Bài 14. Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại trang 96, 97 SBT Hóa 12 Chân trời sáng tạoĐặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại. Tổng hợp đề thi học kì 2 lớp 12 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Hoá - Sinh - Sử - Địa
Lựa chọn câu để xem lời giải nhanh hơn
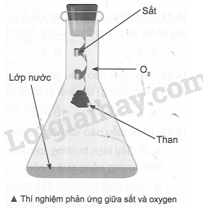
14.1 Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là A. 1s22s22p63s1. B. 1s22s22p63s2. C. 1s22s32p63s2. D. 1s22s22p73s1. Phương pháp giải: Dựa vào nguyên tắc viết cấu hình electron. Lời giải chi tiết: Cấu hình electron của nguyên tử Mg: 1s22s22p63s2. Đáp án B 14.2 Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s1. Số hiệu nguyên tử của nguyên tố X là A. 11. B. 12. C. 13. D. 14. Phương pháp giải: Dựa vào cấu hình electron. Lời giải chi tiết: Cấu hình electron của X là: 1s22s22p63s1 Đáp án A 14.3 Kim loại có những tính chất vât lí chung nào sau đây? A. Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao. B. Tính dẻo, tính dẫn điện, có khối lượng riêng lớn và có ánh kim. C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim. D. Tính dẻo, có ánh kim, rất cứng. Phương pháp giải: Dựa vào tính chất vật lí chung của kim loại. Lời giải chi tiết: Kim loại có tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim. Đáp án C 14.4 Các tính chất vật lí chung của kim loại gây nên chủ yếu bởi A. các electron tự do trong mạng tinh thể. B. các ion kim loại. C. các electron hoá trị. D. các kim loại đều là chất rắn Phương pháp giải: Dựa vào tính chất vật lí chung của kim loại. Lời giải chi tiết: Các tính chất vật lí chung của kim loại gây nên chủ yếu bởi các electron tự do trong mạng tinh thể. Đáp án A 14.5 Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là A. W. B. Cr. C. Hg. D. Pb. Phương pháp giải: Dựa vào tính chất vật lí riêng của kim loại. Lời giải chi tiết: Kim loại duy nhất ở thể lỏng là Hg. Đáp án C 14.6 Kim loại nào sau đây tan hoàn toàn trong nước? A. Cu. B. Ag. C. K. D. Au. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Các kim loại mạnh như Na, K, Ca, Ba có thể tan hoàn toàn trong nước. Đáp án C 14.7 Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo thành dung dịch có môi trường kiềm là A. Na, Fe, K. B. Na, Cr, K. C. Na, Ba, K. D. Mg, Na, Ca. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Các kim loại mạnh như Na, K, Ca, Ba có thể tan hoàn toàn trong nước. Đáp án C 14.8 Trong các kim loại Na, Ca, K, Al, Fe, Cu và Zn, số kim loại tan tốt trong dung dịch KOH là A. 3. B. 4. C. 5. D. 6. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Các kim loại có khả năng tan trong nước có thể tan tốt trong dung dịch KOH hoặc có thể tan trong dung dịch base: Na, Ca, K, Al, Zn. Đáp án C 14.9 Thí nghiệm nào sau đây không sinh ra đơn chất? A. Cho CaCO3 vào lượng dư dung dịch HCl. B. Cho kim loại Cu vào dung dịch AgNO3. C. Cho kim loại Zn vào dung dịch CuSO4. D. Cho kim loại Mg vào dung dịch HCl. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Phản ứng A sinh ra khí CO2, muối CaCl2 và H2O. Phản ứng B sinh ra muối Cu(NO3)2 và Ag. Phản ứng C sinh ra muối ZnSO4 và Cu Phản ứng D sinh ra muối MgCl2 và H2. Đáp án A 14.10 Cho dãy các kim loại: Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Các kim loại đứng trước H tan tốt trong dung dịch H2SO4 loãng: Al, Fe Đáp án B 14.11 Cho dãy các kim loại: Fe, Cu, Mg, Ag, Al, Na, Ba. Số kim loại trong dãy phản ứng được với dung dịch HCl là A. 3. B. 4. C. 5. D. 6. Phương pháp giải: Các kim loại đứng trước H tan tốt trong dung dịch acid. Lời giải chi tiết: Các kim loại: Fe, Mg, Al, Na, Ba Đáp án C 14.12 Kim loại nào sau đây khi tác dụng với HCl và tác dụng với Cl2 (được nung nóng) tạo thành cùng một sản phẩm muối chloride? A. Fe. B. Ag. C. Zn. D. Cu. Phương pháp giải: Dựa vào tính chất hóa học của kim loại Lời giải chi tiết: Zn khi tác dụng với HCl tạo ra ZnCl2 và tác dụng với Cl2 cũng sinh ra ZnCl2. Loại Fe vì Fe tác dụng với HCl tạo muối sắt (II) chloride; tác dụng với Cl2 tạo muối sắt (III) chloride. Loại Ag, Cu vì không phản ứng HCl. Đáp án C 14.13 Phát biểu nào sau đây là đúng? A. Ở điều kiện thường, các kim loại đều có khối lượng riêng lớn hơn khối lượng riêng của nước. B. Tính chất hoá học đặc trưng của kim loại là tính khử. C. Các kim loại đều chỉ có một oxi hoá duy nhất trong các hợp chất. D. Ở điều kiện thường, tất cả các kim loại đều ở trạng thái rắn. Phương pháp giải: Dựa vào tính chất hóa học của kim loại Lời giải chi tiết: A sai, vì kim loại IA có khối lượng riêng nhẹ hơn nước. B đúng C. sai, các kim loại có thể có nhiều số oxi hóa trong các hợp chất. D sai, thủy ngân ở thể lỏng. Đáp án B 14.14 Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hoá học là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Fe có thể phản ứng với: FeCl3, Cu(NO3)2, AgNO3. Đáp án C 14.15 X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y có thể là A. Ag, Mg. B. Cu, Fe. C. Fe, Cu. D. Mg, Ag. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: X là Fe và Y là Cu. Vì theo thế điện cực chuẩn của kim loại Cu có thể đẩy được Fe3+ ra khỏi dung dịch muối. Đáp án C 14.16 Cho một lá sắt nhỏ vào dung dịch chứa một trong những muối sau: CuSO4, AlCl3, Pb(NO3)2, ZnCl2, KNO3, AgNO3. Viết phương trình hoá học của các phản ứng xảy ra (nếu có). Cho biết vai trò của các chất tham gia phản ứng. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Fe + CuSO4 → FeSO4 + Cu Fe là chất khử, CuSO4 là chất oxi hoá Fe + AlCl3 → không phản ứng Fe + Pb(NO3)2 → Fe(NO3)2 + Pb Fe là chất khử, Pb(NO3)2 là chất oxi hoá Fe + ZnCl2 → không phản ứng Fe + KNO3 → không phản ứng Fe + 2AgNO3 → Fe(NO3)2 + 2Ag Fe là chất khử, AgNO3 là chất oxi hoá Nếu AgNO3 dư: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag 14.17 Hãy giới thiệu phương pháp để làm sạch kim loại sắt có lẫn tạp chất nhôm. Giải thích phương pháp được lựa chọn, viết phương trình hoá học của các phản ứng xảy ra (nếu có). Phương pháp giải: Dựa vào tính chất hóa học của kim loại Lời giải chi tiết: - Phương pháp vật lí: Dùng nam châm hút sắt để tách lấy riêng sắt. - Phương pháp hoá học: Hoà tan hỗn hợp trong dung dịch NaOH dư, kim loại nhôm tan tạo thành dung dịch và còn lại sắt không phản ứng. Lọc bỏ dung dịch, thu được kim loại sắt. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 14.18 Cho Cu tác dụng với dung dịch Fe2(SO4)3 thu được dung dịch hỗn hợp gồm hai chất tan là FeSO4 và CuSO4. Cho vào dung dịch thu được một ít bột sắt thì thấy bột sắt bị hoà tan. Viết phương trình hoá học của các phản ứng xảy ra. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Fe + Fe2(SO4)3 → 3FeSO4 14.19 Sodium và potassium là hai kim loại kiềm có tính khử mạnh. Hãy đề xuất cách bảo quản hai kim loại này. Giải thích Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Ngâm trong dầu hoả để tránh cho sodium và potassium không phản ứng với hơi nước và oxygen trong không khí. 14.20 Khi thực hiện thí nghiệm về phản ứng giữa sắt và oxygen, người ta thường cho một ít nước vào trong bình tam giác chứa khí oxygen và cột mẩu than lên thanh dây sắt (như hình bên). Hãy cho biết vai trò của lớp nước dưới đáy bình và mẩu than. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: Lớp nước giúp tránh làm vỡ bình vì phản ứng toả nhiệt mạnh. Mẩu than gỗ có tác dụng làm mồi lửa vì khi than cháy toả nhiệt lượng đủ lớn để phản ứng giữa Fe và O2 xảy ra (có thể thay mẩu than bằng que diêm).
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|