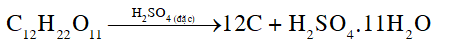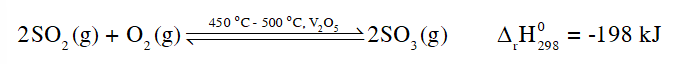Bài 7. Sulfuric acid và muối sulfate trang 40, 41, 42, 43, 44, 45 Hóa học 11 Chân trời sáng tạoSulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Sản lượng sulfuric acid của một quốc gia là một trong những chỉ số đánh giá sức mạnh công nghiệp hoá chất của quốc gia đó. Sulfuric acid có tính chất và ứng dụng gì trong đời sống? Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 40 MĐ Video hướng dẫn giải Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Sản lượng sulfuric acid của một quốc gia là một trong những chỉ số đánh giá sức mạnh công nghiệp hoá chất của quốc gia đó. Sulfuric acid có tính chất và ứng dụng gì trong đời sống? Phương pháp giải: Sulfuric acid có công thức là H2SO4. Dung dịch sulfuric acid loãng là một acid mạnh, thể hiện đầy đủ tính chất hóa học của một acid. Dung dịch acid sulfuric đặc ngoài là một acid mạnh còn có tính oxi hóa. Dựa vào các tính chất của sulfuric acid, người ta sử dụng sulfuric acid trong nhiều lĩnh vực. Lời giải chi tiết: - Tính chất của sulfuric acid: + Tính chất vật lí: chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (H2SO4 98% có khối lượng riêng là 1,84 g/mL), + Tính chất hóa học: • Dung dịch sulfuric acid loãng là một trong các acid mạnh và có đầy đủ tính chất của acid: Đổi màu quỳ tím thành đỏ. Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học. Tác dụng với basic oxide và base. Tác dụng với nhiều muối. • Dung dịch sulfuric acid đặc có tính oxi hoá mạnh và tính háo nước. - Ứng dụng: dùng trong sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu,... CH tr 40 CH Quan sát Hình 7.1 nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi. Phương pháp giải: - Quan sát Hình 7.1 để trả lời được tính chất vật lí của sulfuric acid (màu, trạng thái). - Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết. Liên kết hydrogen thường được biểu diễn bằng dấu ba chấm (…). Các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do tạo được liên kết hydrogen liên phân tử và tan tốt hơn trong nước do tạo được liên kết hydrogen với các phân tử nước. Lời giải chi tiết: - Ở điều kiện thường sulfuric acid là một chất lỏng không màu. - Trong phân tử sulfuric acid tồn tại liên kết hydrogen liên phân tử hình thành từ nguyên tử H linh động và nguyên tử O. Do đó ở điều kiện thườn, sulfuric acid không bay hơi. CH tr 41 CH1 Video hướng dẫn giải Quan sát Hình 7.2, mô tả cấu tạo phân tử của H2SO4. Phương pháp giải: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Liên kết cộng hóa trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện. Lời giải chi tiết: Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O. CH tr 41 CH2 Video hướng dẫn giải Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O. Phương pháp giải: Dung dịch sulfuric acid loãng là một trong các acid mạnh và có đầy đủ tính chất của acid: + Đổi màu quỳ tím thành đỏ. + Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học. + Tác dụng với basic oxide và base. + Tác dụng với nhiều muối. Lời giải chi tiết: - Hình 7.3 a) Phản ứng giữa sulfuric acid với barium hydroxide + Hiện tượng: Xuất hiện kết tủa trắng BaSO4. + Phương trình: H2SO4 + Ba(OH)2 → BaSO4 + 2H2O - Hình 7.3 b) Phản ứng giữa sulfuric acid với sodium carbonate + Hiện tượng: Sủi bọt khí CO2. + Phương trình: H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O CH tr 41 TN1 Thí nghiệm 1. Phản ứng của dung dịch H2SO4 đặc, nóng với Cu Dụng cụ: ống nghiệm, kẹp ống nghiệm, đèn cồn. Hoá chất: dung dịch H2SO4 đặc, dung dịch NaOH, mảnh đồng, bông. Tiến hành: Cho khoảng 2 mL dung dịch H2SO4 đặc vào ống nghiệm. Cho một mảnh đồng vào ống nghiệm, đun nóng nhẹ trên ngọn lửa đèn cồn. Dùng bông tẩm dung dịch NaOH đậy trên miệng ống nghiệm. Quan sát và mô tả hiện tượng xảy ra. Phương pháp giải: Dung dịch sulfuric acid đặc có tính oxi hoá mạnh. Lời giải chi tiết: Hiện tượng: Mảnh đồng tan dần, xuất hiện khí không màu, dung dịch sau phản ứng có màu xanh. CH tr 41 TN2 Thí nghiệm 2. Phản ứng của dung dịch H2SO4 đặc với đường Dụng cụ: cốc thuỷ tinh. Hoá chất: dung dịch H2SO4 đặc, đường tinh luyện. Tiến hành: Cho một thìa nhỏ đường vào cốc thuỷ tinh. Nhỏ vài giọt dung dịch H2SO4 đặc vào cốc. Quan sát và mô tả hiện tượng xảy ra. Phương pháp giải: Dung dịch sulfuric acid đặc có tính háo nước. Lời giải chi tiết: Hiện tượng: Đường kính dần dần hoá thành chất rắn màu đen, sau đó trong cốc sủi bọt đẩy chất rắn màu đen trào ra ngoài cốc. CH tr 41 CH1 Viết quá trình oxi hoá và quá trình khử trong phản ứng của H2SO4 đặc với Cu ở Thí nghiệm 1. Phương pháp giải: - Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm. - Chất khử thực hiện quá trình oxi hóa, chất oxi hóa thực hiện quá trình khử. Lời giải chi tiết:
CH tr 41 CH2 Giải thích hiện tượng xảy ra trong Thí nghiệm 2. Phương pháp giải: Dung dịch sulfuric acid đặc có tính háo nước. Lời giải chi tiết: Đường kính bị sulfuric acid đặc hút nước tạo ra chất rắn màu đen là carbon. Một phần carbon sinh ra tiếp tục bị oxi hoá bởi sulfuric acid tạo thành khí CO2 và SO2 , đẩy carbon trào ra ngoài cốc.
CH tr 43 CH1 Video hướng dẫn giải Quan sát Hình 7.5, mô tả cách pha loãng sulfuric acid. Giải thích. Phương pháp giải: Sulfuric acid 98% có khối lượng riêng là 1,84 g/cm3, nước có khối lượng riêng là 1 g/cm3. Sulfuric acid tan trong nước và tỏa nhiều nhiệt. Lời giải chi tiết: Vì sulfuric acid 98% có khối lượng riêng là 1,84 g/cm3, nước có khối lượng riêng là 1 g/cm3, do đó sulfuric acid đặc nặng hơn nước, nếu đổ nước vào acid, nước nhẹ hơn nên nổi ở trên, một phần nước hòa tan với acid, tỏa lượng nhiệt lớn, làm phần nước còn lại sôi và bắn ra ngoài kèm theo các hạt acid, gây nguy hiểm cho người pha. Vậy nên cách pha đúng là đổ từ từ sulfuric acid đặc vào nước. CH tr 43 CH2 Hãy nêu nguyên tắc chung trong việc xử lí sơ bộ khi bỏng acid. Phương pháp giải: Dung dịch sulfuric acid đặc có tính háo nước và oxi hóa mạnh. Khi acid tác động lên cơ thể, acid phá hủy cấu trúc mô như da, mỡ, gân, cơ… gây hoại tử từ ngoài vào trong theo cơ chế đông vón protein của cơ thể. Bỏng sulfuric acid có thể dẫn tới nhiễm trùng máu nếu xử lí không đúng trong bước sơ cứu. Vì vậy, chỉ nên dùng nước sạch để sơ cứu và đưa người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị. Lời giải chi tiết: Khi bị bỏng acid, cần nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay bằng nước sạch khoảng 20 phút. Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị. CH tr 43 CH3 Hãy giải thích vì sao ở giai đoạn tạo ra SO2 người ta chọn điều kiện phản ứng ở nhiệt độ cao (450 °C - 500 °C). Phương pháp giải: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Khi tăng nhiệt độ, tốc độ phản ứng tăng. Lời giải chi tiết:
CH tr 43 CH4 Hãy cho biết giai đoạn nào trong quá trình sản xuất H2SO4 có nguy cơ cao gây ô nhiễm môi trường. Giải thích. Phương pháp giải:
Lời giải chi tiết: Sản xuất sulfur dioxide (SO2) có nguy cơ cao gây ô nhiễm môi trường. Vì những nguyên nhân sau: + Việc khai thác nguyên liệu (sulfur hoặc quặng pyrite sắt) tiềm ẩn nhiều nguy cơ gây ô nhiễm môi trường (như xói mòn, sụt đất, mất đa dạng sinh học, ô nhiễm đất, nước ngầm và nước mặt do hóa chất từ chế biến quặng). + Việc đốt nguyên liệu (sulfur hoặc quặng pyrite sắt) cần một lượng lớn nhiên liệu, khí thải khi đốt các nhiên liệu này gây ô nhiễm môi trường. + Trong quá trình sản xuất làm thất thoát SO2 ra môi trường cũng là một trong những nguyên nhân gây ô nhiễm môi trường (như mưa acid). CH tr 44 CH1 Video hướng dẫn giải Nếu ứng dụng trong đời sống, sản xuất của một số muối sulfate mà em biết. Phương pháp giải: Muối sulfate là muối của sulfuric acid, có chứa ion . Muối sulfate có nhiều ứng dụng trong đời sống như chất phụ gia, bột màu, muối tắm, thuốc trừ sâu, phân bón,… Lời giải chi tiết: Muối sulfate có nhiều ứng dụng trong đời sống và sản xuất. - Calcium sulfate (CaSO4) được dùng trong sản xuất vật liệu xây dựng; làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non; ... - Barium sulfate (BaSO4) được sử dụng như một loại bột màu làm phụ gia pha màu cho công nghiệp sơn; cho thuỷ tinh, cho gốm sứ cách điện và cao su chất lượng cao, ... - Magnesium sulfate (MgSO4) được sử dụng sản xuất muối tắm; làm giảm dịu cơ bắp khi sưng tấy cho con người; bổ sung magnesium cho tôm, cá, động vật thuỷ sinh khác; ... - Ammonium sulfate (NH4)2SO4 là thành phần của thuốc trừ sâu hoà tan, thuốc diệt nấm; phân bón, sử dụng kết hợp với chlorine để tạo monochloramine để khử trùng trong nước uống CH tr 44 CH2 Quan sát Hình 7.6, trình bày cách nhận biết ion . Nêu hiện tượng xảy ra, viết phương trình hoá học.’ Phương pháp giải: Để nhận biết anion ta sử dụng cation Ba2+ tạo kết tủa trắng BaSO4 Lời giải chi tiết:
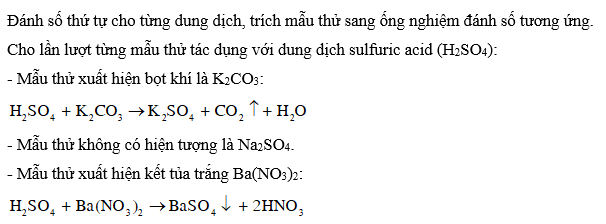
CH tr 45 CH1 Video hướng dẫn giải Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc? A. Tính háo nước. B. Tính oxi hoá. C. Tính acid. D. Tính khử. Phương pháp giải: Dung dịch sulfuric acid đặc có tính acid mạnh, tính oxi hoá mạnh và tính háo nước. Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm. Lời giải chi tiết: Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6. Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy trong phản ứng oxi hóa khử H2SO4 đặc không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa. → Chọn D. CH tr 45 CH2 Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6. Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy trong phản ứng oxi hóa khử H2SO4 đặc không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa. → Chọn D. Phương pháp giải: Cách nhận biết ion : Sử dụng cation Ba2+ (trong dung dịch muối barium hoặc barium hydroxide) Lời giải chi tiết: Vì muối MgSO4 là muối tan nên không nhận biết được anion bằng cation Mg2+. Dung dịch K2SO4 không phản ứng với dung dịch MgCl2 (không thỏa mãn điều kiện của phản ứng trao đổi). → Chọn D. CH tr 45 CH3 Dung dịch sulfuric acid đặc được dùng làm khô khí nào trong số các khí sau: CO, H2, CO2, SO2, O2 và NH3? Giải thích. Phương pháp giải: Để sử dụng dung dịch sulfuric acid đặc làm khô khí, khí cần làm khô không được phản ứng với sulfuric acid đặc. Dung dịch sulfuric acid đặc có tính acid mạnh, tính oxi hoá mạnh nên khí cần làm khô phải là khí không có tính base và không có tính khử. Lời giải chi tiết: Trong các khí trên: + Khí có tính khử là: CO, H2. + Khí có tính base là: NH3. Vì dung dịch sulfuric acid đặc có tính acid mạnh, tính oxi hoá mạnh nên các khí có tính base và tính khử sẽ phản ứng với sulfuric acid đặc. Vậy các khí có thể làm khô bằng sulfuric acid đặc là CO2, SO2, O2. CH tr 45 CH4 Cho các dung dịch không màu của mỗi chất sau: K2CO3, Na2SO4, Ba(NO3)2. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra. Phương pháp giải: Cách nhận biết ion : Sử dụng cation Ba2+ (trong dung dịch muối barium hoặc barium hydroxide) Lời giải chi tiết:
cH tr 45 CH5 Có 4 mẫu sau: dung dịch NaOH, dung dịch HCl, dung dịch H2SO4 và H2O được kí hiệu bằng các chữ cái: A, B, C và D (không theo trình tự trên). Kết quả của những thí nghiệm nhận biết những mẫu này được ghi trong bảng sau:
Hãy cho biết A, B, C và D là kí hiệu của những chất nào. Giải thích và viết phương trình hóa học của các phản ứng xảy ra. Phương pháp giải: - Cách nhận biết ion : Sử dụng cation Ba2+ (trong dung dịch muối barium hoặc barium hydroxide). - Acid làm quỳ tím hóa đỏ, base làm quỳ tím hóa xanh. Lời giải chi tiết: - Chất A làm quỳ tím hóa đỏ, chứng tỏ A là acid (A có thể là dung dịch HCl hoặc dung dịch H2SO4). Chất A còn tạo kết tủa trắng với dung dịch BaCl2, vậy A là dung dịch H2SO4. H2SO4 + BaCl2 → BaSO4 + 2HCl - Chất B làm quỳ tím hóa xanh, chứng tỏ B là base. Vậy B là NaOH. - Chất C không làm quỳ tím đổi màu, chứng tỏ B có môi trường trung tính. Vậy B là H2O. - Chất D làm quỳ tím hóa đỏ, chứng tỏ D là acid còn lại, không tạo kết tủa với BaCl2. Vậy D là HCl. Lý thuyết >> Xem chi tiết: Lý thuyết Sulfuric acid và muối sulfate - Hóa học 11 - Chân trời sáng tạo CH tr 42 Viết phương trình hoá học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2 Phương pháp giải: Dựa vào tính chất hoá học của H2SO4 đặc Lời giải chi tiết: H2SO4+C→CO2+2SO2+H2O2H2SO4+2KBr→K2SO4+SO2+Br2+2H2O
>> 2K8! chú ý! Mở đặt chỗ Lộ trình Sun 2026: Luyện thi chuyên sâu TN THPT, Đánh giá năng lực, Đánh giá tư duy tại Tuyensinh247.com (Xem ngay lộ trình). Ưu đãi -70% (chỉ trong tháng 3/2025) - Tặng miễn phí khoá học tổng ôn lớp 11, 2K8 xuất phát sớm, X2 cơ hội đỗ đại học. Học thử miễn phí ngay.
|
|||||||||||||||||||||||||