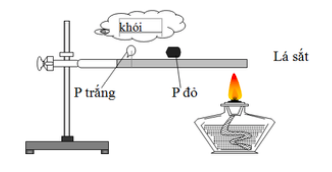
Giải đề thi kì 1 hoá lớp 11 năm 2019 - 2020 trường THPT Nguyễn Tất ThànhGiải chi tiết đề thi kì 1 môn hoá lớp 11 năm 2019 - 2020 trường THPT Nguyễn Tất Thành với cách giải nhanh và chú ý quan trọng PHẦN I: TRẮC NGHIỆM (3 điểm) Câu 1. Một loại tro thực vật được dùng làm phân kali, có chứa 68,31% K2CO3 về khối lượng (còn lại là các tạp chất không chứa kali). Độ dinh dưỡng của loại phân bón này là A. 38,61%. B. 46,53%. C. 56,52%. D. 68,12%. Câu 2: Kim loại nào sau đây tác dụng được với dung dịch HCl và dung dịch HNO3 đặc, nguội? A. Zn B. Fe C. Al D. Ag Câu 3: Sản phẩm của phản ứng nhiệt phân hoàn toàn AgNO3 là: A. Ag2O, NO2, O2. B. Ag, NO, O2. C. Ag2O, NO, O2. D. Ag, NO2, O2. Câu 4: Nguyên tắc chung của phép phân tích định tính là: A. Chuyển hóa các nguyên tố C, H, N,… thành các chất vô cơ dễ nhận biết. B. Đốt cháy hợp chất hữu cơ để tìm hiđro do có hơi nước thoát ra. C. Đốt cháy hợp chất hữu cơ để tìm cacbon dưới dạng muội đen. D. Đốt cháy hợp chất hữu cơ để tìm nitơ do có mùi khét. Câu 5: Dãy chất nào sau đây đều là hợp chất hữu cơ ? A. (NH4)2CO3, CO2, CH4, C2H6. B. C2H4, CH4, C2H6O, C3H9N. C. CO2, K2CO3, NaHCO3, C2H5Cl. D. NH4HCO3, CH3OH, CH4, CCl4. Câu 6: CO là khí không màu, không mùi, rất độc. Để phòng nhiễm độc CO người ta dùng mặt nạ phòng độc có chứa A. than đá. B. than bùn. C. than cốc. D. than hoạt tính. Câu 7: Công thức CaCO3 tương ứng với thành phần hoá học chính của loại đá nào sau đây? A. Đá đỏ. B. Đá vôi. C. Đá mài. D. Đá tổ ong. Câu 8: Phản ứng nào sau đây không xảy ra? A. CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2 B. 2NaHCO3 \(\xrightarrow{{{t^o}}}\) Na2CO3 + CO2 + H2O C. MgCO3 \(\xrightarrow{{{t^o}}}\) MgO + CO2 D. Na2CO3 \(\xrightarrow{{{t^o}}}\) Na2O + CO2 Câu 9: Trong dung dịch, muối nào sau đây dễ bị phân hủy khi đun nóng? A. Ca(HCO3)2. B. Na2SO4. C. CaCl2. D. NaCl. Câu 10: Một nhóm học sinh thực hiện thí nghiệm cho kim loại Cu tác dụng với dung dịch HNO3 đặc. Hiện tượng quan sát nào sau đây là đúng? A. Khí không màu thoát ra, dung dịch chuyển sang màu xanh. B. Khí màu nâu đỏ thoát ra, dung dịch không màu. C. Khí màu nâu đỏ thoát ra, dung dịch chuyển sang màu xanh. D. Khí không màu thoát ra, dung dịch không màu. Câu 11: Đặt P trắng và P đỏ trên lá sắt và đốt bằng đèn cồn theo sơ đồ thí nghiệm dưới đây:
Sau một thời gian, người ta thấy P trắng bốc cháy trong không khí. Thí nghiệm này chứng tỏ A. khả năng bốc cháy của P trắng dễ hơn P đỏ. B. khả năng bay hơi của P trắng dễ hơn P đỏ. C. khả năng bốc cháy của P đỏ dễ hơn P trắng. D. khả năng bay hơi của P đỏ dễ hơn P trắng. Câu 12: Cho 300 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 1M. Muối thu được sau phản ứng là A. NaH2PO4. B. NaH2PO4 và Na2HPO4. C. Na2HPO4 và Na3PO4. D. Na3PO4. PHẦN II: TỰ LUẬN (7 điểm) Câu 13: (3 điểm) 1. Nêu hiện tượng quan sát được khi nhỏ dung dịch HCl từ từ đến dư vào dung dịch Na2CO3. Viết phản ứng hóa học tương ứng. 2. Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp gồm Al2O3, Fe2O3 và CuO. Sau khi phản ứng hoàn toàn, thu được chất rắn X và khí Y. Dẫn Y vào nước vôi trong dư thu được kết tủa trắng. Viết các phương trình hóa học và xác định các chất trong X và Y. Câu 14: (3,5 điểm) 1. Từ ơgenol (trong tinh dầu hương nhu) điều chế được metylơgenol (M = 178 g/mol) là chất dẫn dụ côn trùng. Kết quả phân tích nguyên tố của metylơgenol cho thấy % khối lượng của các nguyên tố như sau: %C = 74,16%; %H = 7,86%, còn lại là oxi. Xác định CTPT của metylơgenol. 2. Hoà tan hoàn toàn 8,4 gam Fe vào dung dịch HNO3 đặc nóng, dư thu được V lít (đktc) khí NO2 duy nhất. Tính V. Câu 15: (0,5 điểm) Cho 5 gam bột Mg vào dung dịch hỗn hợp KNO3 và H2SO4, đun nhẹ, trong điều kiện thích hợp, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa m gam muối; 1,792 lít hỗn hợp khí Y (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của Y đối với H2 là 11,5. Tính m?
-----------------------HẾT-----------------------
Hướng dẫn giải chi tiết Thực hiện: Ban chuyên môn HocTot.Nam.Name.Vn PHẦN I: TRẮC NGHIỆM Câu 1 (VD): Phương pháp: + Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % K2O tương ứng với lượng kali có trong phân đó. + Tính khối lượng K2CO3 có trong phân bón, từ đó tính được số mol của K2CO3 + Áp dụng bảo toàn nguyên tố K để tìm được số mol của K2O, từ đó tính được khối lượng của K2O + Tính % khối lượng của K2O và kết luận Cách giải: Giả sử có 100 gam phân bón \( \to {m_{{K_2}C{O_3}}} = 68,31\% .100 = 68,31\,\,gam \to {n_{{K_2}C{O_3}}} = \frac{{68,31}}{{138}} = 0,495\,\,mol\) Bảo toàn nguyên tố K: \(2{n_{{K_2}O}} = 2{n_{{K_2}C{O_3}}} \to {n_{{K_2}O}} = {n_{{K_2}C{O_3}}} = 0,495\,\,mol\) \( \to {m_{{K_2}O}} = 0,495.94 = 46,54\,\,gam\) Độ dinh dưỡng = \(\% {m_{{K_2}O}} = \frac{{46,53}}{{100}}.100\% = 46,53\% \) Chọn B. Câu 2 (TH): Phương pháp: Các kim loại đứng trước H trong dãy hoạt động hóa học có khả năng tham gia phản ứng với HCl Al, Fe, Cr bị thụ động hóa trong HNO3 đặc, nguội và H2SO4 đặc, nguội. Cách giải: Đáp án A \(Zn + 2HCl \to ZnC{l_2} + {H_2}\) \(Zn + 4HN{O_3} \to Zn{(N{O_3})_2} + 2N{O_2} + 2{H_2}O\) Đáp án B. \(F{\text{e}} + 2HCl \to F{\text{e}}C{l_2} + {H_2}\) Fe không phản ứng với HNO3 đặc, nguội Đáp án C. \(2{\text{A}}l + 6HCl \to 2AlC{l_3} + 3{H_2}\) Al không phản ứng với HNO3 đặc, nguội Đáp án D. Ag không phản ứng với HCl \(Ag + 2HN{O_3} \to AgN{O_3} + N{O_2} + {H_2}O\) Chọn A. Câu 3 (NB): Phương pháp: - Muối nitrat của kim loại đứng trước Mg \(2M{(N{O_3})_n}\xrightarrow{{{t^0}}}2M{(N{O_2})_n} + n{O_2}\) - Muối nitrat của kim loại từ Mg đến Cu \(4M{(N{O_3})_n}\xrightarrow{{{t^0}}}2{M_2}{O_n} + 4nN{O_2} + n{O_2}\) - Muối nitrat của kim loại đứng sau Cu \(2M{(N{O_3})_n}\xrightarrow{{{t^0}}}2M + 2nN{O_2} + n{O_2}\) Cách giải: PTHH: \(2AgN{O_3}\xrightarrow{{{t^0}}}2Ag + 2N{O_2} + {{\text{O}}_2}\) Vậy sản phẩm của phản ứng nhiệt phân AgNO3 là Ag, NO2 và O2. Chọn D. Câu 4 (NB): Phương pháp: - Nguyên tắc của phương pháp phân tích định tính: Chuyển các nguyên tố trong hợp chất hữu cơ thành chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng. - Nguyên tắc của phương pháp phân tích định lượng: Cân chính xác khối lượng hợp chất hữu cơ, sau đó chuyển nguyên tố C thành CO2, H thành H2O, N thành N2, sau đó xác định chính xác khối lượng hoặc thể tích của các chất tạo thành, từ đó tính % khối lượng các nguyên tố. Cách giải: Nguyên tắc của phương pháp phân tích định tính: Chuyển các nguyên tố trong hợp chất hữu cơ thành chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng. Chọn A. Câu 5 (TH): Phương pháp: Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua,…) Cách giải: Đáp án A: (NH4)2CO3 và CO2 là hợp chất vô cơ Đáp án C: CO2, K2CO3, NaHCO3 là hợp chất vô cơ Đáp án D: NH4HCO3 là hợp chất vô cơ Chọn B. Câu 6 (TH): Phương pháp: Than hoạt tính có khả năng hấp phụ các chất trong không khí, trong dung dịch nên được ứng dụng để làm mặt nạ phòng độc, lõi lọc nước,… Cách giải: Để phòng nhiễm độc CO người ta dùng mặt nạ phòng độc có chứa than hoạt tính. Chọn D. Câu 7 (NB): Phương pháp: Canxi cacbonat tương ứng với thành phần hóa học chính của đá vôi. Cách giải: Đá vôi có thành phần hóa học chính là CaCO3. Chọn B. Câu 8 (NB): Phương pháp: - Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân \(MgC{O_3}\xrightarrow{{{t^0}}}MgO + C{O_2}\) - Tất cả các muối hiđrocacbonat đều bị nhiệt phân \(2HCO_3^ - \xrightarrow{{{t^0}}}CO_3^{2 - } + C{O_2} + {H_2}O\) Cách giải: Na2CO3 là muối cacbonat tan nên không bị nhiệt phân Chọn D. Câu 9 (NB): Phương pháp: - Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân \(MgC{O_3}\xrightarrow{{{t^0}}}MgO + C{O_2}\) - Tất cả các muối hiđrocacbonat đều bị nhiệt phân \(2HCO_3^ - \xrightarrow{{{t^0}}}CO_3^{2 - } + C{O_2} + {H_2}O\) Cách giải: PTHH: \(Ca{(HC{O_3})_2}\xrightarrow{{{t^0}}}CaC{{\text{O}}_3} + C{O_2} + {H_2}O\) Chọn A. Câu 10 (TH): Phương pháp: PTHH tổng quát: kim loại + HNO3 ---> muối + sản phẩm khử + H2O HNO3 đặc cho sản phẩm khử là NO2 (khí màu nâu đỏ) Cách giải: \(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2N{O_2} + 4{H_2}O\) Khí NO2 thoát ra có màu nâu đỏ Dung dịch muối Cu(NO3)2 có màu xanh Chọn C. Câu 11 (TH): Phương pháp: P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử, còn P đỏ có cấu trúc polime) Cách giải: Thí nghiệm chứng tỏ khả năng bốc cháy của P trắng dễ hơn P đỏ. Chọn A. Câu 12 (VD): Phương pháp: Xét tỷ lệ \(\frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = T\) + Nếu \(T \leqslant 1\), phản ứng chỉ tạo muối NaH2PO4 + Nếu 1 < T < 2, phản ứng tạo muối NaH2PO4 và Na2HPO4 + Nếu T = 2, phản ứng tạo muối Na2HPO4 + Nếu 2 < T < 3, phản ứng tạo muối Na2HPO4 và Na3PO4 + Nếu \(T \geqslant \)3, phản ứng tạo muối Na3PO4 Cách giải: \({n_{NaOH}} = 0,3.1 = 0,3\,\,mol;{n_{{H_3}P{O_4}}} = 0,2.1 = 0,2\,\,mol\) Vì \(1 < \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,3}}{{0,2}} = 1,5 < 2 \to \)phản ứng sinh ra 2 muối NaH2PO4 và Na2HPO4 Chọn B. PHẦN II: TỰ LUẬN Câu 13 (VD): Phương pháp: 1. Khi cho từ từ dung dịch axit vào dung dịch muối cacbonat, phản ứng xảy ra theo từng nấc \({H^ + } + CO_3^{2 - } \to HCO_3^ - \) \({H^ + } + HCO_3^ - \to C{O_2} + {H_2}O\) 2. CO chỉ khử được oxit của kim loại đứng sau Al trong dãy hoạt động hóa học. Cách giải: 1. Khi nhỏ dung dịch HCl từ từ đến dư vào dung dịch Na2CO3, phản ứng xảy ra theo từng nấc \(N{a_2}C{O_3} + HCl \to NaHC{O_3} + NaCl\) \(NaHC{O_3} + HCl \to NaCl + C{O_2} + {H_2}O\) 2. CO chỉ khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học Al2O3 không phản ứng \(3CO + F{{\text{e}}_2}{O_3}\xrightarrow{{{t^0}}}2F{\text{e}} + 3C{O_2}\) \(CO + CuO\xrightarrow{{{t^0}}}Cu + C{O_2}\) Vậy chất rắn X gồm Al2O3, Fe và Cu. Khí Y là CO2 Dẫn khí Y vào nước vôi trong dư \(C{O_2} + Ca{(OH)_2} \to CaC{{\text{O}}_3} + {H_2}O\) Câu 14 (VD): Phương pháp: 1. Tính % khối lượng của Oxi trong metylơgenol + Gọi công thức của metylơgenol là CxHyOz + Ta có: \(x:y:z = \frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% O}}{{16}}\) => Kết luận công thức đơn giản nhất của metylơgenol + Từ phân tử khối của metylơgenol, tìm công thức phân tử của metylơgenol 2. Áp dụng bảo toàn electron cho phản ứng, suy ra số mol của NO2 Từ đó tìm được V. Cách giải: 1. Ta có: %O = 100% - %C - %H = 100% - 74,16% - %7,86% = 17,98% Gọi công thức phân tử của metylơgenol là CxHyOz \(x:y:z = \frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% O}}{{16}} = \frac{{74,16}}{{12}}:\frac{{7,86}}{1}:\frac{{17,98}}{{16}} = 11:14:2\) Vậy công thức đơn giản nhất của metylơgenol là C11H14O2 Mà Mmetylơgenol = 178 => (C11H14O2)n = 178 => (11.12 + 14.1 + 2.16)n = 178 => n = 1 Vậy công thức phân tử của metylơgenol là C11H14O2 2. Ta có: \({{n}_{F\text{e}}}=\dfrac{8,4}{56}=0,15\,\,mol\) Quá trình trao đổi electron Fe0 ----> Fe+3 + 3e N+5 + 1e ----> N+4 Áp dụng bảo toàn electron: ne nhường = ne nhận \( \to 3{n_{Fe}} = {n_{N{O_2}}} \to {n_{N{O_2}}} = 3.0,15 = 0,45\,\,mol\) \( \to {V_{N{O_2}}} = 0,45.22,4 = 10,08\)lít Câu 15 (VDC): Phương pháp: + Kết luận các khí có trong Y và tính số mol mỗi khí trong Y + Áp dụng bảo toàn electron, chứng minh sau phản ứng thu được muối amoni, tính số mol muối amoni. + Tìm số mol các ion K+ và SO42- thông qua H+và NO3- + Áp dụng bảo toàn khối lượng cho dung dịch X và tìm m. Cách giải: Hỗn hợp khí Y gồm NO (x mol) và H2 (y mol) \({n_Y} = \frac{{1,792}}{{22,4}} = 0,08\,\,mol \to x + y = 0,08\)(1) \({{d}_{Y/{{H}_{2}}}}=11,5\to \frac{{{M}_{Y}}}{{{M}_{{{H}_{2}}}}}=11,5\to {{M}_{Y}}=11,5.2=23\) \(\to {{m}_{Y}}=23.0,08=1,84\,\,gam\to 30\text{x}+2y=1,84(2)\) Từ (1) và (2) => x = 0,06 và y =0,02 Ta có mMg phản ứng = 5 – 0,44 = 4,56 gam \( \to {n_{Mg}} = \frac{{4,56}}{{24}} = 0,19\,\,mol\) Quá trình trao đổi electron:
Ta thấy: ne nhường = 2nMg phản ứng = 0,38 mol \( \ne \) ne nhận = \(3{n_{NO}} + 2{n_{{H_2}}} = 3.0,06 + 2.0,02 = 0,22\) => Phản ứng có tạo muối amoni \({n_{NH_4^ + }} = \frac{{2{n_{Mg}} - 3{n_{NO}} - 2{n_{{H_2}}}}}{8} = 0,02\,\,mol\) \({n_{{H^ + }}} = 4{n_{NO}} + 10{n_{NH_4^ + }} + 2{n_{{H_2}}} = 0,48\,\,mol \to {n_{SO_4^{2 - }}} = \frac{1}{2}{n_{{H^ + }}} = 0,24\,\,mol\) \({n_{NO_3^ - }} = {n_{NO}} + {n_{NH_4^ + }} = 0,08\,\,mol \to {n_{{K^ + }}} = {n_{NO_3^ - }} = 0,08\,\,mol\) Dung dịch X chứa Mg2+(0,19 mol), K+ (0,08 mol), \(SO_4^{2 - }(0,24\,\,mol),NH_4^ + (0,02\,\,mol)\) \(\to m = 0,19.24 + 0,08.39 + 0,24.96 + 0,02.18 = 31,08\,\,gam\) HocTot.Nam.Name.Vn
|