Giải đề thi học kì 1 hoá lớp 11 năm 2019 - 2020 trường THPT Trần Hưng ĐạoGiải chi tiết đề thi học kì 1 môn hoá lớp 11 năm 2019 - 2020 trường THPT Trần Hưng Đạo với cách giải nhanh và chú ý quan trọng Câu 1: Dung dịch HNO3 0,01M có giá trị pH là A. 0,01. B. 2. C. 10-2. D. 12. Câu 2: Sản phẩm thu được khi nhiệt phân hoàn toàn muối NH4HCO3 là A. NH3. B. H2O. C. CO2. D. NH3, CO2, H2O. Câu 3: Dãy gồm các ion không tồn tại được trong một dung dịch là A. K+, Ba2+, OH-, Cl-. B. Na+, PO43-, Cl-, NH4+. C. Ca2+, Cl-, Na+, NO3-. D. Na+, NH4+, OH-, HCO3-. Câu 4: Thể tích dung dịch HNO3 1M vừa đủ để trung hòa hết 200 ml NaOH 1M là A. 100 ml. B. 50 ml. C. 200 ml. D. 150 ml. Câu 5: Trộn 100 ml dung dịch H3PO4 1M với 100 ml dung dịch NaOH 1M thu được dung dịch X. Thành phần của dung dịch X là A. Na2HPO4 và Na3PO4. B. NaH2PO4 và H3PO4 dư. C. Na3PO4 và NaOH dư. D. NaH2PO4. Câu 6: Dẫn khí CO qua ống sứ đựng 32 gam Fe2O3 nung nóng, sau một thời gian thu được 25,6 gam chất rắn. Thể tích khí CO (đktc) đã tham gia phản ứng là A. 7,68 lít. B. 2,24 lít. C. 6,72 lít. D. 8,96 lít. Câu 7: Phương trình hóa học CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl có phương trình ion rút gọn là A. CuCl2 + 2OH- → Cu(OH)2 + 2Cl-. B. CuCl2 + 2Na+ → Cu2+ + 2NaCl. C. Cu2+ + 2OH- → Cu(OH)2. D. Na+ + Cl- → NaCl. Câu 8: Cho 100 ml NaOH 2M phản ứng hết với dung dịch NH4Cl dư thu được V lít khí (đktc). Giá trị của V là A. 4,48. B. 6,72. C. 2,24. D. 8,96. Câu 9: Dẫn 1,12 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư, khối lượng kết tủa thu được là A. 4,0 gam. B. 1,0 gam. C. 5,0 gam. D. 3,0 gam. Câu 10: Trong các kim loại Mg, Al, Cu, Fe. Số kim loại bị oxi hóa bởi HNO3 đặc nguội là A. 1. B. 2. C. 3. D. 4. Câu 11: Trong các nhận xét dưới đây, nhận xét nào không đúng? A. Phân đạm cung cấp nitơ hóa hợp cho cây dưới dạng ion nitrat NO3- và ion amoni NH4+. B. Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng. C. Trong tự nhiên, photpho có ở dạng tự do. D. Trong y học Nabica (NaHCO3) là chất được dùng làm thuốc giảm đau dạ dày. Câu 12: Chất nào dưới đây là chất điện li mạnh? A. BaSO4. B. HCl. C. H2O. D. Cu(OH)2. Câu 13: Cho các axit: (1) HNO3, (2) H3PO4, (3) H2CO3, (4) H2SiO3. Dãy các axit được sắp xếp theo chiều tính axit giảm dần là A. 4, 3, 2, 1. B. 3, 4, 1, 2. C. 1, 2, 3, 4. D. 2, 3, 4, 1. Câu 14: Trộn V ml dung dịch NaOH 0,01M với 100 ml hỗn hợp dung dịch HCl 0,01M và H2SO4 0,01M thu được dung dịch X có pH = 2. Giá trị của V là A. 400. B. 200. C. 100. D. 300. Câu 15: Nước đá khô không nóng chảy mà thăng hoa, được dùng để tạo môi trường lạnh không có hơi ẩm, công thức hóa học của nước đá khô là A. CO2. B. N2. C. CO. D. NO2. Câu 16: Thuốc thử để nhận biết ion PO43- trong dung dịch muối photphat là dung dịch A. NaNO3. B. NaOH. C. AgNO3. D. NaCl. Câu 17: Công thức hóa học của muối amoni clorua là A. (NH2)2CO. B. NaCl. C. NH4NO3. D. NH4Cl. Câu 18: Chọn câu trả lời đúng. Trong các phản ứng oxi hóa - khử, nitơ A. chỉ thể hiện tính khử. B. không thể hiện tính khử và tính oxi hóa. C. chỉ thể hiện tính oxi hóa. D. thể hiện tính khử hoặc tính oxi hóa. Câu 19: Trong các phản ứng hóa học sau, phản ứng nào không đúng? A. SiO2 + 4HF → SiF4 + 2H2O. B. 2NH3 + 3Cl2 → 6HCl + N2. C. 2CO + O2 CO2. D. Fe + 2HNO3 loãng → Fe(NO3)2 + 2H2. Câu 20: Để phân biệt các muối NH4Cl, NaNO3, (NH4)2SO4 ta có thể dùng hóa chất sau A. HCl. B. Ba(OH)2. C. NaOH. D. AgNO3. Phần 2: TỰ LUẬN (2,0 điểm) Học sinh làm bài phần tự luận vào giấy kiểm tra. Câu 1 (1,0 điểm): Viết các phương trình hóa học thực hiện dãy biến hóa sau: C → CO2 → NaHCO3 → Na2CO3 → NaCl Câu 2 (1,0 điểm): Hòa tan hoàn toàn 37,8 gam Al bằng dung dịch HNO3 loãng, dư thu được 8,96 lít hỗn hợp khí X (gồm N2O và N2) (đktc) và dung dịch chứa m gam muối. Biết tỉ khối hơi của X so với H2 là 18. Tính m. HƯỚNG DẪN GIẢI CHI TIẾT Thực hiện: Ban chuyên môn HocTot.Nam.Name.Vn PHẦN I: TRẮC NGHIỆM
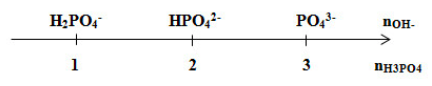
Câu 1 (VD): Phương pháp: - HNO3 là chất điện li mạnh, điện li hoàn toàn thành ion nên từ nồng độ của dung dịch HNO3 xác định được nồng độ của H+. - Công thức tính pH: pH = -log[H+] Cách giải: HNO3 là chất điện li mạnh, điện li hoàn toàn thành ion: \(HN{O_3} \to {H^ + } + N{O_3}^ - \) \( \to {\rm{[}}{H^ + }{\rm{]}} = {C_{M\,\,HN{O_3}}} = 0,01M\) \( \to pH = - \log {\rm{[}}{H^ + }{\rm{]}} = - \log (0,01) = 2\) Chọn B. Câu 2 (TH): Phương pháp: Viết PTHH của phản ứng nhiệt phân NH4HCO3 từ đó xác định các sản phẩm thu được. Cách giải: PTHH: Vậy sản phẩm thu được khi nhiệt phân hoàn toàn muối NH4HCO3 là NH3, H2O, CO2. Chọn D. Câu 3 (TH): Phương pháp: - Các ion cùng tồn tại trong cùng một dung dịch là các ion không phản ứng với nhau. - Điều kiện xảy ra phản ứng trao đổi ion: Các ion phản ứng với nhau khi tạo ít nhất 1 trong 3 loại chất sau: + Kết tủa + Khí + Chất điện li yếu Cách giải: Dãy Na+, NH4+, OH-, HCO3- (phương án D) không cùng tồn tại được trong cùng dung dịch vì có các phản ứng: \(N{H_4}^ + + O{H^ - } \to N{H_3} + {H_2}O\) \(HC{O_3}^ - + O{H^ - } \to C{O_3}^{2 - } + {H_2}O\) Chọn D. Câu 4 (VD): Phương pháp: Tính theo PTHH: \(HN{O_3} + NaOH \to NaN{{\rm{O}}_3} + {H_2}O\) Cách giải: \({n_{NaOH}} = 0,2.1 = 0,2(mol)\) PTHH: \(HN{O_3} + NaOH \to NaN{{\rm{O}}_3} + {H_2}O\) Theo PTHH: \({n_{HN{O_3}}} = {n_{NaOH}} = 0,2(mol)\) \( \to {V_{dd\,HN{O_3}}} = \dfrac{{{n_{HN{O_3}}}}}{{{C_{M\,HN{O_3}}}}} = \dfrac{{0,2}}{1} \\= 0,2(l) = 200(ml)\) Chọn C. Câu 5 (TH): Phương pháp: Dạng bài H3PO4 + OH-: H3PO4 + OH- → H2PO4- + H2O H3PO4 + 2OH- → HPO42- + 2H2O H3PO4 + 3OH- → PO43- + 3H2O Giải thích trục số: Đặt \(\dfrac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} = (*)\) + Nếu (*) < 1 => H3PO4 dư và H2PO4- + Nếu (*) = 1 => H2PO4- + Nếu 1 < (*) < 2 => H2PO4- và HPO42- + Nếu (*) = 2 => HPO42- + Nếu 2 < (*) < 3 => HPO42- và PO43- + Nếu (*) = 3 => PO43- + Nếu (*) > 3 => PO43- và OH‑ dư Cách giải: \({n_{{H_3}P{O_4}}} = 0,1\,(mol);\,\,\,{n_{NaOH}} = 0,1(mol)\) Ta thấy: \(\dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{{0,1}}{{0,1}} = 1\) → Phản ứng chỉ tạo muối NaH2PO4. Chọn D. Câu 6 (VD): Phương pháp: - Khối lượng chất rắn giảm là khối lượng O bị lấy đi → mO phản ứng - Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2 → nCO phản ứng = nO phản ứng Cách giải: Khối lượng chất rắn giảm là khối lượng O bị lấy đi → \({m_{O(pu)}} = 32 - 25,6 = 6,4(g)\) Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2 \( \to {n_{CO(pu)}} = {n_{O(pu)}} = \dfrac{{6,4}}{{16}} = 0,4(mol) \\\to {V_{CO}} = 0,4.22,4 = 8,96(l)\) Chọn D. Câu 7 (TH): Phương pháp: Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn: + Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ. + Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn. Cách giải: Phương trình phân tử: CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl Phương trình ion đầy đủ: Cu2+ 2Cl- + 2Na+ + 2OH- → Cu(OH)2 ↓ + 2Na+ + 2Cl- Phương trình ion rút gọn: Cu2+ + 2OH- → Cu(OH)2 ↓ Chọn C. Câu 8 (VD): Phương pháp: Tính theo PTHH: \(NaOH + N{H_4}Cl \to NaCl + N{H_3} + {H_2}O\) Cách giải: \({n_{NaOH}} = 0,1.2 = 0,2(mol)\) PTHH: \(NaOH + N{H_4}Cl \to NaCl + N{H_3} + {H_2}O\) Theo PTHH: \({n_{N{H_3}}} = {n_{NaOH}} = 0,2(mol) \\\to {V_{N{H_3}}} = 0,2.22,4 = 4,48(l)\) Chọn A. Câu 9 (VD): Phương pháp: Khi cho CO2 tác dụng với Ca(OH)2 dư thì có phản ứng: \(C{O_2} + Ca{(OH)_2} \to CaC{{\rm{O}}_3} + {H_2}O\) Từ số mol của CO2 suy ra số mol của CaCO3. Cách giải: \({n_{C{O_2}}} = \dfrac{{1,12}}{{22,4}} = 0,05(mol)\) Khi cho CO2 tác dụng với Ca(OH)2 dư thì có phản ứng: \(C{O_2} + Ca{(OH)_2} \to CaC{{\rm{O}}_3} + {H_2}O\) Theo PTHH: \({n_{CaC{{\rm{O}}_3}}} = {n_{C{O_2}}} = 0,05(mol)\) \( \to {m_{CaC{{\rm{O}}_3}}} = 0,05.100 = 5(g)\) Chọn C. Câu 10 (TH): Phương pháp: HS ghi nhớ một số kim loại bị thụ động trong HNO3 đặc nguội: Al, Fe, Cr. Cách giải: Al, Fe bị thụ động hóa bởi HNO3 đặc nguội nên không bị oxi hóa. → Trong dãy kim loại Mg, Al, Cu, Fe chỉ có Mg, Cu bị oxi hóa bởi HNO3 đặc nguội. → 2 kim loại Chọn B. Câu 11 (TH): Phương pháp: Lý thuyết chương Cacbon - Silic và Nitơ - Photpho. Cách giải: A đúng B đúng C sai vì P khá hoạt động về mặt hóa học nên trong tự nhiên, ta không gặp photpho ở trạng thái tự do. D đúng Chọn C. Câu 12 (NB): Phương pháp: Chất điện li mạnh gồm có axit mạnh, bazo mạnh và hầu hết các muối. Cách giải: Chất điện li mạnh gồm có axit mạnh, bazo mạnh và hầu hết các muối. HCl là một axit mạnh, khi tan trong nước phân li hoàn toàn thành ion nên là chất điện li mạnh. Chọn B. Câu 13 (TH): Cách giải: Tính axit: (1) HNO3 > (2) H3PO4 > (3) H2CO3 > (4) H2SiO3 Chọn C. Câu 14 (VD)): Phương pháp: - Tính số mol H+ và OH-. - Từ pH dung dịch sau phản ứng đánh giá ion hết, ion còn dư. - Tính toán theo PT ion rút gọn. Cách giải: Giả sử V có đơn vị là lít. \({n_{O{H^ - }}} = {n_{NaOH}} = 0,01V(mol)\) \({n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}} \\= 0,1.0,01 + 2.0,1.0,01 = 0,003(mol)\) Ta thấy dung dịch sau pư có pH = 2 < 7 nên H+ dư, OH- phản ứng hết PT ion: H+ + OH- → H2O Ban đầu: 0,003 0,01V Phản ứng: 0,01V ← 0,01V Sau: 0,003-0,01V 0 Ta có: \({\rm{[}}{H^ + }{\rm{]}} = \dfrac{{{n_{{H^ + }}}}}{{{V_{dd\,sau}}}} = {10^{ - pH}} \\\Leftrightarrow \dfrac{{0,003 - 0,01V}}{{V + 0,1}} = {10^{ - 2}} \\\Leftrightarrow V = 0,1(l) = 100(ml)\) Chọn C. Câu 15 (NB): Phương pháp: Lý thuyết về hợp chất của cacbon. Cách giải: Nước đá khô là CO2 ở dạng rắn. Chọn A. Câu 16 (TH): Phương pháp: Lý thuyết về muối photphat. Cách giải: Để nhận biết ion PO43- trong dung dịch muối photphat ta có thể dùng muối AgNO3. Hiện tượng là tạo kết tủa vàng. \(A{g^ + } + P{O_4}^{3 - } \to A{g_3}P{O_4} \downarrow \) Chọn C. Câu 17 (NB): Phương pháp: Muối amoni là muối của NH4+ liên kết với gốc axit. Cách giải: Công thức hóa học của muối amoni clorua là NH4Cl. Chọn D. Câu 18 (TH): Phương pháp: Dựa vào số oxi hóa của nguyên tử N trong phân tử N2 để đánh giá tính chất oxi hóa - khử của N2 trong các phản ứng hóa học. + Nếu số oxi hóa có thể tăng → Thể hiện tính khử + Nếu số oxi hóa có thể giảm → Thể hiện tính oxi hóa Cách giải: Nguyên tử N trong phân tử N2 có số oxi hóa 0 là số oxi hóa trung gian nên vừa có thể tăng lên +1, +3, +5, +7 và giảm xuống -3. Do đó trong các phản ứng hóa học thì N2 thể hiện tính khử hoặc tính oxi hóa. Chọn D. Câu 19 (TH): Cách giải: Phản ứng không đúng là: Fe + 2HNO3 loãng → Fe(NO3)2 + 2H2. Giải thích: Do HNO3 loãng có tính oxi hóa mạnh nên sẽ oxi hóa Fe lên mức oxi hóa cao nhất, tạo Fe(NO3)3 và sản phẩm khử của N. Chọn D. Câu 20 (TH): Phương pháp: Để nhận biết các chất ta chọn thuốc thử sao cho hiện tượng khác nhau giữa các chất. Cách giải: Để nhận biết các hóa chất trên ta có thể sử dụng Ba(OH)2: + Xuất hiện khí mùi khai và kết tủa trắng → (NH4)2SO4 (NH4)2SO4 + Ba(OH)2 → BaSO4↓ trắng + 2NH3↑ mùi khai + 2H2O + Xuất hiện khí mùi khai → NH4Cl 2NH4Cl + Ba(OH)2 → BaCl2 + NH3↑ mùi khai + H2O + Không hiện tượng → NaNO3 Chọn B. PHẦN II: TỰ LUẬN (2,0 điểm) Câu 1 (TH): Phương pháp: Lý thuyết tổng hợp chương Cacbon - Silic. Cách giải: (1) \(C + {O_{2\,du}}\xrightarrow{{{t^0}}}C{O_2}\) (2) \(C{O_2}du + NaOH \to NaHC{O_3}\) (3) \(NaHC{O_3} + NaOH \to N{a_2}C{O_3} + {H_2}O\) (4) \(N{a_2}C{O_3} + BaC{l_2} \to BaC{{\rm{O}}_3} \downarrow + 2NaCl\) Câu 2 (VDC): Phương pháp: - Tính được số mol Al. - Đặt ẩn số mol mỗi khí, lập hệ phương trình về số mol và khối lượng của khí. Giải tìm được số mol mỗi khí. - Ta so sánh số mol e do Al nhường và số mol e do khí nhận để kết luận về sự tạo muối NH4NO3. - Áp dụng bảo toàn electron để tính số mol NH4NO3. - Xác định thành phần của muối trong dung dịch sau phản ứng. Cách giải: \({n_{Al}} = \dfrac{{37,8}}{{27}} = 1,4(mol);\,\,\,\,\,\,\,\,\,\,\,\,\,\\{M_X} = 18.2 = 36;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\\{n_X} = \dfrac{{8,96}}{{22,4}} = 0,4(mol)\) Đặt số mol của N2O và N2 lần lượt là a và b. Ta có hệ phương trình:\(\left\{ \begin{array}{l}{n_X} = a + b = 0,4\\{m_X} = 44{\rm{a}} + 28b = 0,4.36\end{array} \right. \\\to \left\{ \begin{array}{l}a = 0,2\\b = 0,2\end{array} \right.\) Ta có: \(\mathop {Al}\limits^0 \to \mathop {Al}\limits^{ + 3} + 3{\rm{e}}\) \(2\mathop N\limits^{ + 5} + 8{\rm{e}} \to 2\mathop N\limits^{ + 1} \,\,({N_2}O)\) \(2\mathop N\limits^{ + 5} + 10{\rm{e}} \to {\rm{2}}\mathop N\limits^0 \,\,({N_2})\) Số mol electron do Al nhường \( = 3{n_{Al}} = 1,4.3 = 4,2(mol)\) Số mol electron do khí nhận \( = 8{n_{{N_2}O}} + 10{n_{{N_2}}} = 8.0,2 + 10.0,2 \\= 3,6(mol)\) Ta thấy: 4,2 mol > 3,6 mol → Phản ứng tạo NH4NO3 Vậy các quá trình oxi hóa - khử là: \(\mathop {Al}\limits^0 \to \mathop {Al}\limits^{ + 3} + 3{\rm{e}}\) \(2\mathop N\limits^{ + 5} + 8{\rm{e}} \to 2\mathop N\limits^{ + 1} \,\,({N_2}O)\) \(2\mathop N\limits^{ + 5} + 10{\rm{e}} \to {\rm{2}}\mathop N\limits^0 \,\,({N_2})\) \(\mathop N\limits^{ + 5} + 8{\rm{e}} \to \mathop N\limits^{ - 3} (N{H_4}N{O_3})\) Áp dụng bảo toàn e: \(3{n_{Al}} = 8{n_{{N_2}O}} + 10{n_{{N_2}}} + 8{n_{N{H_4}N{O_3}}}\) \( \Leftrightarrow 3.1,4 = 8.0,2 + 10.0,2 + 8{n_{N{H_4}N{O_3}}} \\\Leftrightarrow {n_{N{H_4}N{O_3}}} = 0,075\) Vậy dung dịch muối chứa: \({n_{Al{{(N{O_3})}_3}}} = {n_{Al}} = 1,4(mol);\,\,\,\,\,\,\\{n_{N{H_4}N{O_3}}} = 0,075(mol)\) Khối lượng muối là: \(m = 1,4.213 + 0,075.80 = 304,2(g)\) HocTot.Nam.Name.Vn
|