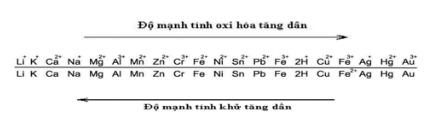
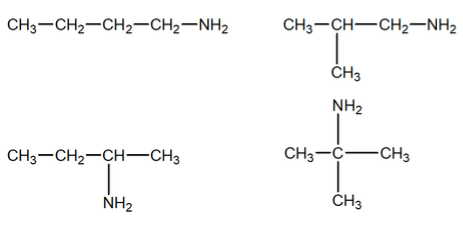
Giải đề thi học kì 1 hoá lớp 12 năm 2019 - 2020 sở giáo dục Tây NinhGiải chi tiết đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Tây Ninh với cách giải nhanh và chú ý quan trọng PHẦN I: TRẮC NGHIỆM (8,0 điểm) Câu 1 (NB): Kim loại nào sau đây có nhiệt độ nóng chảy thấp nhất? A. Pb. B. Al. C. Sn. D. Hg. Câu 2 (NB): Chất nào sau đây thuộc loại polisaccarit? A. Tinh bột. B. Saccarozo. C. Fructozo. D. Glucozo. Câu 3 (VD): Cho m gam hỗn hợp gồm glyxin và alanin tác dụng vừa đủ với 250 ml dung dịch NaOH 1,2M. Cô cạn dung dịch sau phản ứng, thu được 31,62 gam muối khan. Giá trị của m là A. 30,96. B. 26,94. C. 24,72. D. 25,02. Câu 4 (TH): Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là A. FeCl2. B. CuCl2, FeCl2. C. FeCl2, FeCl3. D. FeCl3. Câu 5 (NB): Số nguyên tử oxi trong một phân tử triglixerit là A. 8. B. 6. C. 4. D. 2. Câu 6 (TH): Polime nào sau đây được điều chế bằng phản ứng trùng ngưng? A. Poli(etylen terephtalat). B. Poli(vinyl clorua). C. Polistiren. D. Polietilen. Câu 7 (TH): Cho các phát biểu sau: (a) Dung dịch lòng trắng trứng bị đông tụ khi đun nóng. (b) Trong phân tử lysin có một nguyên tử nitơ. (c) Dung dịch alanin làm đổi màu quỳ tím. (d) Anilin là chất rắn, tan tốt trong nước. Số phát biểu đúng là A. 4. B. 2. C. 3. D. 1. Câu 8 (VD): Hỗn hợp X gồm 3 chất: CH2O2, C2H4O2, C4H8O2. Đốt cháy hoàn toàn một lượng hỗn hợp X, thu được 0,8 mol H2O và m gam CO2. Giá trị của m là A. 35,20. B. 17,60. C. 17,92. D. 70,40. Câu 9 (NB): Chất nào dưới đây khi cho vào dung dịch AgNO3 trong NH3 dư, đun nóng, không xảy ra phản ứng tráng bạc? A. Glucozo. B. Fructozo. C. Anđehit axetic. D. Saccarozo. Câu 10 (TH): Cho biết số thứ tự của Mg trong bảng tuần hoàn là 12. Vị trí của Mg trong bảng tuần hoàn là A. chu kì 3, nhóm IIB. B. chu kì 3, nhóm IIA. C. chu kì 3, nhóm IIIA. D. chu kì 2, nhóm IIA. Câu 11 (NB): Este nào sau đây có công thức phân tử C4H8O2? A. Vinyl axetat. B. Etyl axetat. C. Propyl axetat. D. Phenyl axetat. Câu 12 (NB): Chất nào sau đây không thủy phân trong môi trường axit? A. Tinh bột. B. Saccarozo. C. Glucozo. D. Xenlulozo. Câu 13 (TH): Kim loại nào sau đây khử được Fe2+ trong dung dịch? A. Ag. B. Na. C. Zn. D. Cu. Câu 14 (TH): Sản phẩm của phản ứng este hóa giữa ancol metylic và axit axetic là A. propyl propionat. B. propyl fomat. C. metyl axetat. D. metyl propionat. Câu 15 (TH): Chất X có cấu tạo CH3CH2COOCH3. Tên gọi của X là A. metyl axetat. B. propyl axetat. C. etyl axetat. D. metyl propionat. Câu 16 (NB): Đường fructozo có nhiều trong mật ong, ngoài ra còn có trong các loại hoa quả và rau xanh như ổi, cam, xoài, rau diếp xoắn, cà chua, … rất tốt cho sức khỏe. Công thức của fructozo là A. C12H22O11. B. C6H10O5. C. CH3COOH. D. C6H12O6. Câu 17: Số nguyên tử nitơ trong phân tử Ala-Gly-Ala-Gly là A. 2. B. 3. C. 4. D. 5. Câu 18 (NB): Chất nào sau đây thuộc loại amin bậc ba? A. CH3-NH-CH3. B. C2H5-NH2. C. (CH3)3N. D. CH3-NH2. Câu 19 (TH): Chất không tham gia phản ứng trùng hợp là A. toluen. B. isopren. C. propen. D. stiren. Câu 20 (NB): Nguyên tắc chung được dùng để điều chế kim loại là A. cho hợp chất chứa ion kim loại tác dụng với chất khử. B. oxi hóa ion kim loại trong hợp chất thành nguyên tử kim loại. C. khử ion kim loại trong hợp chất thành nguyên tử kim loại. D. cho hợp chất chứa ion kim loại tác dụng với chất oxi hóa. Câu 21 (TH): Những tính chất vật lí chung của kim loại như: tính dẻo, dẫn điện, dẫn nhiệt, ánh kim gây nên chủ yếu bởi A. khối lượng riêng của kim loại. B. các electron tự do trong tinh thể kim loại. C. cấu tạo mạng tinh thể kim loại. D. các ion dương kim loại. Câu 22: Ion nào sau đây có tính oxi hóa mạnh nhất trong dung dịch? A. Fe2+. B. Zn2+. C. Ag+. D. Ba2+. Câu 23 (VD): Trùng hợp m tấn etilen thu được 1,2 tấn polietilen (PE) với hiệu suất phản ứng bằng 80%. Giá trị của m là A. 1,5. B. 2,0. C. 1,2. D. 1,8. Câu 24 (VD): Cho 3,0 gam hỗn hợp X gồm anilin, metylamin, đimetylamin phản ứng vừa đủ với 50 ml dung dịch HCl 1,2M thu được m gam muối. Giá trị của m là A. 5,19. B. 3,06. C. 5,67. D. 4,17. Câu 25 (NB): Amino axit là hợp chất hữu cơ trong phân tử có chứa nhóm chức A. hiđroxyl và amino. B. cacboxyl và amino. C. cacbonyl và amino. D. cacboxyl và hiđroxyl. Câu 26: Số đồng phân cấu tạo amin bậc một có công thức phân tử C4H11N là A. 5. B. 2. C. 3. D. 4. Câu 27 (NB): Chất béo là trieste của axit béo với A. ancol etylic. B. glixerol. C. ancol metylic. D. etylen glicol. Câu 28 (TH): Cho dãy các kim loại: Hg, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là A. 2. B. 3. C. 4. D. 1. Câu 29 (NB): Xà phòng hóa chất nào sau đây thu được glixerol? A. Tristearin. B. Metyl axetat. C. Benzyl axetat. D. Metyl fomat. Câu 30 (TH): Số nhóm amino và số nhóm cacboxyl có trong một phân tử axit glutamic tương ứng là A. 2 và 2. B. 2 và 1. C. 1 và 1. D. 1 và 2. Câu 31 (TH): Phân tử polime nào sau đây chỉ chứa hai nguyên tố C và H? A. Poli(vinyl clorua). B. Poli(vinyl axetat). C. Polietilen. D. Poliacrilonitrin. Câu 32 (VDC): Đốt cháy hoàn toàn 0,120 mol hỗn hợp E gồm hai chất hữu cơ mạch hở X (CnH2n+3O2N) và muối của axit cacboxylic hai chức Y (CmH2m+4O4N2) cần vừa đủ 0,258 mol O2, thu được 0,720 mol hỗn hợp CO2, N2 và H2O. Mặt khác, khi cho 0,120 mol E tác dụng vừa đủ với dung dịch NaOH đun nóng. Kết thúc phản ứng, cô cạn dung dịch thu được hỗn hợp Z gồm hai chất khí, đều làm xanh quỳ tím ẩm và m gam hỗn hợp muối khan. Giá trị của m là A. 8,832. B. 12,284. C. 11,328. D. 12,336. Câu 33 (VDC): Lên men m gam tinh bột thành ancol etylic với hiệu suất cả quá trình là 75%. Lượng CO2 sinh ra được hấp thụ hoàn toàn vào dung dịch Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch X. Thêm dung dịch KOH 1,0M vào X, thu được kết tủa. Để lượng kết tủa thu được là lớn nhất thì cần tối thiểu 150 ml dung dịch KOH. Giá trị của m là A. 75,6. B. 86,4. C. 70,2. D. 64,8. Câu 34 (VDC): Cho m gam Mg vào dung dịch X gồm 0,036 mol Zn(NO3)2 và 0,060 mol Cu(NO3)2, sau một thời gian thu được 6,300 gam kim loại và dung dịch Y. Cho dung dịch NaOH vào dung dịch Y, thu được lượng kết tủa lớn nhất là 8,004 gam. Giá trị của m là A. 4,860. B. 2,424. C. 3,432. D. 4,320. Câu 35 (VD): Đốt cháy hoàn toàn a gam triglixerit X cần vừa đủ 3,26 mol O2, thu được 2,28 ml CO2 và 39,6 gam H2O. Mặt khác, thủy phân hoàn toàn 2a gam X trong dung dịch KOH, thu được glixerol và m gam hỗn hợp muối. Giá trị của m là A. 38,64. B. 77,28. C. 19,32. D. 57,96. Câu 36: Cho 33,32 gam hỗn hợp X gồm glyxin, alanin, axit glutamic và etylamin tác dụng với dung dịch KOH dư thì có 0,35 mol KOH đã tham gia phản ứng. Đốt cháy hoàn toàn 33,32 gam X, thu được CO2, N2 và 25,20 gam H2O. Cho 33,32 gam X tác dụng với dung dịch HCl dư, thu được dung dịch Y chứa m gam muối. Giá trị của m là A. 48,65. B. 58,87. C. 53,76. D. 46,09. Câu 37 (VDC): Đốt cháy hoàn toàn m gam hỗn hợp X gồm ba este đều mạch hở (phân tử khối nhỏ hơn 148), thu được 26,88 lít CO2 (đktc). Cho m gam X tác dụng với dung dịch NaOH (vừa đủ), thu được 40,6 gam hỗn hợp muối và 19,0 gam hỗn hợp ancol Y. Cho toàn bộ Y tác dụng với Na dư, thu được 6,72 lít H2 (đktc). Phần trăm khối lượng của este có khối lượng phân tử nhỏ nhất trong X là A. 62,36%. B. 33,71%. C. 41,57%. D. 50,56%. Câu 38 (VDC): Hòa tan hoàn toàn 10,680 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1,2M. Sau khi các phản ứng kết thúc, thu được 1,2096 lít khí N2O (đktc) duy nhất và dung dịch X chứa m gam muối. Giá trị của m là A. 40,920. B. 40,440. C. 41,184 D. 37,584. Câu 39 (TH): Cho các phát biểu sau: (a) Phản ứng thủy phân este trong môi trường kiềm là phản ứng thuận nghịch. (b) Poli(vinyl clorua) được điều chế bẳng phản ứng trùng ngưng. (c) Ở điều kiện thường, metylamin là chất khí, tan nhiều trong nước. (d) Glucozo thuộc loại monosaccarit, tinh bột thuộc loại polisaccarit. (e) Các chất có công thức dạng Cn(H2O)m đều thuộc loại cacbohiđrat. (g) Các loại tơ poliamit kém bền trong môi trường axit và môi trường kiềm. Số phát biểu đúng là A. 4. B. 6. C. 3. D. 5. Câu 40: Tiến hành thí nghiệm theo các bước sau: - Bước 1: Cho vài giọt dung dịch iot (màu vàng nhạt) vào ống nghiệm đựng sẵn 2 ml dung dịch hồ tinh bột (không màu) và để trong thời gian 2 phút ở nhiệt độ thường. - Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồn (không để sôi) khoảng 1-2 phút. - Bước 3: Để nguội ống nghiệm về nhiệt độ phòng. Cho các phát biểu sau: (a) Sau bước 1, dung dịch có màu xanh tím. (b) Sau bước 2, dung dịch bị mất màu do iot bị thăng hoa hoàn toàn. (c) Sau bước 3, dung dịch có màu xanh tím. (d) Ở bước 1, nếu thay dung dịch hồ tinh bột bằng xenlulozo thì hiện tượng thí nghiệm sau bước 3 vẫn xảy ra tương tự. (e) Thí nghiệm trên có thể được dùng để nhận biết hồ tinh bột. Số phát biểu đúng là A. 2. B. 1. C. 4. D. 3. PHẦN II: TỰ LUẬN (2,0 điểm) Câu 1: (1,0 điểm) Viết các phương trình hóa học sau: a) CH3COOC2H5 + H2O \(\overset {{H_2}S{O_4}dac,{t^o}} \leftrightarrows \) b) C12H22O11 (saccarozo) + Cu(OH)2 → c) Anilin + HCl → d) Trùng hợp acrilonitrin. Câu 2: (1,0 điểm) Tính thể tích dung dịch axit nitric 63% (D = 1,4 g/ml) cần dùng vừa đủ để sản xuất được 59,4 kg xenlulozo trinitrat (hiệu suất 80%). Viết phương trình hóa học xảy ra. ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI Thực hiện: Ban chuyên môn HocTot.Nam.Name.Vn PHẦN I: TRẮC NGHIỆM (8,0 điểm)
Câu 1: Phương pháp: Xem lại Lý thuyết bài đại cương kim loại. Hướng dẫn giải: Kim loại có nhiệt độ nóng chảy thấp nhất và là kim loại duy nhất có thể lỏng ở điều kiện thường là thủy ngân (Hg). Đáp án D Câu 2: Phương pháp: Xem lại Lý thuyết về cacbohiđrat. Hướng dẫn giải: Tinh bột thuộc loại polisaccarit. Đáp án A Câu 3: Phương pháp: - Viết phản ứng tổng quát: H2N-R-COOH + NaOH → H2N-R-COONa + H2O - Từ PTTQ suy ra: \({n_{{H_2}O}} = {n_{NaOH}}\) - Áp dụng định luật bảo toàn khối lượng để tính m Hướng dẫn giải: Tổng quát: H2N-R-COOH + NaOH → H2N-R-COONa + H2O Theo phương trình tổng quát: \({n_{{H_2}O}} = {n_{NaOH}} = 0,25.1,2 = 0,3(mol)\) Bảo toàn khối lượng: \({m_{a.a}} + {m_{NaOH}} = {m_{muoi}} + {m_{{H_2}O}} \Leftrightarrow m + 0,3.40 = 31,62 + 0,3.18 \Leftrightarrow m = 25,02(g)\) Đáp án D Câu 4: Phương pháp: - Chất rắn không tan là Cu. - Viết các PTHH xảy ra để xác định muối có trong dung dịch sau phản ứng. Hướng dẫn giải: Chất rắn không tan là Cu PTHH: \(F{{\rm{e}}_2}{O_3} + 6HCl \to 2F{\rm{e}}C{l_3} + 3{H_2}O\) \(Cu + 2F{\rm{e}}C{l_3} \to CuC{l_2} + 2F{\rm{e}}C{l_2}\) Vậy dung dịch sau phản ứng có chứa muối FeCl2. Đáp án A Câu 5: Phương pháp: Dựa vào định nghĩa về triglixerit: Triglixerit là trieste của glixerol và axit béo. Hướng dẫn giải: Triglixerit là trieste của glixerol và axit béo. Do đó phân tử triglixerit có 3 nhóm este COO chứa 6 nguyên tử O. Đáp án B Câu 6: Phương pháp: Phản ứng trùng ngưng là phản ứng kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng các phân tử nhỏ khác. Hướng dẫn giải: Poli(etylen terephtalat) được điều chế phản ứng trùng ngưng etylenglicol và axit terephtalic. PTHH: \(nHOC{H_2}C{H_2}OH + nHOOC{C_6}{H_4}COOH\xrightarrow{{{t^o}}}{( - OC{H_2}C{H_2}O - OOC{C_6}{H_4}COO - )_n} + 2n{H_2}O\) Đáp án A Câu 7: Phương pháp: Xem lại Lý thuyết về amin, amino axit và protein. Hướng dẫn giải: (a) Dung dịch lòng trắng trứng bị đông tụ khi đun nóng. → Đúng do thành phần chính của lòng trắng trứng là protein nên bị đông tụ khi đun nóng. (b) Trong phân tử lysin có một nguyên tử nitơ. → Sai, phân tử lysin có 2 nhóm -NH2 nên có 2 nguyên tử N. (c) Dung dịch alanin làm đổi màu quỳ tím. → Sai, alanin là H2N-CH(CH3)-COOH có số nhóm -NH2 bằng số nhóm -COOH nên không làm đổi màu quỳ tím. (d) Anilin là chất rắn, tan tốt trong nước. → Sai vì anilin ít tan trong nước. Vậy có 1 phát biểu đúng. Đáp án D Câu 8: Phương pháp: - Quan sát CTPT của các chất để rút ra đặc điểm chung của chúng. - Suy ra mối liên hệ giữa mol CO2 và mol H2O. Hướng dẫn giải: Các chất đều có dạng CnH2nOm nên khi đốt cháy thu được: \({n_{C{O_2}}} = {n_{{H_2}O}} = 0,8(mol)\) \( \to {m_{C{O_2}}} = 0,8.44 = 35,2(g)\) Đáp án A Câu 9: Phương pháp: Các chất có chứa nhóm -CHO (hoặc có khả năng chuyển thành chất có nhóm -CHO) thì có phản ứng tráng gương. Hướng dẫn giải: - Glucozo, anđehit axetic có chứa nhóm -CHO trong phân tử nên có phản ứng tráng gương - Fructozo trong môi trường kiềm chuyển hóa thành glucozo nên cũng có phản ứng tráng gương - Saccarozo không chứa -CHO nên không có phản ứng tráng gương. Đáp án D Câu 10: Phương pháp: - Viết cấu hình e nguyên tử. - Từ cấu hình e nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn: *Chu kì: số lớp = số thứ tự chu kì *Nhóm: - Nếu e cuối cùng được điền vào phân lớp s, p => nhóm A Số e lớp ngoài cùng = số thứ tự nhóm - Nếu e cuối cùng được điền vào phân lớp d, f => nhóm B Gọi n là tổng số e hóa trị của nguyên tố (n = số e lớp ngoài cùng + số e phân lớp sát ngoài cùng nếu nó chưa bão hòa) + n < 8 => nhóm nB + 8 ≤ n ≤ 10 => nhóm VIIB + n > 10 => nhóm (n-10)B Hướng dẫn giải: - Cấu hình e của Mg (Z = 12) là 1s22s22p63s2 - Vị trí của Mg trong bảng tuần hoàn: + Chu kì 3 do có 3 lớp e + Nhóm IIA do có e cuối cùng điền vào phân lớp s và có 2e ở lớp ngoài cùng Đáp án B Câu 11: Phương pháp: Từ tên gọi → CTCT → CTPT. Hướng dẫn giải: - Vinyl axetat là CH3COOCH=CH2 có CTPT là C4H6O2 - Etyl axetat là CH3COOC2H5 có CTPT là C4H8O2 - Propyl axetat là CH3COOCH2CH2CH3 có CTPT là C5H10O2 - Phenyl axetat là CH3COOC6H5 có CTPT là C8H8O2 Đáp án B Câu 12: Phương pháp: Lý thuyết chung về cacbohiđrat. Hướng dẫn giải: Glucozo là monosaccarit nên không có phản ứng thủy phân (kể cả trong môi trường axit và kiềm). Đáp án C Câu 13: Phương pháp: Kim loại đứng trước Fe trong dãy điện hóa (trừ các KL phản ứng với H2O) sẽ khử được Fe2+ trong dung dịch. Hướng dẫn giải: Kim loại đứng trước Fe trong dãy điện hóa (trừ các KL phản ứng với H2O) sẽ khử được Fe2+ trong dung dịch. → Zn có thể khử được Fe2+ PT ion: Zn + Fe2+ → Zn2+ + Fe Chú ý: Na đứng trước Fe nhưng Na khử nước, không khử ion Fe2+. Đáp án C Câu 14: Hướng dẫn giải: PTHH: \(C{H_3}{\text{COO}}H + C{H_3}OH\overset {{H_2}S{O_4}dac,{t^o}} \leftrightarrows \\C{H_3}COOC{H_3}(metyl\,\,axet{\text{a}}t) + {H_2}O\) Đáp án C Câu 15: Phương pháp: Cách gọi tên este: Tên gọi của este RCOOR' = Tên gốc R' + tên gốc axit (đuôi "at") Hướng dẫn giải: CH3CH2COOCH3 có tên gọi là Metyl propionat. Đáp án D Câu 16: Hướng dẫn giải: Công thức phân tử của fructozo là C6H12O6. Đáp án D Câu 17: Phương pháp: Số nguyên tử C của peptit bằng tổng số nguyên tử C của các amino axit thành phần. Hướng dẫn giải: Phân tử Ala và Gly đều có 1 nhóm -NH2 nên có 1 nguyên tử N. → Ala-Gly-Ala-Gly có 4 nguyên tử N Đáp án C Câu 18: Phương pháp: Dựa vào khái niệm về bậc amin: Bậc của amin là số gốc hiđrocacbon gắn trực tiếp với nguyên tử N. Hướng dẫn giải: Bậc của amin là số gốc hiđrocacbon gắn trực tiếp với nguyên tử N. → Trong các amin thì (CH3)3N thuộc loại amin bậc 3. Đáp án C Câu 19: Phương pháp: Điều kiện để tham gia phản ứng trùng hợp: Một chất tham gia phản ứng trùng hợp khi phân tử của nó có chứa liên kết π kém bền hoặc vòng kém bền. Hướng dẫn giải: Toluen không có liên kết π kém bền hoặc vòng kém bền nên không tham gia phản ứng trùng hợp. Đáp án A Câu 20: Phương pháp: Lý thuyết về điều chế kim loại. Hướng dẫn giải: Nguyên tắc chung được dùng để điều chế kim loại là khử ion kim loại trong hợp chất thành nguyên tử kim loại. Đáp án C Câu 21: Hướng dẫn giải: Những tính chất vật lí chung của kim loại như: tính dẻo, dẫn điện, dẫn nhiệt, ánh kim gây nên chủ yếu bởi các electron tự do trong tinh thể kim loại. Đáp án B Câu 22: Phương pháp: Xem lại Lý thuyết về dãy điện hóa: Hướng dẫn giải: Trong các ion kim loại đề bài cho thì Ag+ có tính oxi hóa mạnh nhất. Đáp án C Câu 23: Phương pháp: - Áp dụng bảo toàn khối lượng: \({m_{{C_2}{H_4}pu}} = {m_{PE}}\) - Tính khối lượng C2H4 ban đầu dựa vào công thức tính hiệu suất: \(H\% = \dfrac{{{m_{{C_2}{H_4}ban\,dau}}}}{{{m_{{C_2}{H_4}phan\,ung}}}}.100\% \) Hướng dẫn giải: PTHH: \(nC{H_2} = C{H_2}\xrightarrow{{{t^o},xt,p}}{( - C{H_2} - C{H_2} - )_n}\) Bảo toàn khối lượng: \({m_{{C_2}{H_4}pu}} = {m_{PE}} = 1,2\) (tấn) Do hiệu suất phản ứng đạt 80% nên khối lượng của C2H4 ban đầu là: \({m_{{C_2}{H_4}b{\rm{d}}}} = 1,2.\dfrac{{100}}{{80}} = 1,5\) (tấn) Đáp án A Câu 24: Phương pháp: - Tổng quát: Amin + HCl → Muối - Áp dụng định luật bảo toàn khối lượng để tính khối lượng của muối thu được. Hướng dẫn giải: Tổng quát: Amin + HCl → Muối Bảo toàn khối lượng: mmuối = mamin + mHCl = 3 + 0,05.1,2.36,5 = 5,19 gam Đáp án A Câu 25: Phương pháp: Xem lại Lý thuyết về amino axit. Hướng dẫn giải: Amino axit là hợp chất hữu cơ trong phân tử có chứa nhóm chức amino (-NH2) và nhóm cacboxyl (-COOH). Chú ý: Nhóm cacbonyl là -CHO, hiđroxyl là -OH. Đáp án B Câu 26: Phương pháp: - Amin bậc 1 là amin có dạng R-NH2 - Phân loại đồng phân amin: + Đồng phân vị trí nhóm amin + Đồng phân mạch cacbon Hướng dẫn giải: Các đồng phân cấu tạo amin bậc một có công thức phân tử C4H11N: → Có 4 đồng phân Đáp án D Câu 27: Hướng dẫn giải: Chất béo là trieste của axit béo với glixerol. Đáp án B Câu 28: Phương pháp: Các kim loại đứng trước H trong dãy điện hóa phản ứng được với dung dịch H2SO4 loãng. Hướng dẫn giải: Kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là Fe → 1 kim loại Đáp án D Câu 29: Phương pháp: Lý thuyết về chất béo. Hướng dẫn giải: Xà phòng hóa tristearin thu được glixerol. PTHH: \({({C_{17}}{H_{35}}COO)_3}{C_3}{H_5} + 3NaOH\xrightarrow{{{t^o}}}\\3{C_{17}}{H_{35}}COONa + {C_3}{H_5}{(OH)_3}\) Đáp án A Câu 30: Hướng dẫn giải: Axit glutamic là HOOC-CH2-CH2-CH(NH2)-COOH có 1 nhóm -NH2 và 2 nhóm -COOH. Đáp án D Câu 31: Phương pháp: Dựa vào cấu tạo của polime để xác định thành phần của các nguyên tố trong polime. Hướng dẫn giải: - Poli(vinyl clorua) là (-CH2-CHCl-)n chứa C, H, Cl - Poli(vinyl axetat) là (-CH2-CH(OOCCH3)-)n chứa C, H, O - Polietilen là (-CH2-CH2-)n chứa C, H - Poliacrilonitrin là (-CH2-CHCN-)n chứa C, H, N Đáp án C Câu 32: Phương pháp: X có công thức CnH2n+3O2N nên là muối của axit đơn chức. Ta thấy các muối đều no nên có thể quy đổi thành: HCOONH4, (COONH4)2, CH2. Hướng dẫn giải: X có công thức CnH2n+3O2N nên là muối của axit đơn chức. Ta thấy các muối đều no nên có thể quy đổi thành: \(\left\{ \begin{array}{l}HCOON{H_4}:a\\{(COON{H_4})_2}:b\\C{H_2}:c\end{array} \right. + {O_2}:0,258 \\\to 0,72\left\{ \begin{array}{l}C{O_2}:a + 2b + c(BT:C)\\{H_2}O:2,5{\rm{a}} + 4b + c(BT:H)\\{N_2}:0,5{\rm{a}} + b(BT:N)\end{array} \right.\) (1) nE = a + b = 0,12 (2) n sản phẩm = a + 2b + c + 2,5a + 4b + c + 0,5a + b = 0,72 (3) BTNT "O" → 2a + 4b + 2.0,258 = 2(a + 2b + c) + 2,5a + 4b + c Giải (1) (2) (3) được a = 0,072; b = 0,048; c = 0,048 Như vậy hỗn hợp quy đổi: \(\left\{ \begin{array}{l}HCOON{H_4}:0,072\\{(COON{H_4})_2}:0,048\\C{H_2}:0,048\end{array} \right.\) Ta thấy \({n_{C{H_2}}} = {n_{{{(C{\rm{OON}}{{\rm{H}}_4})}_2}}} = 0,048\) nên 1 nhóm CH2 trả về cho (COONH4)2. Mà do khi phản ứng với NaOH thu được hỗn hợp khí làm xanh quỳ tím ẩm nên hỗn hợp E chứa: HCOONH4 (0,072 mol) và CH3NH3OOC-COONH4 (0,048 mol) → Muối chứa HCOONa (0,072 mol) và NaOOC-COONa (0,048 mol) → m muối = 0,072.68 + 0,048.134 = 11,328 gam Đáp án C Câu 33: Phương pháp: - Dựa vào dữ kiện về số mol KOH thêm vào xác định được số mol của Ba(HCO3)2. Chú ý, để lượng kết tủa tối đa cần tối thiểu lượng KOH thì phản ứng là: Ba(HCO3)2 + KOH → BaCO3 + KHCO3 + H2O - Xét phản ứng của CO2 với Ba(OH)2 tính được số mol CO2 - Sơ đồ lên men tinh bột: C6H10O5 → C6H12O6 → 2CO2 Từ lượng CO2 tính được lượng tinh bột. Chú ý phản ứng có hiệu suất. Hướng dẫn giải: \({n_{BaC{{\rm{O}}_3}}} = \dfrac{{98,5}}{{197}} = 0,5(mol)\); \({n_{K{\rm{O}}H}} = 0,15(mol)\) Do thêm KOH vào dung dịch X thu được kết tủa nên dung dịch X có chứa Ba(HCO3)2. Để lượng kết tủa tối đa cần tối thiểu lượng KOH thì phản ứng là: Ba(HCO3)2 + KOH → BaCO3 + KHCO3 + H2O 0,15 ← 0,15 - Xét phản ứng của CO2 và Ba(OH)2: CO2 + Ba(OH)2 → BaCO3 + H2O 0,5 ← 0,5 2CO2 + Ba(OH)2 → Ba(HCO3)2 0,3 ← 0,15 \( \to {n_{C{O_2}}} = 0,5 + 0,3 = 0,8(mol)\) Để đơn giản ta coi tinh bột là C6H10O5 Sơ đồ: C6H10O5 → C6H12O6 → 2CO2 Từ sơ đồ ta có: \({n_{{C_6}{H_{10}}{O_5}}} = \dfrac{1}{2}{n_{C{O_2}}} = \dfrac{1}{2}.0,8 = 0,4(mol) \to {m_{tinh\,\,bot}} = 0,4.162 = 64,8(g)\) Do hiệu suất cả quá trình là 75% nên lượng tinh bột đã dùng là: \(m = 64,8.\dfrac{{100}}{{75}} = 86,4(g)\) Đáp án B Câu 34: Phương pháp: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 - Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}}\) - Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = {n_{O{H^ - }(ket\,\,tua)}}\) - Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = {m_{hi{\rm{dr}}oxit}} - {m_{O{H^ - }(hi{\rm{dr}}oxit)}}\) - Bảo toàn khối lượng cho kim loại và ion kim loại để tính m: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) Hướng dẫn giải: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}} = 2.0,036 + 2.0,06 = 0,192(mol)\) Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = 0,192(mol) = {n_{O{H^ - }(ket\,\,tua)}}\) Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = 8,004 - 0,192.17 = 4,74(g)\) Bảo toàn khối lượng cho kim loại và ion kim loại: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) \( \Leftrightarrow m + 0,036.65 + 0,06.64 = 6,3 + 4,74\) \( \Leftrightarrow m = 4,86(g)\) Đáp án A Câu 35: Phương pháp: - Xét phản ứng đốt cháy a gam X: + Bảo toàn nguyên tố O tính số mol của X. + Bảo toàn khối lượng tính được khối lượng của X. - Xét phản ứng thủy phân 2a gam X bằng KOH (chú ý lượng chất gấp đôi so với phản ứng đốt cháy): Phản ứng thủy phân chất béo trong KOH có dạng: (RCOO)3C3H5 + 3KOH → 3RCOOK + C3H5(OH)3 + Từ số mol của X tính được số mol KOH và glixerol. + Áp dụng bảo toàn khối lượng tính được khối lượng của muối. Hướng dẫn giải: - Đốt cháy a gam X: Triglixerit có chứa 6 nguyên tử O. BTNT "O → \(6{n_X} + 2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\\ \Leftrightarrow 6{n_X} + 2.3,26 = 2.2,28 + 2,2\\ \Leftrightarrow {n_X} = 0,04\) BTKL → \({m_X} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} \\= 44.2,28 + 39,6 - 32.3,26 = 35,6(g)\) - Thủy phân 2a gam X bằng KOH: \({m_X} = 2.35,6 = 71,2(g)\) \({n_X} = 2.0,04 = 0,08(mol)\) Phản ứng thủy phân chất béo trong KOH: (RCOO)3C3H5 + 3KOH → 3RCOOK + C3H5(OH)3 0,08 → 0,24 → 0,08 (mol) BTKL → m muối = mX + mKOH - mglixerol = 71,2 + 0,24.56 - 0,08.92 = 77,28 gam Đáp án B Câu 36: Phương pháp: Glyxin = COO + NH3 + CH2 Alanin = COO + NH3 + 2CH2 Axit glutamic = 2COO + NH3 + 3CH2 Etylamin = NH3 + 2CH2 → Ta quy đổi hỗn hợp thành: COO, NH3, CH2 với \({n_{COO}} = {n_{K{\rm{O}}H}}\) Hướng dẫn giải: Glyxin = COO + NH3 + CH2 Alanin = COO + NH3 + 2CH2 Axit glutamic = 2COO + NH3 + 3CH2 Etylamin = NH3 + 2CH2 → Ta quy đổi hỗn hợp thành: COO, NH3, CH2 với \({n_{COO}} = {n_{K{\rm{O}}H}} = 0,35(mol)\) - Tóm tắt sơ đồ đốt cháy X: \(33,32(g)\left\{ \begin{array}{l}COO:0,35\\N{H_3}:a\\C{H_2}:b\end{array} \right. + {O_2} \\\to \left\{ \begin{array}{l}C{O_2}\\{N_2}\\{H_2}O:1,4\end{array} \right.\) (1) mX = 0,35.44 + 17a + 14b = 33,32 (2) BTNT "H" → 3a + 2b = 2.1,4 Giải hệ trên thu được a = 0,42 và b = 0,77 Bảo toàn nguyên tố N ta có: \({n_{ - N{H_2}(X)}} = {n_{N{H_3}}} = 0,42(mol)\) - Cho X phản ứng với HCl: X + HCl → Muối \( \to {n_{HCl}} = {n_{N{H_2}}} = 0,42(mol)\) BTKL: mmuối = mX + mHCl = 33,32 + 0,42.36,5 = 48,65 (g) Đáp án A Câu 37: Hướng dẫn giải: \({n_{C{O_2}}} = 1,2(mol);\,\,\,{n_{{H_2}}} = 0,3(mol)\) Do các este đều có M < 148 nên không thể là este 3 chức → Các este trong X có thể là đơn chức, hai chức - Khi ancol phản ứng với Na ta luôn có: \({n_{ - OH}} = 2.{n_{{H_2}}} = 0,6(mol)\) - Khi thủy phân este trong NaOH ta luôn có: \({n_{COONa}} = {n_{ - OH}} = 0,6(mol)\) Nhận thấy: \({n_{C{O_2}}} = {n_{{\rm{COONa}}}} + {n_{OH}} = 1,2(mol)\) → Số C của gốc axit bằng số C của gốc COONa và số C của ancol bằng số nhóm OH → Muối gồm HCOONa (a mol) và (COONa)2 (b mol) ; ancol gồm CH3OH (c mol) và C2H4(OH)2 (d mol) Giải hệ mol của từng muối: \(\left\{ \begin{array}{l}68{\rm{a}} + 134b = 40,6\\a + 2b = 0,6\end{array} \right. \to \left\{ \begin{array}{l}a = 0,4\\b = 0,1\end{array} \right.\) Giải hệ mol của từng ancol: \(\left\{ \begin{array}{l}32c + 62{\rm{d}} = 19\\c + 2{\rm{d}} = 0,6\end{array} \right. \to \left\{ \begin{array}{l}c = 0,4\\d = 0,1\end{array} \right.\) Từ mol của muối và ancol ta suy ra được hỗn hợp X gồm: \(\left\{ \begin{array}{l}HCOOC{H_3}:0,2\\{(HCOO)_2}{C_2}{H_4}:0,1\\{(COOC{H_3})_2}:0,1\end{array} \right.\) \( \to \% {m_{HCOOC{H_3}}} = \dfrac{{0,2.60}}{{0,2.60 + 0,1.118 + 0,1.118}}.100\% = 33,71\% \) Đáp án B Câu 38: Phương pháp: - Ta có các bán phản ứng tạo sản phẩm khử: 10H+ + 2NO3- + 8e → N2O + 5H2O 10H+ + NO3- + 8e → NH4+ + 3H2O Từ các bán phản ứng lập mối liên hệ giữa HNO3 phản ứng và số mol các sản phẩm khử. - Bảo toàn nguyên tố H tính được số mol H2O. - Áp dụng bảo toàn khối lượng tính được khối lượng muối thu được. Hướng dẫn giải: Ta có các bán phản ứng tạo sản phẩm khử: 10H+ + 2NO3- + 8e → N2O + 5H2O 10H+ + NO3- + 8e → NH4+ + 3H2O \( \to {n_{HN{O_3}pu}} = 10{n_{{N_2}O}} + 10{n_{N{H_4}^ + }} \Leftrightarrow 0,5.1,2 = 10.0,054 + 10{n_{N{H_4}^ + }} \Leftrightarrow {n_{N{H_4}^ + }} = 0,006\) Bảo toàn nguyên tố H → \({n_{{H_2}O}} = \dfrac{{{n_{HN{O_3}}} - 4{n_{N{H_4}^ + }}}}{2} \\= \dfrac{{0,6 - 4.0,006}}{2} = 0,288(mol)\) Bảo toàn khối lượng → \({m_{muoi}} = {m_{KL}} + {m_{HN{O_3}}} - {m_{{N_2}O}} - {m_{{H_2}O}} \\= 10,68 + 0,6.63 - 44.0,054 - 0,288.18 \\= 40,92(g)\) Đáp án A Câu 39: Hướng dẫn giải: (a) Phản ứng thủy phân este trong môi trường kiềm là phản ứng thuận nghịch. → Sai, vì đây là phản ứng một chiều. (b) Poli(vinyl clorua) được điều chế bẳng phản ứng trùng ngưng. → Sai, vì poli(vinyl clorua) phản ứng trùng hợp. (c) Ở điều kiện thường, metylamin là chất khí, tan nhiều trong nước. → Đúng (d) Glucozo thuộc loại monosaccarit, tinh bột thuộc loại polisaccarit. → Đúng (e) Các chất có công thức dạng Cn(H2O)m đều thuộc loại cacbohiđrat. → Sai, ví dụ HCHO không phải là cacbohiđrat. (g) Các loại tơ poliamit kém bền trong môi trường axit và môi trường kiềm. → Đúng, vì nó chứa liên kết amit -CONH- nên kém bền trong axit và kiềm. Vậy có 3 phát biểu đúng Đáp án C Câu 40: Hướng dẫn giải: (a) Sau bước 1, dung dịch có màu xanh tím. → Đúng (b) Sau bước 2, dung dịch bị mất màu do iot bị thăng hoa hoàn toàn. → Sai, dung dịch bị mất màu do khi đun nóng thì tinh bột không còn cấu trúc xoắn nên I2 không tạo được hợp chất xanh tím. (c) Sau bước 3, dung dịch có màu xanh tím. → Đúng, vì lúc này tinh bột lại có cấu trúc xoắn nên tạo được hợp chất màu xanh tím với I2. (d) Ở bước 1, nếu thay dung dịch hồ tinh bột bằng xenlulozo thì hiện tượng thí nghiệm sau bước 3 vẫn xảy ra tương tự. → Sai, xenlulozo không có tính chất này (e) Thí nghiệm trên có thể được dùng để nhận biết hồ tinh bột. → Đúng, vì đây là phản ứng đặc trưng của hồ tinh bột. Vậy có 3 phát biểu đúng. Đáp án D PHẦN II: TỰ LUẬN (2,0 điểm) Câu 1: Hướng dẫn giải: a) CH3COOC2H5 + H2O \(\overset {{H_2}S{O_4}dac,{t^o}} \leftrightarrows \) CH3COOH + C2H5OH b) C12H22O11 (saccarozo) + Cu(OH)2 → (C12H21O11)2Cu + 2H2O c) C6H5NH2 + HCl → C6H5NH3Cl d) n CH2=CH-CN \(\xrightarrow{{{t^o},xt,p}}\) (-CH2-CHCN-)n Câu 2: Phương pháp: - Tính số mol xenlulozo trinitrat - Viết PTHH: [C6H7O2(OH)3]n + 3nHNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^o}}}\) [C6H7O2(ONO2)3]n + 3nH2O - Theo PTHH: \({n_{HN{O_3}}} = 3n.{n_{xenlulozo\,trinit{\rm{r}}at}}\)→ \({m_{HN{O_3}}}\)→ \({m_{dd\,HN{O_3}}}\)→ \({V_{dd}}{\,_{HN{O_3}}} = \dfrac{m}{D}\) Chú ý: Phản ứng có hiệu suất. Hướng dẫn giải: Ta có: \[{n_{xenlulozo\,\,trinit{\rm{r}}at}} = \dfrac{{59,4}}{{297n}} = \dfrac{{0,2}}{n}(kmol)\] PTHH: [C6H7O2(OH)3]n + 3nHNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^o}}}\) [C6H7O2(ONO2)3]n + 3nH2O Theo PTHH: \({n_{HN{O_3}}} = 3n.{n_{xenlulozo\,trinit{\rm{r}}at}} = 3n.\dfrac{{0,2}}{n} = 0,6(kmol)\) → \({m_{HN{O_3}}} = 0,6.63 = 37,8(kg)\) → \({m_{dd\,HN{O_3}}} = 37,8.\dfrac{{100}}{{63}} = 60(kg)\) → \({V_{dd}}{\,_{HN{O_3}}} = \dfrac{m}{D} = \dfrac{{60}}{{1,4}} = 42,857(l)\) Do hiệu suất cả quá trình là 80% nên thể tích dung dịch HNO3 cần dùng là: \({V_{dd}}{\,_{HN{O_3}\,can\,dung}} = 42,857.\dfrac{{100}}{{80}} = 53,57(l)\) HocTot.Nam.Name.Vn
|