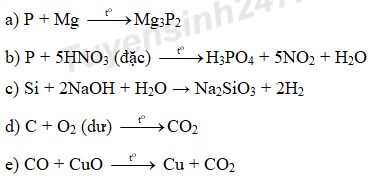Đề số 8 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 8 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Đề bài Câu 1 (3,5 điểm): a) Viết phương trình điện li của các chất sau khi hòa tan trong nước: HCl, NaOH, CH3COOH, AlCl3, Fe2(SO4)3. b) Bằng phương pháp hóa học hãy nhận biết các dung dịch đựng trong các lọ riêng biệt mất nhãn sau: Na3PO4, NaNO3, Na2CO3, NH4NO3. Câu 2 (2,5 điểm): Hoàn thành các phương trình phản ứng giữa các cặp chất sau, ghi rõ điều kiện cần thiết nếu có? a) P + Mg → b) P + HNO3 (đặc) → c) Si + NaOH + H2O → d) C + O2 (dư) → e) CO + CuO → Câu 3 (3 điểm): a) + Tính pH của dung dịch chứa 2,92 gam HCl trong 800 ml? + Tính pH của dung dịch chứa 0,8 gam NaOH trong 200 ml? b) Hòa tan hoàn toàn 10,35 gam hỗn hợp X gồm 2 kim loại Mg và Al bằng dung dịch HNO3 (loãng) dư sau phản ứng thu được dung dịch A và 7,84 lít khí không màu hóa nâu trong không khí (ở đktc, là sản phẩm khử duy nhất). - Tính % khối lượng mỗi kim loại trong hỗn hợp X? - Tính tổng khối lượng muối khan thu được khi cô cạn dung dịch A? Câu 4 (1 điểm): Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH và 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Xác định giá trị của m? Lời giải chi tiết Câu 1: a) HCl → H+ + Cl- NaOH → Na+ + OH- CH3COOH \( \rightleftarrows \) CH3COO- + H+ AlCl3 → Al3+ + 3Cl- Fe2(SO4)3 → 2Fe3+ + 3SO42- b)
PTHH: NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O Na2CO3 + HCl → NaCl + CO2↑ + H2O Na3PO4 + AgNO3 → NaNO3 + Ag3PO4↓ Câu 2:
Câu 3: a) + nHCl = 2,92 : 36,5 = 0,08 mol => nH+ = 0,08 mol => [H+] = 0,08 : 0,8 = 0,1 M => pH = -log[H+] = -log(0,1) = 1 + nNaOH = 0,8 : 40 = 0,02 mol => nOH- = 0,02 mol => [OH-] = 0,02 : 0,2 = 0,1M => [H+] = 10-14 : [OH-] = 10-13 M => pH = -log[H+] = -log(10-13) = 13 b) nNO = 7,84 : 22,4 = 0,35 mol Đặt nMg = x mol; nAl = y mol - Khối lượng hỗn hợp X: 24x + 27y = 10,35 (1) - Bảo toàn electron: 2nMg + 3nAl = 3nNO => 2x + 3y = 3.0,35 (2) Từ (1) và (2) ta có: \(\left\{ \begin{gathered} - Phần trăm mỗi kim loại: \(\left\{ \begin{gathered} - Khối lượng muối khan: BTNT “Mg”: nMg(NO3)2 = nMg = 0,15 mol BTNT “Al”: nAl(NO3)3 = nAl = 0,25 mol => m muối = 0,15.148 + 0,25.213 = 75,45 gam Câu 4: nNaOH = 0,006 mol; nBa(OH)2 = 0,012 mol nCO2 = 0,448 : 22,4 = 0,02 mol nOH- = nNaOH + 2nBa(OH)2 = 0,06.0,1 + 2.0,12.0,1 = 0,03 mol Ta thấy: \(1 < \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,03}}{{0,02}} = 1,5 < 2\) => tạo muối CO32-, HCO3- Đặt \({n_{C{O_3}^{2 - }}}\) = a mol và \({n_{HC{O_3}^ - }}\) = b mol PTHH: CO2 + 2OH- → CO32- + H2O a ← 2a ← a (mol) CO2 + OH- → HCO3- b ← 2b ← b (mol) Theo đề bài ta có: nCO2 = a + b = 0,02 (1) nOH- = 2a + b = 0,03 (2) \(\left\{ \begin{gathered} \({n_{B{a^{2 + }}}} = {n_{Ba{{\left( {OH} \right)}_2}}} = 0,012{\text{ }}mol\) \({n_{C{O_3}^{2 - }}} = 0,01mol\) => CO32- hết, Ba2+ dư => \({n_{BaC{O_3}}} = {n_{C{O_3}^{2 - }}} = 0,01{\text{ }}mol\) => m = mBaCO3 = 0,01.197 = 1,97 gam Xem lời giải chi tiết đề thi học kì 1 tại HocTot.Nam.Name.Vn HocTot.Nam.Name.Vn
|