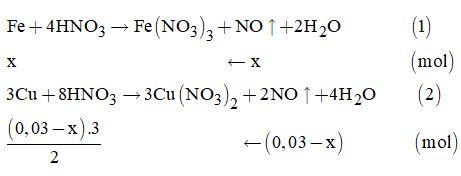Đề số 13 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 13 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Nồng độ của ion H+ trong dung dịch CH3COOH 0,1M là 0,025M. Độ điện li của dung dịch trên là: A.2,5% B.25% C.1,25% D.5% Câu 2. Xét quá trình sau: \({H_2}O + HCl \to {H_3}{O^ + } + C{l^ - }.\) Trong đó nước đóng vai trò như là: A. một tác nhân oxi hóa. B. một axit theo Bronstet. C. một bazơ theo Bronstet. D. một axit theo Areniut. Câu 3. Cho các ion: \({K^ + };NO_3^ - ;SO_3^{2 - };HSO_3^ - ;C{H_3}CO{O^ - };NH_4^ + ;{S^{2 - }}.\) Có bao nhiêu ion mang tính bazơ theo định nghĩa axit – bazơ của Bronstet? A.2 B.3 C.5 D.4 Câu 4. Dẫn 8,96 lít khí NH3 (đktc) qua ống nghiệm chứa 60 gam bột CuO và nung nóng. Biết hiệu suất phản ứng đạt 75%. Thể tích khí N2 thu được ở (đktc) là: A.6,72 lít B.4,48 lít C.3,36 lít D.21,2 lít Câu 5. Xét phản ứng oxi hóa – khử sau: \(Fe + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + N{O_2} + NO + {H_2}O\) Nếu tỉ lệ \({n_{N{O_2}}}:{n_{NO}} = a:b\) thì hệ số của các chất phản ứng lần lượt là: A. (a + 3b); (6a + 12b) B. (3a + b); (3a + 3b) C. (a + 3b); (2a + 5b) D. (3a + 5b); (2a + 2b) Câu 6. Cho a gam bột nhôm tác dụng với dung dịch HNO3 loãng, dư, thu được hỗn hợp khí gồm 224ml khí NO (đktc) và 336 lít khí N2O (đktc). Giá trị của a là: A.2,50 gam B.1,50 gam C.1,75 gam D.1,35 gam. Câu 7. Cho 50ml dung dịch K2CO3 0,2M hấp thụ với 112ml khí CO2 (đktc). Khối lượng các chất trong dung dịch sau phản ứng là: A.0,96 gam K2CO3 và 1 gam KHCO3 B.0,75 gam K2CO3 và 2,1 gam KHCO3 C.1 gam KHCO3 D.2,5 gam K2CO3 và 1,25 gam KHCO3 Câu 8. Dùng CO khử hoàn toàn một oxit kim loại có dạng RxOy (R chiếm 72,41% khối lượng) thu được 16,8 gam kim loại R. Công thức của oxit đem dùng là: A.Al2O3 B.Cr2O3 C.Fe2O3 D.Fe3O4 Câu 9. Thổi khí CO dư qua ống đựng bột một oxit sắt ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thu được 2 gam kết tủa. Công thức oxit sắt đem dùng là: A.Fe2O3 B.Fe3O4 C.FeO D.Fe3O2 Câu 10. Hai hợp chất (X) và (Y) là đồng phân của nhau. Điểm khác nhau giữa (X) và (Y) là: A. số nguyên tử cacbon. B. số nguyên tử hiđro. C. công thức cấu tạo. D. công thức phân tử. Câu 11. Đốt cháy hoàn toàn a gam chất hữu cơ (X) chứa C, H, O phải dùng vừa hết 0,15 mol O2 (đktc) thu được 2,24 lít khí CO2 (đktc) và 2,7 gam H2O. Công thức phân tử của (X) là: A.CH4O B.C2H6O C.C3H8O D.C4H10O Câu 12. Số đồng phân của hợp chất ứng với công thức phân tử C5H12 là: A.3 B.4 C.5 D.6 II. PHẦN TỰ LUẬN Câu 13. Cho 300ml dung dịch axit CH3COOH 0,2M \(\left( {{K_a} = 1,{{8.10}^{ - 5}}} \right)\). Để độ điện li \(\alpha \) tăng gấp đôi, thì thể tích (ml) nước cất cần thêm vào là bao nhiêu? Câu 14. Khi hòa tan 2,5 gam hợp kim đồng, sắt và vàng vào axit nitric loãng thì tạo thành 672ml khí nitơ monooxit (đktc) và 0,02 gam chất rắn không tan. Xác định thành phần phần trăm các kim loại trong hợp kim. Câu 15. Đốt cháy 200ml hơi một chất hữu cơ A chứa C, H và O trong 900ml O2. Thể tích của hỗn hợp khí thu được là 1,3 lít. Sau khi cho hơi nước ngưng tụ chỉ còn 700ml. Tiếp theo cho qua dung dịch KOH đặc, chỉ còn 100ml (các thể tích khí đều đo ở cùng diều kiện). Xác định công thức phân tử của A. Câu 16. Cho một dung dịch (X) có nồng độ H+ bằng 0,001M. Tính giá trị pH và \(\left[ {O{H^ - }} \right]\) của dung dịch đã cho.
Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
II. PHẦN TỰ LUẬN Câu 13. Ta có: \(\alpha = \sqrt {\dfrac{{1,{{8.10}^{ - 5}}}}{{0,2}}} = 9,{487.10^{ - 3}}\) Khi pha loãng độ điện li của axit là: 18,974.10-3 ứng với nồng độ: \(C = \dfrac{{1,{{8.10}^{ - 5}}}}{{{{\left( {18,{{974.10}^{ - 3}}} \right)}^2}}} \approx 0,05M\) Vậy pha loãng 0,2 : 0,05 = 4 lần, tức phải thêm 900ml nước vào 300ml dung dịch CH3COOH 0,2M để được 1,2 lít dung dịch CH3COOH mới nồng độ 0,05M. Câu 14. Ta có: \({n_{NO}} = \dfrac{{0,672}}{{22,4}} = 0,03\left( {mol} \right)\) Gọi x là số mol NO sinh ra trong phản ứng (1) \( \Rightarrow \) Số mol NO sinh ra trong phản ứng (2) là (0,03 – x)
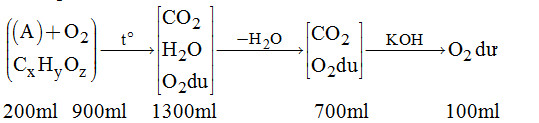
Theo đề bài, ta có phương trình: \({m_{\left( {Fe + Cu} \right)}} = 2,48\) \(\begin{array}{l} \Leftrightarrow 56x + \dfrac{{\left( {0,03 - x} \right).3}}{2} \times 64 = 2,48\\ \Leftrightarrow 56x + 2,88 - 96x = 2,48\\ \Rightarrow x = 0,01\end{array}\) Suy ra: \({m_{Fe}} = x \times 56 = 0,01 \times 56 = 0,56\left( {gam} \right)\) \(\begin{array}{l} \Rightarrow \% {m_{Fe}} = \dfrac{{0,56}}{{2,5}} \times 100\% = 22,4\% \\{\rm{ \% }}{{\rm{m}}_{Cu}} = \dfrac{{1,92}}{{2,5}} \times 100\% = 76,8\% \end{array}\) Câu 15. Sơ đồ phân tích đề bài:
Dựa vào sơ đồ, ta tính được: \({V_{{O_2}}}\)phản ứng \( = 900 - 100 = 800(ml);{V_{C{O_2}}} \)\(\,= 700 - 100 = 600(ml)\) \({V_{{H_2}O}} = 100y = 600 \Rightarrow y = 6\) \({V_{{O_2}}}\)phản ứng \( = \left( {x + \dfrac{y}{4} - \dfrac{z}{2}} \right).200 = 800\) \(\Leftrightarrow 3 + \dfrac{3}{2} - \dfrac{z}{2} = 4\) \( \Leftrightarrow \dfrac{z}{2} = \dfrac{1}{2} \Rightarrow z = 1.\) Vậy công thức phân tử của A: C3H6O. Câu 16. Ta có: \(pH = - \lg \left[ {{H^ + }} \right] = - \lg {.10^{ - 3}} = 3\) Mà: \(\left[ {{H^ + }} \right].\left[ {O{H^ - }} \right] = {10^{ - 14}} \) \(\Rightarrow \left[ {O{H^ - }} \right] = \dfrac{{{{10}^{ - 14}}}}{{{{10}^{ - 3}}}} = {10^{ - 11}}\left( {mol/l} \right)\). HocTot.Nam.Name.Vn
|