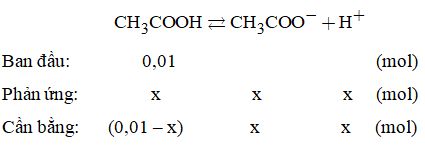Đề số 14 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 14 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Đề bài Câu 1. Cho các dung dịch sau: \(N{a_2}C{O_3};FeC{l_3};AlC{l_3};{K_2}S;NaHS{O_4};{K_2}S{O_3}.\) Số dung dịch có pH>7 là: A.3 B.2 C.1 D.Không xác định Câu 2. Xét cân bằng: Trong đó ion C2H5O- đóng vai trò là: A.một tác nhân oxi hóa. B.một axit theo Bronstet. C.một bazơ theo Bronstet. D.một axit theo Areniut. Câu 3. Trong dung dịch Fe2(SO4)3 loãng chứa 0,9 mol ion \(SO_4^{2 - }\) thì dung dịch có chứa: A.0,9 mol Fe2(SO4)3 B.0,6 mol Fe2(SO4)3 C.0,3 mol Fe2(SO4)3 D.Cả B, C đều đúng. Câu 4.Cho một lượng dung dịch X gồm NaNO3, KNO3 và Ba(NO3)2. Ban đầu thêm một ít bột kẽm vào X thì không có hiện tượng gì. Sau đó nhỏ tiếp một ít dung dịch NaOH vào thì hiện tượng nào mô tả sau đây la đúng? A.Có khí mùi khai thoát ra. B.Có kết tủa trắng. C.Có khí màu nâu đỏ bay ra. D.Có khí không màu bay ra và hóa nâu trong không khí. Câu 5. Để điều chế 300 gam dung dịch HNO3 6,3% từ NaNO3 chứa 10% tạp chất và axit H2SO4 đặc với hiệu suất phản ứng là 90% thì khối lượng NaNO3 đem dùng là: A.30,48 gam B.31,48 gam C.52,10 gam D.40,48 gam Câu 6. Cho 12,9 gam hỗn hợp gồm Al và Mg phản ứng với 100ml dung dịch hỗn hợp gồm HNO3 4M và H2SO4 7M (đậm đặc) thu được 0,1 mol mỗi khí SO2, NO và N2O. Số mol của mỗi kim loại trong hỗn hợp ban đầu lần lượt là: A. 0,3 mol và 0,4 mol B. 0,1 mol và 0,7 mol C. 0,3 mol và 0,2 mol D. 0,5 mol và 0,2 mol Câu 7. Dẫn khí CO qua ống sứ đựng a gam Fe2O3 ở nhiệt độ cao một gian, thu được 6,72 gam hỗn hợp gồm 4 chất rắn. Đem hòa tan hỗn hợp này vào dung dịch HNO3 dư tạo thành 0,448 lít khí NO. Giá trị của a là: A.6,50 gam B.7,20 gam C.9,50 gam D.12,25 gam. Câu 8. Dãy muối nào sau đây không bị nhiệt phân hủy? \(\begin{array}{l}A.CaC{O_3};MgC{O_3};FeC{O_3};Ca{\left( {HC{O_3}} \right)_2}\\B.Mg{\left( {HC{O_3}} \right)_2};KHC{O_3};Ca{\left( {HC{O_3}} \right)_2};N{a_2}C{O_3}\\C.N{a_2}C{O_3};{K_2}C{O_3};C{s_2}C{O_3}\\D.BaC{O_3};{K_2}C{O_3};KHC{O_3};L{i_2}C{O_3}\end{array}\) Câu 8. Dẫn V lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 2 lít dung dịch Ba(OH)2 0,0225 mol/l, thu được 2,955 gam kết tủa. Giá trị của V là: A. 2,24 lít hoặc 10,0 lít. B. 4,48 lít hoặc 6,72 lít. C. 1,68 lít hoặc 1,12 lít. D. 0,336 lít hoặc 1,68 lít. Câu 10. Số đồng phân chứa nhóm OH của hợp chất phản ứng với công thức phân tử C4H10O là: A.2 B.3 C.4 D.5 Câu 11. Hợp chất hữu cơ nào sau đây có đồng phân cis – trants? A.CH3CH=CHCH3 B.\({\left( {C{H_3}} \right)_2} = CHC{H_3}\) C.CH3CH=CHC2H5 D. Cả A và C đều đúng. Câu 12. Số đồng phân ứng với công thức phân tử C3H6Cl2 là: A.4 B.3 C.2 D.5 II. PHẦN TỰ LUẬN Câu 13. Xác định khối lượng nước cần hòa tan 188 gam kali oxit để thu được dung dịch KOH 5,6%. Câu 14. Hòa tan a gam nhôm vào dung dịch HNO3 dư, thu được 10,08 lít khí NO2 (đktc). Tính khối lượng kim loại nhôm đã dùng. Câu 15. Chất hữu cơ B có tỉ khối hơi đối với etan là 2. Hãy xác định công thức phân tử của B, biết B chỉ chứa C, H, O. Câu 16. Lấy 2,5ml dung dịch CH3COOH 4M rồi pha loãng với nước thành 1 lít dung dịch A. Hãy tính độ điện li \(\alpha \) của axit axetic và pH của dung dịch A, biết rằng trong 1ml A có 6,28.1018 ion và phân tử axit khong phân li. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
II. PHẦN TỰ LUẬN Câu 13. Cách 1: \(\begin{array}{l}{K_2}O + {H_2}O \to 2KOH{\rm{ }}\left( 1 \right)\\{\rm{ 2}} \to\;\; \;\;{\rm{ 2 \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, 4 }}\left( {mol} \right)\end{array}\) Ta có: \({n_{{K_2}O}} = \dfrac{{188}}{{94}} = 2\left( {mol} \right)\) Từ (1) \( \Rightarrow {n_{KOH}} = 4\left( {mol} \right) \) \(\Rightarrow {m_{KOH}} = 4 \times 56 = 224\left( {gam} \right)\) Mà: \(C{\% _{KOH}} = \dfrac{{224}}{{{m_{{\rm{dd}}}}}} \times 100\% = 5,6\% \) \(\begin{array}{l} \Rightarrow {m_{{\rm{dd}}}} = \dfrac{{224 \times 100\% }}{{5,6\% }} = 4000\left( {gam} \right)\\ \Rightarrow {m_{{H_2}O}} = 4000 - 188 = 3812\left( {gam} \right)\end{array}\) Cách 2: Gọi x là khối lượng của nước cần dùng Suy ra khối lượng dung dịch thu được: (188 + x) gam Ta có: \({n_{{K_2}O}} = \dfrac{{188}}{{94}} = 2\left( {mol} \right)\) \(\begin{array}{l}{K_2}O + {H_2}O \to 2KOH{\rm{ }}\left( 2 \right)\\{\rm{ 2}} \to\;\;\;\;\; {\rm{ 2 \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, 4 (mol)}}\end{array}\) Từ (2) \( \Rightarrow {n_{KOH}} = 4\left( {mol} \right)\) \(\Rightarrow {m_{KOH}} = 4 \times 56 = 224\left( {gam} \right)\) Mà: \(C{\% _{KOH}} = \dfrac{{224}}{{188 + x}} \times 100\% = 5,6\% \) \( \Leftrightarrow 188 + x = 4000\) \(\Rightarrow x = 3812 = {m_{{H_2}O}}.\) Câu 14. Ta có: \({n_{N{O_2}}} = \dfrac{{10,08}}{{22,4}} = 0,45\left( {mol} \right)\) \(\begin{array}{l}Al + 6HN{O_3} \to Al{\left( {N{O_3}} \right)_3} + 3N{O_2} \uparrow + 3{H_2}O{\rm{ }}\left( 1 \right)\\{\rm{ 0,15 \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, }} \leftarrow {\rm{0,45 }}\left( {mol} \right)\end{array}\) Từ (1) \( \Rightarrow {n_{Al}} = 0,15\left( {mol} \right)\) \(\Rightarrow {m_{Al}} = 0,15 \times 27 = 4,05\left( {gam} \right).\) Câu 15. Gọi công thức tổng quát của B: CxHyOz (với x, y, z \( \in {Z^ + }\)) Ta có: \({d_{B/{C_2}{H_6}}} = \dfrac{{{M_B}}}{{{M_{{C_2}{H_6}}}}} = 2 \) \(\Rightarrow {M_B} = 2 \times 30 = 60{\rm{ }}\left( 1 \right)\) Từ (1) \( \Rightarrow 12x + y + 16z = 60 \) \(\Leftrightarrow 12x + y = 60 - 16z \Rightarrow 0 < z \le 3.\) +) Khi \(z = 1 \Rightarrow 12x + y = 44\) \(\Leftrightarrow y = 44 - 12x\) (2) Cách 1. Vì \(y \le 2x + 2 \Leftrightarrow 44 - 12x \le 2x + 2 \) \(\Rightarrow x \ge 3\) Từ (2) \( \Rightarrow x < \dfrac{{44}}{{12}} = 3,667 \Rightarrow 3 \le x < 3,667\) Vậy nghiệm duy nhất: \(\left\{ \begin{array}{l}x = 3\\y = 8\\z = 1\end{array} \right. \Rightarrow \) CTPT (B): C3H8O. Cách 2.Lập bảng biện luận (với \(y \le 2x + 2\) nguyên dương). Biện luận phương trình: y = 44 – 12x Bảng biện luận: Bảng biện luận:
Vậy công thức phân tử của B: C3H8O. +) Khi \(z = 2 \Rightarrow 12x + y = 28 \) \(\Leftrightarrow y = 28 - 12x\) (3) Cách 1. Vì \(y \le 2x + 2 \Rightarrow 28 - 12x \le 2x + 2\) \( \Rightarrow x \ge 1,857\) và từ (3) \( \Rightarrow x = 2,33\) Suy ra \(1,857 \le x < 2,33\) Vậy: \(\left\{ \begin{array}{l}x = 2\\y = 4\\z = 2\end{array} \right.\) \(\Rightarrow \) CTPT (B): C2H4O2. Cách 2. Lập bảng biện luận ( với \(y \le 2x + 2\) nguyên dương). Biện luận phương trình (3). Vậy công thức phân tử của B: C2H4O2. +) Khi \(z = 3 \Rightarrow 12x + y = 12\) (loại). Câu 16. Số mol CH3COOH là: \(0,005 \times 4 = 0,01\left( {mol} \right)\) Trong 1 lít dung dịch sau khi pha loãng có 6,28.108.103 = 6,28.1021 hạt vi mô (ion và phân tử axit không phân li). Phương trình phân li:
Trong 1 lít dung dịch có: \({n_{C{H_3}COOH}} = 0,01 - x\left( {mol} \right)\) \( \Rightarrow {n_{C{H_3}CO{O^ - }}} = {n_{{H^ + }}} = x\left( {mol} \right)\) Mà tổng số mol sau khi cân bằng: 0,01 + x (mol) \(\begin{array}{l} \Rightarrow 0,01 + x = \dfrac{{6,{{28.10}^{21}}}}{{6,{{02.10}^{23}}}} = 1,{0432.10^{ - 2}}\left( {mol} \right)\\ \Rightarrow x = 0,{0432.10^{ - 2}}\left( {mol} \right)\end{array}\) Vậy: \(\alpha = \dfrac{{0,{{0432.10}^{ - 2}}}}{{{{10}^{ - 2}}}} \times 100\% = 4,32\% \) Và \(pH = - \lg \left( {4,{{32.10}^{ - 4}}} \right) = 3,36.\) HocTot.Nam.Name.Vn
|