Giải đề thi học kì 1 môn hoá lớp 10 năm 2019 - 2020 trường THPT Nguyễn Tất ThànhGiải chi tiết đề thi học kì 1 môn hoá lớp 10 năm 2019 - 2020 trường THPT Nguyễn Tất Thành với cách giải nhanh và chú ý quan trọng PHẦN I: TRẮC NGHIỆM (4 điểm) Câu 1. Cho các ion: Na+, Al3+, SO42-, NH4+, NO3-, Cl-, Ca2+. Hỏi có bao nhiêu anion? A. 2 B. 3 C. 4 D. 5 Câu 2. Liên kết ion là liên kết được hình thành bởi: A. sự góp chung các electron độc thân. B. sự cho – nhận cặp electron hoá trị. C. lực hút tĩnh điện giữa các ion mang điện trái dấu. D. lực hút tĩnh điện giữa các ion dương và electron tự do. Câu 3. Điện hóa trị của nguyên tố Cl trong các hợp chất với các nguyên tố nhóm IA là A. 2- B. 2+ C. 1- D. 1+. Câu 4. Hợp chất trong phân tử có liên kết ion là A. NH4Cl. B. NH3. C. HCl. D. H2O. Câu 5. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết A. cộng hóa trị không cực. B. cộng hóa trị có cực C. ion D. hiđro
Câu 6. Liên kết trong phân tử HF, HCl, HBr, HI đều là A. liên kết ion. B. liên kết cộng hóa trị có cực. C. liên kết cộng hóa trị không cực. D. liên kết đôi. Câu 7. Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion? A. NaF. B. CH4. C. H2O. D. CO2. Câu 8. Số oxi hóa của S trong phân tử SO2 là: A. +2 B. +4 C. +6 D. -1 Câu 9. Trong phản ứng Fe3O4 tác dụng với HNO3 tạo ra sản phẩm Fe(NO3)3, NO và H2O thì một phân tử Fe3O4 sẽ A. nhường 1 electron. B. nhận 1 electron. C. nhường 3 electron. D. nhường 2 electron. Câu 10. Cho phản ứng: CO + Fe2O3 → Fe + CO2. Trong phản ứng trên, CO đóng vai trò là A. chất oxi hóa. B. vừa chất oxi hóa, vừa là chất khử C. oxit trung tính. D. chất khử. Câu 11. Cho các phản ứng sau: (1) 4HCl + MnO2→ MnCl2 + Cl2 + 2H2O. (2) 2HCl + Fe → FeCl2 + H2. (3) 6HCl + 2Al → 2AlCl3 + 3H2. (4) 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O. Các phản ứng trong đó HCl thể hiện tính oxi hóa là A. (2) và (3). B. (1) và (2). C. (1) và (4). D. (3) và (4). Câu 12. Cho phương trình hoá học: Zn + HNO3 → Zn(NO3)2 + N2 + H2O Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là A. 26 B. 28 C. 27 D. 29 II. TỰ LUẬN (7 ĐIỂM) Câu 1: (2 điểm) Cho biết:
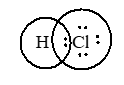
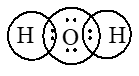
1. Viết cấu hình electron nguyên tử của oxi, canxi và clo. 2. Xét phân tử CaCl2 - Tính hiệu độ âm điện giữa hai nguyên tử Ca và Cl. Cho biết loại liên kết trong phân tử CaCl2 - Mô tả sự hình thành liên kết trong phân tử CaCl2 3. Xét hai phân tử HCl và H2O. Dựa vào hiệu độ âm điện, hãy cho biết phân tử nào có liên kết liên kết cộng hóa trị phân cực? Viết công thức electron và công thức cấu tạo của phân tử đó. Câu 2 (3 điểm): Cân bằng các phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron. Xác định chất oxi hóa, chất khử trong mỗi phản ứng. a. H2S + Br2 + H2O → H2SO4 + HBr b. FeO + HNO3 → Fe(NO3)3 + NO + H2O c. KMnO4 + FeSO4 + H2SO4 → K2SO4 + MnSO4 + Fe2(SO4)3 + H2O Câu 3 (1,5 điểm). Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,30% về khối lượng. Để xác định hàm lượng lưu huỳnh trong một loại nhiên liệu người ta lấy 100,0 g nhiên liệu đó và đốt cháy hoàn toàn. Khí tạo thành chỉ chứa cacbon đioxit, lưu huỳnh đioxit và hơi nước được dẫn vào nước tạo ra 500,0 ml dung dịch. Biết rằng tất cả lưu huỳnh đioxit đã tan vào dung dịch. Lấy 10,0 ml dung dịch này cho tác dụng vừa đủ với 12,5 ml dung dịch KMnO4 5,00.10-3 M. Sản phẩm phản ứng thu được sau phản ứng có K2SO4, MnSO4 và H2SO4. a/ Viết phương trình hóa học giữa SO2 và dung dịch KMnO4. b/ Tính hàm lượng phần trăm (về khối lượng) của lưu huỳnh trong loại nhiên liệu nói trên. Nhiên liệu đó có được phép sử dụng không? Câu 4 (0,5 điểm) Cho 5,68 gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 0,672 lít NO (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Tính giá trị của m. HƯỚNG DẪN GIẢI CHI TIẾT Thực hiện: Ban chuyên môn HocTot.Nam.Name.Vn PHẦN I: TRẮC NGHIỆM
Câu 1 (TH): Phương pháp: - Anion là các ion mang điện tích âm - Cation là các ion mang điện tích dương Cách giải: Các anion là \(SO_4^{2 - },NO_3^ - ,C{l^ - }\) Các cation là \(N{a^ + },A{l^{3 + }},NH_4^ + ,C{a^{2 + }}\) Chọn B. Câu 2 (NB): Phương pháp: Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Cách giải: Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu. Chọn C. Câu 3 (TH): Phương pháp: Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó. Cách giải: Trong hợp chất ion, Cl nhận 1e tạo thành Cl- → Cl có điện hóa trị là 1- Chọn C. Câu 4 (TH): Phương pháp: Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu Cách giải: Hợp chất trong phân tử có liên kết ion là NH4Cl, được hình thành bởi lực hút tĩnh điện giữa 2 ion \(NH_4^ + \)và Cl- Chọn A. Câu 5 (TH): Phương pháp: - Liên kết cộng hóa trị trong đó cặp electron chung lệch về phóa 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực. - Liên kết cộng hóa trị trong đó cặp electron chung không bị lệch về phía nguyên tử nào gọi là liên kết cộng hóa trị không phân cực. - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Cách giải: Liên kết hóa học trong phân tử Br2 là liên kết cộng hóa trị không cực Chọn A. Câu 6 (TH): Phương pháp: - Liên kết cộng hóa trị trong đó cặp electron chung lệch về phóa 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực. - Liên kết cộng hóa trị trong đó cặp electron chung không bị lệch về phía nguyên tử nào gọi là liên kết cộng hóa trị không phân cực. - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Cách giải: Liên kết trong phân tử HF, HCl, HBr, HI đều là các liên kết cộng hóa trị có cực. Chọn B. Câu 7 (TH): Phương pháp: - Nếu \(0 \le {\Delta _X} < 0,4\)thì liên kết được gọi là liên kết cộng hóa trị không cực - Nếu \(0,4 \le {\Delta _X} < 1,7\)thì liên kết được gọi là liên kết cộng hóa trị có cực - Nếu \({\Delta _X} \ge 1,7\)là liên kết ion Với \({\Delta _X}\)là hiệu độ âm điện của 2 nguyên tố. Cách giải: \({\Delta _{NaF}} = 3,98 - 0,93 = 3,05 > 1,7 \to \)liên kết trong phân tử NaF là liên kết ion \({\Delta _{C{H_4}}} = 2,55 - 2,2 = 0,35 < 0,4 \to \)liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực \({\Delta _{{H_2}O}} = 3,44 - 2,2 = 1,24 \to 0,4 \le {\Delta _{{H_2}O}} < 1,7 \to \)liên kết trong phân tử H2O là liên kết cộng hóa trị có cực \({\Delta _{C{O_2}}} = 3,44 - 2,55 = 0,89 \to 0,4 \le {\Delta _{C{O_2}}} < 1,7 \to \)liên kết trong phân tử CO2 là liên kết cộng hóa trị có cực Chọn A. Câu 8 (TH): Phương pháp: - Số oxi hóa của nguyên tố trong các đơn chất bằng không. - Trong một phân tử, tổng số oxi hóa của các nguyên tố bằng 0. - Số oxi hóa của các ion đơn nguyên tử bằng điện tích của ion đó. - Trong hầu hết hợp chất, số oxi hóa của H là +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH2,…). Số oxi hóa của O bằng -2 trừ trường hợp OF2 và peoxit (H2O2, Na2O2,…) Cách giải: Gọi số oxi hóa của S trong phân tử SO2 là x \( \to x + 2.( - 2) = 0 \to x = + 4\) Chọn B. Câu 9 (TH): Phương pháp: Viết các quá trình trao đổi electron và kết luận. Cách giải: \(\mathop {F{{\rm{e}}_3}}\limits^{ + 8/3} {O_4} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {F{\rm{e}}}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O + {H_2}O\) \({\mathop {F{\rm{e}}}\limits^{ + 8/3} _3} \to 3F{{\rm{e}}^{ + 3}} + 1{\rm{e}}\) \(\mathop N\limits^{ + 5} + 3{\rm{e}} \to \mathop N\limits^{ + 2} \) Vậy một phân tử Fe3O4 nhường 1 electron. Chọn A. Câu 10 (TH): Phương pháp: - Chất khử là chất nhường electron - Chất oxi hóa là chất nhận electron. Cách giải: \(\mathop C\limits^{ + 2} O + {\mathop {F{\rm{e}}}\limits^{ + 3} _2}{O_3} \to \mathop {F{\rm{e}}}\limits^0 + \mathop C\limits^{ + 4} {O_2}\) \(\mathop C\limits^{ + 2} \to \mathop C\limits^{ + 4} + 2{\rm{e}}\) \(\mathop {F{\rm{e}}}\limits^{ + 3} + 3{\rm{e}} \to \mathop {F{\rm{e}}}\limits^0 \) C+2 trong CO nhường 2e tạo thành C+4 nên CO đóng vai trò là chất khử. Chọn D. Câu 11 (TH): Phương pháp: - Chất khử là chất nhường electron - Chất oxi hóa là chất nhận electron. Cách giải: (1) HCl là chất khử (2) HCl là chất oxi hóa (3) HCl là chất oxi hóa (4) HCl là chất khử Chọn A. Câu 12 (TH): Phương pháp: - Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi - Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. - Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận. - Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Cách giải: \(\mathop {{\rm{Z}}n}\limits^0 \, + H\mathop N\limits^{ + 5} {O_3} \to \mathop {{\rm{Z}}n}\limits^{ + 2} {(N{O_3})_3} + {\mathop N\limits^0 _2}\, + {H_2}O\) \(\mathop {{\rm{Z}}n}\limits^0 \to \mathop {{\rm{Z}}n}\limits^{ + 2} + 2{\rm{e}}\) |x5 \(2\mathop N\limits^{ + 5} + 10{\rm{e}} \to \mathop {{N_2}}\limits^0 \) |x1 \(5{\rm{Z}}n + 12HN{O_3} \to 5{\rm{Z}}n{(N{O_3})_2} + {N_2} + 6{H_2}O\) Vậy tổng hệ số = 5 + 12 + 5 + 1 + 6 = 29 Chọn D. PHẦN II: TỰ LUẬN Bài 1 (VD) Phương pháp: 1. Các bước viết cấu hình electron nguyên tử - Điền lần lượt các electron vào các phân lớp theo thứ tự tăng dần mức năng lượng. - Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài - Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f) 2. - Xét quá trình hình thành cation và anion tương ứng. - Hai ion tạo thành mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử. Cách giải: 1. Viết cấu hình electron của các nguyên tử - O (z = 8): 1s22s22p4 - Ca (z = 20): 1s22s22p63s23p64s2 - Cl (z = 17): 1s22s22p63s23p5 2. - \({\Delta _{CaC{l_2}}} = 3,16 - 1 = 2,16 \ge 1,7 \to \)liên kết trong phân tử CaCl2 là liên kết ion. - Nguyên tử Canxi nhường 2 electron tạo thành cation Ca2+ \(Ca \to C{a^{2 + }} + 2{\rm{e}}\) Nguyên tử Cl nhận 1 electron tạo thành anion Cl- \(Cl + 1{\rm{e}} \to C{l^ - }\) Cation Ca2+ liên kết với 2 anion Cl- tạo thành phân tử CaCl2 \(C{a^{2 + }} + 2C{l^ - } \to CaC{l_2}\) 3. Xét phân tử HCl: 0,4 < ∆H-Cl = 3,16 – 2,2 = 0,96 < 1,7 → liên kết trong phân tử HCl là liên kết cộng hóa trị có cực Xét phân tử H2O: 0,4 < ∆O-H = 3,44 – 2,2 = 1,24 < 1,7 → liên kết trong phân tử H2O là liên kết cộng hóa trị có cực
Bài 2 (VD) Phương pháp: - Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi - Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. - Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận. - Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Cách giải: a. \({H_2}\mathop {\rm{S}}\limits^{ - 2} + {\mathop {B{\rm{r}}}\limits^0 _2} + {H_2}O \to {H_2}\mathop {\rm{S}}\limits^{ + 6} {O_4} + H\mathop {B{\rm{r}}}\limits^{ - 1} \) \(\mathop {\rm{S}}\limits^{ - 2} \to \mathop {\rm{S}}\limits^{ + 6} + 8{\rm{e}}\) (quá trình oxi hóa) \({\mathop {B{\rm{r}}}\limits^0 _2} + 2{\rm{e}} \to 2\mathop {B{\rm{r}}}\limits^{ - 1} \) (quá trình khử) PTHH: \({H_2}S + 4B{{\rm{r}}_2} + 4{H_2}O \to {H_2}S{O_4} + 8HB{\rm{r}}\) Chất khử: H2S Chất oxi hóa: Br2 b. \(\mathop {F{\rm{e}}}\limits^{ + 2} O + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O + {H_2}O\) \(\mathop {F{\rm{e}}}\limits^{ + 2} \to \mathop {F{\rm{e}}}\limits^{ + 3} + 1{\rm{e}}\)(quá trình oxi hóa) \(\mathop N\limits^{ + 5} + 3{\rm{e}} \to \mathop N\limits^{ + 2} \)(quá trình khử) PTHH: \(3F{\rm{e}}O + 10HN{O_3} \to 3F{\rm{e}}{(N{O_3})_3} + NO + 5{H_2}O\) Chất khử: FeO Chất oxi hóa: HNO3 c. \(K\mathop {Mn}\limits^{ + 7} {O_4} + \mathop {F{\rm{e}}}\limits^{ + 2} S{O_4} + {H_2}S{O_4} \to {K_2}S{O_4} + \mathop {Mn}\limits^{ + 2} S{O_4} + {\mathop {F{\rm{e}}}\limits^{ + 3} _2}{(S{O_4})_3} + {H_2}O\) \(\mathop {Mn}\limits^{ + 7} \, + 5{\rm{e}} \to \mathop {Mn}\limits^{ + 2} \)(quá trình khử) \(\mathop {F{\rm{e}}}\limits^{ + 2} \to \mathop {F{\rm{e}}}\limits^{ + 3} + 1{\rm{e}}\)(quá trình oxi hóa) PTHH: \(2KMn{O_4} + 10FeS{O_4} + 8{H_2}S{O_4} \to {K_2}S{O_4} + 2Mn{\rm{S}}{O_4} + 5F{{\rm{e}}_2}{(S{O_4})_3} + 8{H_2}O\) Chất khử: FeSO4 Chất oxi hóa: KMnO4 Bài 3 (VD) Phương pháp: a. Viết phương trình phản ứng b. - Tính số mol của KMnO4, từ phương trình suy ra số mol SO2 có trong 10 ml dung dịch - Lập tỷ lệ, tính được số mol SO2 có trong 500 ml dung dịch - Bảo toàn nguyên tố S, số mol S trong 100 gam nhiên liệu bằng số mol SO2 có trong 500 ml dung dịch - Tính hàm lượng % về khối lượng của S trong 100 gam nhiên liệu. Cách giải: a. \(5S{O_2} + 2KMn{O_4} + 2{H_2}O \to {K_2}S{O_4} + 2Mn{\rm{S}}{O_4} + 2{H_2}S{O_4}\) b. \({n_{KMn{O_4}}} = {5.10^{ - 3}}.0,0125 = 6,{25.10^{ - 5}}\,\,mol\) Theo phương trình: \({n_{S{O_2}}} = \frac{5}{2}{n_{KMn{O_4}}} = \frac{5}{2}.6,{25.10^{ - 5}} = 1,{5625.10^{ - 4}}\,\,mol\) Vậy số mol S trong 10 ml dung dịch tác dụng với dung dịch KMnO4 là 1,5625.10-4 mol Suy ra số mol S trong 500 ml dung dịch là \(\dfrac{{1,{{5625.10}^{ - 4}}.500}}{{10}} = 7,{8125.10^{ - 3}}\,\,mol\) Vậy số mol S có trong 100 gam nhiên liệu là 7,8125.10-3 mol => hàm lượng S trong nhiên liệu \( = \dfrac{{7,{{8125.10}^{ - 3}}.32}}{{100}}.100\% = 0,25\% < 0,30\% \) Vậy nhiên liệu trên được phép sử dụng. Bài 3 (VDC) Phương pháp: - Quy đổi hỗn hợp X về Fe (x mol) và O (y mol) - Biểu diễn khối lượng của X theo khối lượng Fe và khối lượng O (1) - Áp dụng bảo toàn electron (2) - Từ (1) và (2) tìm ra số mol Fe và O trong X - Bảo toàn nguyên tố Fe tìm ra số mol muối, từ đó tìm được m. Cách giải \({n_{NO}} = \dfrac{{0,672}}{{22,4}} = 0,03\,\,mol\) Quy đổi hỗn hợp X về Fe (x mol) và O (y mol) Ta có: mX = mFe + mO => 56x + 16y = 5,68 (1) Các quá trình trao đổi electron: \(\mathop {F{\rm{e}}}\limits^0 \to \mathop {F{\rm{e}}}\limits^{ + 3} + 3{\rm{e}}\) \(\mathop O\limits^0 + 2{\rm{e}} \to \mathop O\limits^{ - 2} \) \(\mathop N\limits^{ + 5} + 3{\rm{e}} \to \mathop N\limits^{ + 2} \) Áp dụng bảo toàn electron: \(3{n_{F{\rm{e}}}} = 2{n_O} + 3{n_{NO}}\) \( \to 3.x = 2y + 3.0,03 \to 3{\rm{x - 2y = 0,09}}\)(2) Từ (1) và (2) => x = 0,08; y = 0,075 Bảo toàn nguyên tố Fe: \({n_{Fe}} = {n_{Fe{{(N{O_3})}_3}}} = 0,08 \to m = {m_{Fe{{(N{O_3})}_3}}} = 0,08.242 = 19,36g\) HocTot.Nam.Name.Vn
|