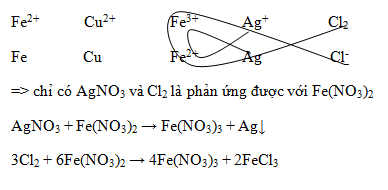50 câu hỏi lý thuyết mức độ thông hiểu về tính chất - dãy điện hóa của kim loại có lời giảiLàm bàiCâu hỏi 1 : Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng chất rắn trong bình tăng lên. Dung dịch X là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 2 : Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3 khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm 2 muối) và chất rắn Y ( gồm 2 kim loại ) . 2 muối trong X là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: (1) Mg + 2Ag+ → Mg2+ + 2Ag (2) Fe + 2Ag+ → Fe2+ + 2Ag (3) Fe2+ + Ag+ → Fe3+ + Ag Vì Chất rắn Y gồm 2 kim loại => đó là Ag và Fe => không thể xảy ra (3) và Ag+ phải hết => X gồm Mg2+ và Fe2+ Đáp án C Câu hỏi 3 : Cho hỗn hợp gồm Zn và Fe vào dung dịch CuSO4, phản ứng xong thu được chất rắn X gồm 2 kim loại và dung dịch Y chứa 3 loại ion. Nhận xét nào sau đây là đúng :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Thứ tự phản ứng : Zn + Cu2+ -> Zn2+ + Cu Fe + Cu2+ -> Fe2+ + Cu => chất rắn gồm 2 kim loại : Cu và Fe Y chứa 3 ion là Zn2+ ; Fe2+ và SO42-. => Zn phản ứng hết, Fe còn dư, CuSO4 hết Đáp án B Câu hỏi 4 : Cho các phản ứng sau: Fe + Cu2+→ Fe2+ + Cu; 2Fe2+ + Cl2→ 2Fe3+ + 2Cl-; 2Fe3+ + Cu → 2Fe2+ + Cu2+ Dãy chất và ion nào sau đây được sắp xếp theo chiều giảm dần tính oxi hóa?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Những phản ứng hóa học luôn có xu hướng tạo thành chất khử hoặc chất oxi hóa yếu hơn những chất ban đầu. 2Fe2++ Cl2 → 2Fe3++ 2Cl- => Tính oxi hóa Fe3+ < Cl2 2Fe3++ Cu → 2Fe2++ Cu2+ => Tính oxi hóa Cu2+ < Fe3+ Như vậy ta có sự so sánh về tính oxi hóa: Cl2 > Fe3+ > Cu2+ > Fe2+ Đáp án C Câu hỏi 5 : Cho phương trình hóa học của phản ứng sau: Fe + CuSO4 → FeSO4 + Cu Phát biểu nào sau đây đúng?
Đáp án: A Phương pháp giải: Lời giải chi tiết: A đúng B sai vì Fe có tính khử mạnh hơn Cu C sai vì Ion Cu2+ có tính oxi hoá mạnh hơn ion Fe2+. D sai Đáp án A Câu hỏi 6 : Ngâm thanh Cu dư vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe dư vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Đáp án A Câu hỏi 7 : Bột Ag có lẫn tạp chất là Fe, Cu và Pb. Muốn có Ag tinh khiết, người ta ngâm hỗn hợp vào một lượng dư dung dịch X, sau đó lọc lấy Ag. Dung dịch X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 8 : Cho các kim loại: Na, Al, Fe, Pb, Cu, Ag. Số kim loại tác dụng với Fe(NO3)3 trong dung dịch?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Kim loại tác dụng trực tiếp với Fe(NO3)3 là : Mg , Al , Fe , Cu , Pb Na tác dụng với H2O trước sau đó tạo NaOH mới tác dụng với Fe(NO3)3 Đáp án A Câu hỏi 9 : Cho các phản ứng xảy ra sau đây: (1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ (2) Mn + 2HCl → MnCl2 + H2↑Dãy các ion được sắp xếp theo chiều tăng dần ính oxi hóa là:
Đáp án: C Phương pháp giải: Theo nguyên tắc anpha : Lời giải chi tiết: Đáp án C Câu hỏi 10 : Cho 2 phương trình rút gịn sau : Fe + Cu2+ -> Fe2+ + Cu Cu + 2Fe3+ -> Cu2+ + 2Fe2+ Nhận xét nào dưới đây đúng :
Đáp án: D Phương pháp giải: Lời giải chi tiết: Các phương trình phản ứng đã cho liên quan đến các cặp oxi hóa khử được sắp xếp trong dãy điện hóa sau : Fe2+/Fe ; Cu2+/Cu ; Fe3+/Fe2+ Theo qui luật biến đổi tính oxi hóa và khử của các chất và ion trong dãy thì : Tính khử : Fe > Cu > Fe2+ Tính oxi hóa : Fe3+ > Cu2+ > Fe2+ Đáp án D Câu hỏi 11 : Cho hỗn hợp chất rắn X gồm Al, Zn và Fe vào dung dịch CuCl2. Sau khi phản ứng xong được hỗn hợp rắn Y và dd Z. Thêm dung dịch NaOH dư vào dung dịch Z thấy xuất hiện kết tủa T. Vậy rắn Y có thể gồm:
Đáp án: C Phương pháp giải: Lời giải chi tiết: \({\rm{ran}}\left\{ {{\rm{Al ; Zn va Fe}}\buildrel {{\rm{ + CuC}}{{\rm{l}}_{\rm{2}}}} \over\longrightarrow } \right.\matrix{ Đáp án C Câu hỏi 12 : Cho biết thứ tự từ trái sang phải của các cặp oxi hóa – khử trong dãy điện hóa như sau: Zn2+/Zn; Fe2+/Fe; Cu2+/ Cu; Fe3+/Fe2+; Ag+/Ag. Các kim loại và ion đều phản ứng được với ion Fe2+ trong dung dịch là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 13 : Hỗn hợp 1,3 mol Mg và x mol Zn vào dung dịch chứa 2 mol Cu2+ và 2 mol Ag+ sau phản ứng hoàn toàn, lọc bỏ phần dung dịch thu được chất rắn gồm 2 kim loại. Gía trị của x có thể là
Đáp án: C Phương pháp giải: Bảo toàn electron Lời giải chi tiết: Hỗn hợp thu được gồm 2 kim loại là Cu và Ag Bảo toàn e: ne( Cu2+; Ag+ nhận) > n e (Mg, Zn nhường) => 2.2 + 2.1 > 1,3.2 + x.2 => x < 1,7 mol Đáp án C Câu hỏi 14 : Trong các ion sau: Ag+, Cu2+, Fe2+, Au3+, ion có tính oxi hóa mạnh nhất là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Ghi nhớ: Kim loại có tính khử càng yếu thì cation của nó có tính oxi hóa càng mạnh Tính oxi hóa: Fe2+ < Cu 2+ < Ag+ < Au3+ => Au 3+ có tính oxi hóa mạnh nhất Đáp án D Câu hỏi 15 : Trong phản ứng : $Cu + 2AgN{O_3} \to Cu(N{O_3}) + 2Ag$ . Phát biểu đúng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 16 : Một tấm kim loại vàng bị bám một lớp Fe ở bề mặt. Ta có thể rửa lớp Fe để loại tạp chất bằng dung dịch nào?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Fe+2FeCl3 -> 3FeCl2 Đáp án D Câu hỏi 17 : Cho Mg vào dung dịch FeSO4, và CuSO4. Sau phản ứng thu được chất rắn A gồm 2 kim loại và dung dịch B chứa 2 muối. Phản ứng kết thúc khi nào?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Hai kim loại là Cu, Fe Hai muối là MgSO4, FeSO4 dư Đáp án D Câu hỏi 18 : Hỗn hợp bột (chứa 2 chất có cùng số mol) nào sau đây không tan hết khi cho vào lượng dư dung dịch H2SO4 (loãng nóng, không có oxi) ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 19 : Cho hỗn hợp gồm Zn và Fe vào dung dịch CuSO4, phản ứng xong thu được chất rắn X gồm 2 kim loại và dung dịch Y chứa 3 loại ion. Nhận xét nào sau đây là đúng :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Thứ tự phản ứng : Zn + Cu2+ → Zn2+ + Cu Fe + Cu2+ → Fe2+ + Cu => chất rắn gồm 2 kim loại : Cu và Fe Y chứa 3 ion là Zn2+ ; Fe2+ và SO42-. => Zn phản ứng hết, Fe còn dư, CuSO4 hết Đáp án B Câu hỏi 20 : Hỗn hợp A gồm 2 kim loại Fe – Cu. Có thể dùng dung dịch nào sau đây để thu được Cu kim loại?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Dùng Cu(NO3)2 vì nó chỉ phản ứng với Fe tạo Cu kim loại Đáp án A Câu hỏi 21 : Cho hỗn hợp X gồm Al, Fe, Cu. Dung dịch nào sau đây khi lấy dư không thể hòa tan hết X :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 22 : Hỗn hợp X gồm Al, Fe2O3 và Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong dung dịch
Đáp án: B Phương pháp giải: Lời giải chi tiết: - Gọi số mol mỗi chất trong X là 1 mol. · Hòa tan X vào NaOH dư thì chỉ có Al tan trong Fe2O3 và Cu không tan. · Hòa tan X vào HCl dư: Hỗn hợp tan hoàn toàn trong dung dịch HCl dư. · Hòa tan X vào AgNO3 dư thì Al và Cu tan trong khi Fe2O3 không tan. · Hòa tan X vào NH3 (dư) thì không có chất nào tan. Chọn B Câu hỏi 23 : Có một hỗn hợp gồm: Fe, Ag, Cu. Tách Ag ra khỏi hỗn hợp với khối lượng không đổi người ta dùng dung dịch
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ag không phản ứng được với dung dịch FeCl3 Đáp án C Câu hỏi 24 : Cho dãy các kim loại: Na, Al; Cu; Fe; Ag. Số kim loại tác dụng được với dung dịch Fe2(SO4)3 là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Các kim loại tác dụng được dd với Fe2(SO4)3 là: Na, Al, Cu, Fe Na + H2O → NaOH + H2↑ 6NaOH + Fe2(SO4)3 → 2Fe(OH)3 ↓ + 3Na2SO4 Al + Fe2(SO4)3 → Al2(SO4)3 + Fe ↓ Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Fe + Fe2(SO4)3 → 3FeSO4 => Có 4 kim loại tác dụng được với dd Fe2(SO4)3 Đáp án A Câu hỏi 25 : Ngâm thanh Cu dư vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe dư vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: \(Cu\,(du)\xrightarrow{{AgN{O_3}}}Cu{(N{O_3})_2}\xrightarrow{{Fe(du)}}Fe{(N{O_3})_2}\) Đáp án A Câu hỏi 26 : Cho hỗn hợp Al, Fe tác dụng với hỗn hợp dung dịch AgNO3, Cu(NO3)2 thu được dung dịch B và chất rắn D gồm 3 kim loại. Cho D tác dụng với HCl dư, thấy có khí bay lên. Thành phần của chất rắn D là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Thứ tự phản ứng: - Kim loại sẽ phản ứng theo thứ tự: Al, Fe - Muối sẽ phản ứng theo thứ tự: AgNO3, Cu(NO3)2 Vậy 3 kim loại là: Fe, Ag, Cu Đáp án A Câu hỏi 27 : Cho các ion kim loại: Zn2+, Sn2+, Ni2+ , Fe2+, Pb2+ . Thứ tự tính oxh giảm dần là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 28 : Dùng hóa chất nào sau với HCl để nhận biết 4 kim loại K, Al, Ag, Fe ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Dùng H2O - Hòa tan các kim loại vào nước. Kim loại tan và sinh ra khí là K - Lấy dung dịch thu được khi hòa tan K cho tác dụng với các dung dịch còn lại, kim loại nào phản ứng sinh ra khí là Al - Cho 2 kim loại còn lại là Fe và Ag phản ứng với HCl, kim loại nào phản ứng với HCl sinh ra khí là Fe Đáp án D Câu hỏi 29 : Cho cấu hình electron nguyên tử của 3 nguyên tố X, Y, Z lần lượt là: 1s22s22p63s2, 1s22s22p63s23p64s2, 1s22s22p63s23p1 . Nếu sắp xếp theo chiều tăng dần tính kim loại thì cách sắp xếp nào sau đây đúng
Đáp án: A Phương pháp giải: Đi theo chiều tăng của điện tích hạt nhân Trong 1 chu kì: R giảm dần Trong 1 nhóm: R tăng dần Lời giải chi tiết: Cấu hình electron nguyên tử của 3 nguyên tố X, Y, Z lần lượt là: X: 1s22s22p63s2 => chu kì 3 nhóm IIA Y: 1s22s22p63s23p64s2=>chu kì 4, nhóm IIA Z: 1s22s22p63s23p1 => chu kì 3 nhóm IIIA => Bán kính: Y > X,Z + Cùng chu kì 3: bán kính của X>Z do ZX < ZZ =>Bán kính: Z<X<Y => Đáp án A Câu hỏi 30 : Cho 3 kim loại Cu, Fe, Al và 4 dung dịch CuSO4, AgNO3, CuCl2 và FeSO4. Kim loại nào sau đây khử được cả 4 dung dịch muối?
Đáp án: A Phương pháp giải: Trong dãy hoạt động hóa học của kim loại, kim loại đứng trước đẩy kim loại đứng sau ra khỏi muối của nó. Lời giải chi tiết: Al đứng trước Cu, Ag, Fe => Al khử được cả 4 dung dịch muối Đáp án A Câu hỏi 31 : Cho phản ứng: Cu +Fe3+→Cu2+ + Fe2+
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 32 : Hãy sắp xếp các ion Cu2+, Hg2+, Fe2+, Pb2+, Ca2+ theo chiều tính oxi hóa tăng dần?
Đáp án: B Phương pháp giải: Ghi nhớ: Kim loại có tính khử càng mạnh thì cation kim loại tương ứng của chúng có tính oxi hóa càng yếu và ngược lại Lời giải chi tiết: Tính oxi hóa tăng dần là: Ca2+ < Fe2+ < Pb2+ < Cu2+ < Hg2+. Đáp án B Câu hỏi 33 : Cho phản ứng hóa học: Mg + CuSO4 → MgSO4 + Cu Quá trình nào dưới đây biểu thị sự oxi hóa của phản ứng trên:
Đáp án: A Phương pháp giải: Ghi nhớ: quá trình oxi hóa là quá trình nhường electron, số oxi hóa của chất sau phản ứng tăng lên Lời giải chi tiết: \(\mathop {Mg}\limits^0 + \mathop {Cu}\limits^{ + 2} S{O_4}\xrightarrow{{}}\mathop {Mg}\limits^{ + 2} S{O_4} + \mathop {Cu}\limits^0 \downarrow \) => Mg có số oxi hóa tăng sau phản ứng => quá trình oxi hóa Mg là: Mg → Mg2+ + 2e. Đáp án A Câu hỏi 34 : Vị trí của một số cặp oxi hóa – khử theo chiều tính khử giảm dần từ trái sang phải được sắp xếp như sau: Fe2+/ Fe, Cu2+ / Cu, Fe3+/Fe2+, Ag+/ Ag, Cl2/Cl- Trong các chất sau: Cu, AgNO3, Cl2. Chất nào tác dụng với dung dịch Fe(NO3)2.
Đáp án: B Phương pháp giải: Ghi nhớ: Quy tắc α Chất khử mạnh + chất oxi hóa mạnh → chất khử yếu + chất oxi hóa yếu Lời giải chi tiết:
Đáp án B Câu hỏi 35 : Cho các phản ứng sau: (1) X + X3+ → X2+ (2) X2+ + Y+ → X3+ + Y Sự sắp xếp đúng với chiều tăng dần tính oxi hóa của các cation là
Đáp án: C Phương pháp giải: Lời giải chi tiết: (1) X3+ có tính oxi hóa mạnh hơn X2+ (2) Y+ có tính oxi hóa mạnh hơn X3+ Vậy tính oxi hóa X2+ < X3+ < Y+ Đáp án C Câu hỏi 36 : Cho dãy các kim loại sau : Ni, Fe, Zn, Na, Cu, Al, Ag. Số kim loại trong dãy khử được ion Fe3+ trong dung dịch muối là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Cho dãy các kim loại sau :, Na, , Ag. Số kim loại trong dãy khử được ion Fe3+ trong dung dịch muối là Ni, Fe, Zn, Cu, Al Chọn B Câu hỏi 37 : Để tách lấy Ag ra khỏi hỗn hợp gồm Fe, Cu, Ag ta dùng lượng dư dung dịch
Đáp án: C Phương pháp giải: Lời giải chi tiết: Tách Ag ra khỏi hỗn hợp Fe, Cu, Ag => ta dùng Fe2(SO4)3 do Ag không tác dụng, còn Fe và Cu tác dụng được Fe + Fe2(SO4)3 → 3FeSO4 Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Đáp án C Câu hỏi 38 : Kim loại Ni phản ứng được với tất cả các muối trong dung dịch của dãy nào sau đây?
Đáp án: D Phương pháp giải: KL mạnh có thể phản ứng được với muối của KL yếu hơn Lời giải chi tiết: Ni có thể phản ứng được với muối của KL yếu hơn A loại NaCl, AlCl3, ZnCl2 B loại NaCl C loại MgSO4 D thỏa mãn Đáp án D Câu hỏi 39 : Cho các ion sau: Al3+, Fe2+, Cu2+, Ag+, Ca2+. Chiều giảm tính oxi hóa của các ion trên là
Đáp án: B Phương pháp giải: Dãy điện hóa được sắp xếp theo chiều tính khử của các KL giảm dần và tính oxi hóa của các ion tăng dần Lời giải chi tiết: Dãy điện hóa được sắp xếp theo chiều tính khử của các KL giảm dần và tính oxi hóa của các ion tăng dần Do đó ta có sự sắp xếp tính oxi hóa: Ag+ > Cu2+ > Fe2+ > Al3+ > Ca2+ Đáp án B Câu hỏi 40 : Cho các phản ứng sau: X + 2X(NO3)3 → 3X(NO3)2 YNO3 + X(NO3)2 → X(NO3)3 + Y Dãy sắp xếp theo thứ tự tăng dần tính oxi hóa các ion kim loại là:
Đáp án: B Phương pháp giải: Phản ứng hóa học xảy ra theo chiều tạo ra các chất có tính khử và tính oxi hóa yếu hơn chất tham gia phản ứng. Lời giải chi tiết: Phản ứng (1) => X3+ có tính oxi hóa mạnh hơn X2+ Phản ứng (2) => Y+ có tính oxi hóa mạnh hơn X3+ Vậy tính oxi hóa: X2+< X3+< Y+ Đáp án B Câu hỏi 41 : Cho các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của dạng oxi hóa như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Có các phát biểu sau: a) Cu khử được Fe3+ thành Fe. b) Cu2+ oxi hóa được Fe2+ thành Fe3+. c) Fe3+ oxi hóa được Cu thành Cu2+. d) Fe2+ oxi hóa được Cu thành Cu2+. Số phát biểu đúng là:
Đáp án: A Phương pháp giải: Dựa vào dãy điện hóa (quy tắc α) Lời giải chi tiết: a) Sai vì Cu chỉ khử được Fe3+ thành Fe2+ b) Sai vì không có phản ứng c) Đúng d) Sai vì không có phản ứng Đáp án A Câu hỏi 42 : Tiến hành các thí nghiệm sau : (1) Nhúng thanh Fe vào dung dịch H2SO4 loãng (2) Nhúng thanh Fe vào dung dịch H2SO4 loãng có thêm CuCl2 (3) Nhúng thanh Cu vào dung dịch FeCl3 (4) Nhúng thanh Fe vào dung dịch Fe2(SO4)3 Số thí nghiệm có sự ăn mòn điện hóa là :
Đáp án: B Phương pháp giải: Phương pháp : Điều kiện để có ăn mòn điện hóa : +) 2 điện cực khác bản chất (KL-KL, KL-PK, …) +) 2 điện cực cùng nhúng vào dung dịch điện ly +) 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp với nhau Lời giải chi tiết: => Các thí nghiệm thỏa mãn : (2) Đáp án B Câu hỏi 43 : Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm hai muối) và chất rắn Y (gồm hai kim loại). Hai muối trong X là
Đáp án: C Phương pháp giải: Thứ tự phản ứng là: Mg, Fe Lời giải chi tiết: 2 kim loại sau phản ứng là: Ag và Fe dư => AgNO3 phản ứng hết nên không có phản ứng: AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ Vậy 2 muối là: Mg(NO3)2 và Fe(NO3)2 Đáp án C Câu hỏi 44 : Cho thứ tự một số cặp oxi hóa khử trong dãy điện hóa như sau: \(\frac{{A{l^{3 + }}}}{{Al}};\frac{{Z{n^{2 + }}}}{{Zn}};\frac{{F{{\rm{e}}^{2 + }}}}{{F{\rm{e}}}};\frac{{C{u^{2 + }}}}{{Cu}};\frac{{F{{\rm{e}}^{3 + }}}}{{F{{\rm{e}}^{{\rm{2 + }}}}}};\frac{{A{g^ + }}}{{Ag}}\) Trong số các kim loại Al, Fe, Zn, Cu, Ag thì số kim loại có phản ứng trong dung dịch Fe(NO3)3 là
Đáp án: C Phương pháp giải: Dựa vào quy tắc α. Lời giải chi tiết: Các kim loại phản ứng được với dung dịch Fe(NO3)3 là: Al, Fe, Zn, Cu. Đáp án C Câu hỏi 45 : Cho hỗn hợp bột gồm Al, Cu vào dung dịch chứa AgNO3 và Fe(NO3)3, sau phản ứng hoàn toàn thu được chất rắn X gồm hai kim loại và dung dịch Y chứa ba muối. Các cation trong dung dịch Y là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Vì sản phẩm gồm 2 kim loại => chắc chắn đó là : Ag và Cu Mà Cu dư thì Fe(NO3)3 phải hết. Dung dịch chứa các muối : Al3+ ; Fe2+ ; Cu2+ Các phản ứng : Al + 3AgNO3 -> Al(NO3)3 + 3Ag Al + 2Fe(NO3)3 -> Al(NO3)3 + Fe(NO3)2 Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag Cu + 2Fe(NO3)3 -> Cu(NO3)2 + 2Fe(NO3)2 Đáp án B Câu hỏi 46 : Cho dãy kim loại sau: K, Ca, Cu, Al, Zn, Ni, Fe, Ag, Mg, Cr, Au, Pb. Số kim loại vừa tác dụng được với dung dịch HCl và vừa tác dụng với HNO3 đặc nguội là
Đáp án: A Phương pháp giải: - Tác dụng với HCl: Những kim loại đứng trước H trong dãy hoạt động hóa học - Những kim loại bị thụ động (hiểu đơn giản là không phản ứng) với axit HNO3 đặc nguội và H2SO4 đặc nguội: Al, Fe, Cr Lời giải chi tiết: - Những KL tác dụng với HCl: K, Ca, Al, Zn, Ni, Fe, Mg, Cr, Pb. - Những KL tác dụng với HNO3 đặc nguội: K, Ca, Cu, Zn, Ni, Ag, Mg, Pb. Như vậy các chất vừa tác dụng với HCl và HNO3 đặc nguội là: K, Ca, Zn, Ni, Mg, Pb. Đáp án A Câu hỏi 47 : Cho phương trình phản ứng aAl +bHNO3 → cAl(NO3)3 + dNO + eH2O.Tỉ lệ a: b là
Đáp án: D Phương pháp giải: Cân bằng phương trình theo phương pháp thăng bằng electron Lời giải chi tiết:
\(\begin{array}{l} Al + 4HNO3 → Al(NO3)3 + NO + 2H2O Vậy a: b = 1: 4 Đáp án D Câu hỏi 48 : Kim loại sắt không phản ứng được với dung dịch nào sau đây?
Đáp án: C Phương pháp giải: Các kim loại Fe, Al, Cr không phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội do bị thụ động hóa trong các axit này. Giải thích thêm về hiện tượng thụ động hóa: hiện tượng này là hiện tượng làm mất khả năng phản ứng của các chất. VD: Khi cho Fe vào HNO3 đặc nguội hoặc H2SO4 đặc nguội sau đó cho vào dd HCl thì Fe không phản ứng được với HCl nữa. Lời giải chi tiết: Kim loại sắt không phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội do bị thụ động hóa trong các axit này. Giải thích thêm về hiện tượng thụ động hóa: hiện tượng này là hiện tượng làm mất khả năng phản ứng của các chất. VD: Khi cho Fe vào HNO3 đặc nguội hoặc H2SO4 đặc nguội sau đó cho vào dd HCl thì Fe không phản ứng được với HCl nữa. Đáp án C Câu hỏi 49 : Cho các phản ứng sau: Fe + 2Fe(NO3)3 → 3Fe(NO3)2; AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag Dãy sắp xếp theo thứ tự tăng dần tính oxi hóa các ion kim loại là:
Đáp án: B Phương pháp giải: Từ phản ứng xảy ra ta suy ra tính oxi hóa của các ion kim loại theo quy tắc α Lời giải chi tiết: Fe + 2Fe(NO3)3 → 3Fe(NO3)2 → Tính oxi hóa của Fe3+ > Fe2+ AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag → Tính oxi hóa của Ag+ > Fe3+ Vậy tính oxi hóa của Ag+ > Fe3+ > Fe2+ Dãy sắp xếp theo thứ tự tăng dần tính oxi hóa các ion kim loại là: Fe2+, Fe3+, Ag+ Đáp án B Câu hỏi 50 : Cho hỗn hợp 2 kim loại Al và Cu vào dung dịch hỗn hợp 2 muối AgNO3 và Ni(NO3)2. Kết thúc phản ứng được rắn X (tan một phần trong dung dịch HCl dư) và thu được dung dịch Y (phản ứng vừa đủ với dung dịch NaOH được tủa gồm 2 hydroxit kim loại). Nhận xét nào sau đây không đúng về thí nghiệm trên
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đầu tiên Al phản ứng với AgNO3 trước (1) Nếu Al còn dư thì phản ứng với Ni(NO3)2 ; Cu không phản ứng (2) Nếu Al hết và AgNO3 dư thì Cu phản ứng với AgNO3 , Ni(NO3)2 giừ nguyên. X tan 1 phần trong HCl => Chứng tỏ giả thuyết (1) đúng => Y gồm Al3+ ; Ni2+ ( có thể ) Mà Y phản ứng với NaOH vừa đủ tạo 2 hydroxit => Y phải có Ni2+ => Rắn X gồm Ag, Cu , Ni Đáp án A
|