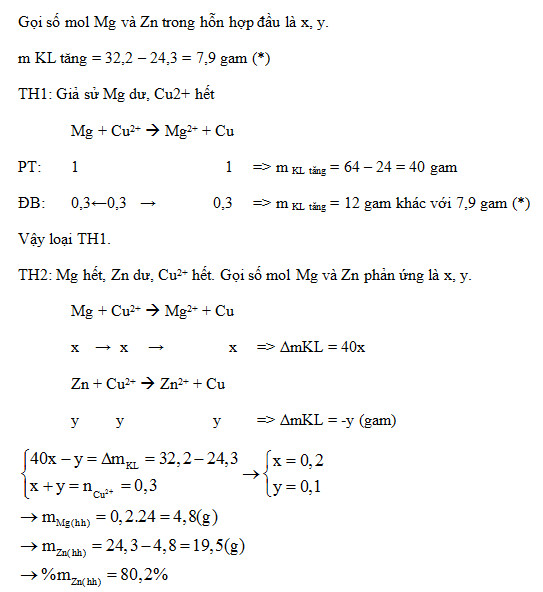20 bài tập về nhiều kim loại tác dụng với một muối có lời giảiLàm bàiCâu hỏi 1 : Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3 khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm 2 muối) và chất rắn Y ( gồm 2 kim loại ) . 2 muối trong X là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: (1) Mg + 2Ag+ → Mg2+ + 2Ag (2) Fe + 2Ag+ → Fe2+ + 2Ag (3) Fe2+ + Ag+ → Fe3+ + Ag Vì Chất rắn Y gồm 2 kim loại => đó là Ag và Fe => không thể xảy ra (3) và Ag+ phải hết => X gồm Mg2+ và Fe2+ Đáp án C Câu hỏi 2 : Hỗn hợp X gồm 3 kim loại: Fe, Ag, Cu. Cho X vào dung dịch Y chỉ chứa 1 chất tan, khuấy kĩ cho đến khi phản ứng kết thúc thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X. Chất tan trong dung dịch Y là
Đáp án: C Phương pháp giải: Dựa vào lí thuyết bài tính chất của kim loại, dãy điện hóa kim loại. Lời giải chi tiết: Ta thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X → Fe2(SO4)3 hòa tan được Cu, Fe. Đáp án C Câu hỏi 3 : Cho 24,3 gam hỗn hợp bột gồm Mg và Zn vào 600 ml dung dịch CuSO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X và 32,2 gam hỗn hợp kim loại. Phần trăm về khối lượng của Zn trong hỗn hợp ban đầu là:
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Đáp án D Câu hỏi 4 : Cho 6,8 gam hỗn hợp X gồm Zn và Fe vào 325ml dung dịch CuSO4 0,2M, sau khi phản ứng hoàn toàn, thu đươc dung dịch và 6,96 gam hỗn hợp kim loại Y. Khối lượng Fe bị oxi bởi ion Cu2+ là:
Đáp án: A Phương pháp giải: Bảo toàn khối lượng , bảo toàn điện tích. Lời giải chi tiết: Do khối lượng kim loại tăng so với ban đầu nên Fe đã phản ứng. Tổng quát : Zn,Fe + CuSO4 -> Zn2+, Fe2+, SO42- + Cu,Fe(dư) + Bảo toàn điện tích: 2nZn2+ + 2nFe2+ = 2nSO4(2-) = 0,13 mol (1) + Bảo toàn khối lượng: mmuối = mX + 160.nCuSO4 – mY = 10,24g Mà ta có: mmuối sau pứ = mion = 65nZn2+ + 56nFe2+ + 96nSO4 => 65nZn2+ + 56nFe2+ + 0,065.96 = 10,24 hay 65nZn2+ + 56nFe2+ = 4 (2) Từ (1,2) => nZn2+ = 0,04 ; nFe2+ = 0,025 mol => mFe bị OXH = 0,025.56 = 1,4g Đáp án A Câu hỏi 5 : Cho hỗn hợp bột gồm 2,7 gam Al và 5,6 gam Fe vào 550 ml dung dịch AgNO3 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án: B Phương pháp giải: Lời giải chi tiết: Al + 3AgNO3→ Al(NO3)3 + 3Ag 0,1 -> 0,3 -> 0,3 (mol) Fe + 2AgNO3→ Fe(NO3)2 + 2Ag 0,1 -> 0,2 -> 0,1 -> 0,2 (mol) Fe(NO3)2 + AgNO3→ Fe(NO3)3 + Ag 0,05 0,05 (mol) Vậy chất rắn gồm : 0,55 mol Ag => m = 59,4g Đáp án B Câu hỏi 6 : Cho 0,42 gam hỗn hợp bột Fe và Al vào 250 ml dung dịch AgNO3 0,12M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 3,333 gam chất rắn. Khối lượng Fe trong hỗn hợp ban đầu là
Đáp án: C Phương pháp giải: So sánh thấy mAg max < mChất rắn => Kim loại dư TH1: Al dư, Fe chưa phản ứng TH2: Al hết, Fe phản ứng 1 phần Lời giải chi tiết: Vì mAg max = 3,24g < 3,333g => Ag+ hết và kim loại còn dư TH1: Al dư, Fe chưa phản ứng Al + 3Ag+ → Al3+ + 3Ag 0,01 ← 0,03 → 0,03 → m chất rắn = m hh KL - mAl pư + mAg = 0,42 - 0,01.27 + 0,03.108 = 3,39 ≠ 3,333 gam (loại) TH2: Al hết, Fe dư => mFe dư = 3,333 - 3,24 = 0,093 gam Các phản ứng: Al + 3Ag → Al3+ + 3Ag Fe + 2Ag → Fe2+ + 2Ag Gọi số mol Al và Fe phản ứng lần lượt là a và b => nAg = 3a + 2b = 0,03 mol; mhh đầu = 0,42g = 27a + 56b + 0,093 => a = 0,009 ; b = 0,0015 mol => mFe(ban đầu) = 0,177g Đáp án C Câu hỏi 7 : Cho hỗn hợp X gồm 0,56 gam Fe và 0,12g Mg tác dụng với 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92 gam kim loại. Nồng độ mol/l của dung dịch CuSO4 là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: nMg = 0,005 mol; nFe = 0,01 mol; Mg + CuSO4 → MgSO4 + Cu Fe + CuSO4 → FeSO4 + Cu - Nếu Mg và Fe đều hết, CuSO4 dư thì lượng Cu sinh ra là: nCu = nMg + nFe = 0,005 + 0,01 = 0,015 mol => mCu = 0,015.64 = 0,96 gam > 0,92 gam => CuSO4 hết, KL còn dư TH1: Mg dư, Fe chưa phản ứng Mg + CuSO4 → MgSO4 + Cu x ← x → x (ĐK để Mg dư là x < 0,005) mKL sau pư = mMg dư + mFe + mCu => 0,12 - 24x + 0,56 + 64x = 0,92 => x = 0,006 (loại) TH2: Mg hết, Fe dư Mg + CuSO4 → MgSO4 + Cu 0,005 → 0,005 → 0,005 Fe + CuSO4 → FeSO4 + Cu y ← y → y mKL sau pư = mFe dư + mCu => 0,56 - 56y + 64(y + 0,005) = 0,92 => y = 0,005 mol => nCuSO4 = 0,005 + y = 0,01 mol => CM dd CuSO4 = 0,01 : 0,25 = 0,04M Đáp án B Câu hỏi 8 : Cho hỗn hợp bột gồm 2,7gam Al và 5,6gam Fe vào 550ml dung dịch AgNO3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là (biết thứ tự trong dãy thế điện hóa Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án: A Phương pháp giải: Al + 3Ag+ → Al3+ + 3Ag bd 0,1 0,55 p/u 0,1 0,3 0,3 sau 0,25 Fe + 2Ag + → Fe2+ + 2Ag bd 0,1 0,25 p/u 0,1 0,2 0,1 0,2 sau 0,05 Ag+ dư tiếp tục phản ứng với Fe2+ Fe2+ + Ag+ → Fe3+ + Ag bđ 0,1 0,05 p/u 0,05 0,05 0,05 => mchất rắn = mAg Lời giải chi tiết: Al + 3Ag+→ Al3+ + 3Ag bd 0,1 0,55 p/u 0,1 0,3 0,3 sau 0,25 Fe + 2Ag + → Fe2+ + 2Ag bd 0,1 0,25 p/u 0,1 0,2 0,1 0,2 sau 0,05 Ag+ dư tiếp tục phản ứng với Fe2+ Fe2+ + Ag+ → Fe3+ + Ag bđ 0,1 0,05 p/u 0,05 0,05 0,05 => mchất rắn = mAg = 108.(0,3+0,2+0,05) = 59,4 gam Đáp án A Câu hỏi 9 : Cho 1 hỗn hợp gồm 3,6g Mg và 6,4g Cu tác dụng với 500ml dung dịch AgNO3 chưa rõ nồng độ. Sau khi các phản ứng xảy ra hoàn toàn được 46,4g rắn B và dung dịch C. Nồng độ mol AgNO3 ban đầu là?
Đáp án: A Phương pháp giải: Giả sử Mg phản ứng hết với AgNO3 Mg + 2Ag+ → Mg2+ + 2Ag 0,15 0,3 => mrắn = 0,3. 108 + 6,4 = 38,8 < 46,4 => Cu tiếp tục phản ứng với AgNO3 Giả sử Cu hết Cu + 2Ag+ → Cu2+ + 2Ag 0,1 0,2 => mrắn = 0,5.108=54 > 46,4 => Cu chỉ phản ứng 1 phần Cu + 2Ag+ → Cu2+ + 2Ag x 2x Cu dư : y \(\left\{ \begin{gathered} Lời giải chi tiết: Giả sử Mg phản ứng hết với AgNO3 Mg + 2Ag+ → Mg2+ + 2Ag 0,15 0,3 => mrắn = 0,3. 108 + 6,4 = 38,8 < 46,4 => Cu tiếp tục phản ứng với AgNO3 Giả sử Cu hết Cu + 2Ag+ → Cu2+ + 2Ag 0,1 0,2 => mrắn = 0,5.108=54 > 46,4 => Cu chỉ phản ứng 1 phần Cu + 2Ag+ → Cu2+ + 2Ag x 2x Cu dư : y \(\left\{ \begin{gathered} => nAgNO3 = 0,3 + 0,1 = 0,4 => CM =0,8 M Đáp án A Câu hỏi 10 : Cho 0,411g hỗn hợp Al và Fe tác dụng với 250ml dung dịch AgNO3 0,12 M. Sau khi các phản ứng xảy ra hoàn toàn được rắn A nặng 3,324g và dung dịch B. Cho NaOH dư vào dung dịch B được kết tủa trắng xanh hóa nâu ngoài không khí. Khối lượng kim loại trong hỗn hợp ban đầu là?
Đáp án: A Phương pháp giải: Cho NaOH dư vào dung dịch B được kết tủa trắng xanh hóa nâu ngoài không khí => B chứa muối Fe(NO3)2 => AgNO3 hết, Fe có thể dư Al + 3Ag+ →Al3+ + 3Ag x 3x 3x Fe + 2Ag+ →Fe2+ + 2Ag y 2x 2y Fe dư : z \(\left\{ \begin{gathered} => mAl , mFe Lời giải chi tiết: Cho NaOH dư vào dung dịch B được kết tủa trắng xanh hóa nâu ngoài không khí => B chứa muối Fe(NO3)2 => AgNO3 hết, Fe có thể dư Al + 3Ag+ →Al3+ + 3Ag x 3x 3x Fe + 2Ag+ →Fe2+ + 2Ag y 2x 2y Fe dư : z \(\left\{ \begin{gathered} => mAl = 0,009.27=0,243 gam mFe = 0,168 gam Đáp án A Câu hỏi 11 : Cho hỗn hợp bột gồm 0,36 gam Mg; 5,6 gam Fe và 2,43 gam Al tác dụng với 400ml dung dịch AgNO3 1M, sau phản ứng thu được m gam chất rắn. Giá trị của m là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 12 : Cho 1,895 gam hỗn hợp bột gồm Zn và Al vào 250 ml dung dịch AgNO3 0,16M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 5,62 gam hỗn hợp kim loại Y. Kết luận nào dưới đây đúng
Đáp án: C Phương pháp giải: Lời giải chi tiết: nAg+ = 0,04 mol => mAg = 4,32g < 5,62g => kim loại ban đầu còn dư => mkim loại phản ứng = 1,895 – ( 5,62 – 4,32) = 0,565g Gọi x, y lần lượt là số mol Zn và Al phản ứng Bảo toàn khối lượng: 65x + 27y = 0,595 Bảo toàn e: 2x + 3y = 0,04 x = 0,005mol và y = 0,01 mol Đáp án C Câu hỏi 13 : Cho 2,7 gam Al và 5,76 gam Fe vào 180 ml dung dịch CuSO4 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
Đáp án: B Phương pháp giải: 3nAl+2nFe > nCu2+ => KL dư, Cu2+ hết BT e: 3nAl + 2nFe pư = 2nCu2+ => nFe pư => mKL = mCu + mFe dư Lời giải chi tiết: nAl = 0,1 mol nFe = 18/175 mol 3nAl+2nFe > nCu2+ => KL dư, Cu2+ hết BT e: 3nAl + 2nFe pư = 2nCu2+ => 0,1.3 + 2x = 2.0,18 => x = 0,03 mol mKL = mCu + mFe dư = 0,18.64 + 5,76 – 0,03.56 = 15,6 gam Đáp án B Câu hỏi 14 : Cho 3,36 gam Fe và 5,12 gam Cu vào 200 ml dung dịch AgNO3 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
Đáp án: D Phương pháp giải: Viết PTHH và tính theo PTHH Chú ý: - Thứ tự phản ứng: Fe, Cu - Có thể có PTHH: Fe2+ + Ag+ → Fe3+ + Ag Lời giải chi tiết: nFe = 3,36:56 = 0,06 mol; nCu = 5,12:64 = 0,08 mol; nAg+ = 0,2 mol Fe + 2Ag+ → Fe2+ + 2Ag 0,06→0,12 → 0,12 (mol) Cu + 2Ag+ → Cu2+ + 2Ag 0,04dư 0,04← 0,08 →0,08 (mol) Chất rắn gồm: Ag (0,2 mol); Cu dư (0,04 mol) => m chất rắn = 0,2.108 + 0,04.64 = 24,16 gam Đáp án D Câu hỏi 15 : Cho 2,7 gam Al và 1,4 gam Fe vào 400 ml dung dịch AgNO3 1M, sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là
Đáp án: D Phương pháp giải: Viết và tính toán theo PTHH. Lời giải chi tiết: nAl = 0,1 mol; nFe = 0,025 mol; nAgNO3 = 0,4 mol Al + 3AgNO3 → Al(NO3)3 + 3Ag 0,1 → 0,3dư 0,1 → 0,3 (mol) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag 0,025 → 0,05dư 0,05 → 0,025 → 0,05 (mol) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag 0,025 ← 0,025 → 0,025 (mol) => m chất rắn = (0,3 + 0,05 + 0,025).108 = 40,5 gam Đáp án D Câu hỏi 16 : Cho hỗn hợp X gồm 0,325 gam Zn và 0,56 gam Fe tác dụng với 100 ml dung dịch Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92 gam kim loại. Nồng độ mol/l của dung dịch Cu(NO3)2 là
Đáp án: C Phương pháp giải: Ta có: nZn = 0,005 mol; nFe = 0,01 mol Thứ tự phản ứng: Zn + Cu(NO3)2 → Zn(NO3)2 + Cu (1) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2) Xét các trường hợp: TH1: Nếu Zn và Fe phản ứng hết TH2: Fe còn dư. Lời giải chi tiết: Ta có: nZn = 0,005 mol; nFe = 0,01 mol Thứ tự phản ứng: Zn + Cu(NO3)2 → Zn(NO3)2+ Cu (1) 0,005 → 0,005 mol Fe + Cu(NO3)2 → Fe(NO3)2+ Cu (2) x → x mol Nếu Zn và Fe phản ứng hết thì theo PT (1) và (2) có: nCu = nZn+ nFe = 0,015 mol → Khối lượng chất rắn là mchất rắn = mCu = 0,015. 64 = 0,96 gam > 0,92 gam (Loại) Vậy sau phản ứng thu được Cu và Fe dư. Đặt nFe pứ (2) = x mol Sau phản ứng thu được (0,005 + x) mol Cu và (0,01 -x) mol Fe dư → 64. (0,005+ x) + 56. (0,01 -x) = 0,92 gam → x = 0,005 mol → nCu(NO3)2 = 0,005 + x = 0,01 mol → CM Cu(NO3)2 = n/Vdd = 0,01/0,1 = 0,1 M Đáp án C Câu hỏi 17 : Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1:2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là:
Đáp án: C Phương pháp giải: Thứ tự phản ứng: Zn + Fe2(SO4)3 → ZnSO4 + 2FeSO4 Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Ta tính lần lượt theo các phương trình trên để xác định kim loại thu được sau phản ứng. Lời giải chi tiết: Đặt nZn = x mol; nCu = 2x mol → 65x + 64.2x = 19,3 gam → x = 0,1 mol Thứ tự phản ứng: Zn + Fe2(SO4)3 → ZnSO4 + 2FeSO4 0,1 0,1 Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 0,1 0,1 Vậy sau phản ứng thu được nCu dư = 0,2 - 0,1 = 0,1 mol → mCu dư = 0,1.64 = 6,4 gam Đáp án C Câu hỏi 18 : Cho 5,5 gam hỗn hợp Al, Fe (được trộn theo tỉ lệ mol lần lượt là 2:1) vào 150 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thì thu được m gam chất rắn X. Giá trị của m là:
Đáp án: A Phương pháp giải: Tính toán theo PTHH. Lời giải chi tiết: nAl = 2nFe; mhh = 27nAl + 56nFe = 5,5 gam → nAl = 0,1; nFe = 0,05 mol nAgNO3 = 0,15.1 = 0,15 mol Thứ tự phản ứng là: Al + 3AgNO3 → Al(NO3)3 + 3Ag 0,05 ← 0,15 → 0,15 mol Vậy chất rắn sau phản ứng gồm: 0,15 mol Ag; 0,05 mol Fe và 0,05 mol Al dư → mrắn = 0,15.108 + 0,05.56 + 0,05.27 = 20,35 gam Đáp án A Câu hỏi 19 : Cho 1,12 g bột sắt và 0,24 g bột Mg vào một bình chứa 250 ml dung dịch CuSO4 rồi khuấy kĩ cho đến khi kết thúc phản ứng. Sau phản ứng, khối lượng kim loại có trong bình là 1,88 g. Nồng độ mol của dung dịch CuSO4 trước phản ứng là
Đáp án: A Phương pháp giải: - Khối lượng mol Cu lớn hơn Fe, Mg → Độ tăng khối lượng kim loại sau phản ứng là ∆m = mKL thu được – mKL ban đầu - Tính ∆ Mg-Cu → Mg phản ứng hết → Số mol Cu2+ phản ứng - Tính ∆ Fe-Cu → Số mol sắt phản ứng → Số mol Cu2+ phản ứng - Tính CM CuSO4 Lời giải chi tiết: nMg = 0,24 / 24 = 0,01 mol; nFe = 1,12 / 56 = 0,02 mol Khối lượng kim loại tăng là: 1,88 - 1,12 - 0,24 = 0,52 (g) Mg là kim loại mạnh hơn Fe nên Mg phản ứng trước. Mg + CuSO4 → MgSO4 + Cu (1) 0,01 → 0,01 (mol) Mg phản ứng hết làm khối lượng tăng là: 64 . 0,01 – 24 . 0,01 = 0,4 (g) Phản ứng của Fe làm khối lượng tăng thêm là: 0,52 - 0,40 = 0,12 (g) Fe + CuSO4 → FeSO4 + Cu (2) Theo (2), ta có: 1 mol CuSO4 phản ứng làm khối lượng tăng 64 - 56 = 8 (g) x mol ← 0,12 g → \(x =\dfrac {{0,12}}{{ 8}} = 0,015(mol)\) Số mol Fe ban đầu là nFe = 0,02 mol > 0,015 mol Vậy Fe còn dư và CuSO4 hết. Nồng độ mol của CuSO4 là: \(C_{MCuSO_4}=\dfrac{{(0,01 + 0,015)\times1000}}{ {250}} =0,1M \) Đáp án A Câu hỏi 20 : Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau mọt thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 loãng dư. Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
Đáp án: B Phương pháp giải: - Vì Z có khối lượng lớn hơn X nên Zn phản ứng hết, Fe phản ứng một phần - Gọi số mol Zn và Fe phản ứng lần lượt là a và b - Biểu diễn khối lượng hỗn hợp X (1) - Biểu diễn khối lượng hỗn hợp Z (2) - Giải ra a, b - Tính %mFe Lời giải chi tiết: Vì mZ > mX nên Zn phản ứng hết, Fe phản ứng một phần Đặt a, b là số mol Zn và Fe đã phản ứng. Ta có: mX = 65a + 56b + 0,28 = 2,7 Và mZ = 64(a + b) + 0,28 = 2,84 → a = b = 0,02 \( \to \% {m_{F{\rm{e}}}} = \frac{{56b + 0,28}}{{{m_X}}}.100\% = 51,85\% \) Đáp án B
|