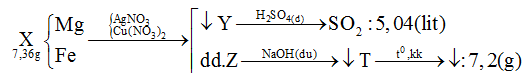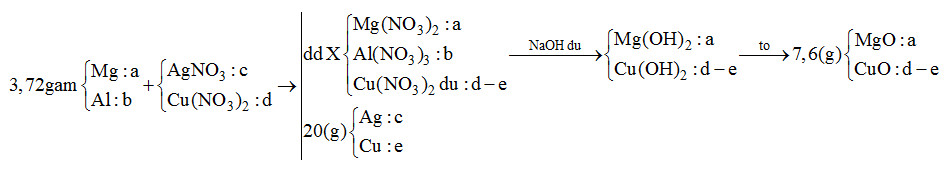30 bài tập vận dụng cao về tính chất hóa học của kim loại có lời giảiLàm bàiCâu hỏi 1 : Thực hiện 2 thí nghiệm : - TN1 : Cho 3,84g Cu phản ứng với 80 ml dung dịch HNO3 1M thấy thoát ra V1 lit khí NO. - TN2 : Cho 3,84g Cu phản ứng với 80 ml dung dịch HNO3 1M và H2SO4 0,5M thấy thoát ra V2 lit khí NO. Biết NO là sản phẩm khử duy nhất. Các thể tích đo ở cùng điều kiện. Quan hệ giữa V1 và V2 là :
Đáp án: C Phương pháp giải: Khi kim loại phản ứng với hỗn hợp axit , trong đó có HNO3 thì nên dùng phương trình ion để không bỏ sót H+ Lời giải chi tiết: Cách giải: TN1 : nCu = 0,06 mol ; nHNO3 = 0,08 mol 3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O => nNO = 0,02 mol (Cu dư) TN2 : nCu = 0,06 mol ; nH+ = 0,16 mol ; nNO3 = 0,08 mol 3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O => nNO = 0,04 mol (Cu và H+ hết , NO3- dư) => V1 : V2 = n1 : n2 = 0,02 : 0,04 = 1 : 2 => V2 = 2V1 Đáp án C Câu hỏi 2 : Cho 33,9 gam hỗn hợp bột Zn và Mg (tỉ lệ mol 1 : 2) tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch A chỉ chứa m gam hỗn hợp các muối trung hòa và 4,48 lít (đkc) hỗn hợp khí B gồm N2O và H2. Hỗn hợp khí B có tỉ khối so với He bằng 8,375. Giá trị gần nhất của m là :
Đáp án: D Phương pháp giải: bảo toàn electron ; Bảo toàn nguyên tố ; Bảo toàn khối lượng. Lời giải chi tiết:
Câu hỏi 3 : Cho 12,56 gam hỗn hợp gồm Mg và Mg(NO3)2 tan vừa đủ trong dung dịch hỗn hợp chứa 0,98 mol HCl và x mol KNO3. Sau phản ứng thu được dung dịch Y chỉ chứa muối clorua và 0,04 mol khí N2. Cô cạn cẩn thận Y thu được m gam muối khan. Biết các phản ứng hoàn toàn. Giá trị của m là
Đáp án: A Phương pháp giải: Bảo toàn e, bảo toàn khối lượng Lời giải chi tiết: Cách giải: Giả sử có tạo muối NH4+ ( a mol ). Khi đó : 2NO3- + 12H+ + 10e → N2 + 6H2O NO3- + 10H+ + 8e → NH4+ + 3H2O => nH+ = 12.nN2 + 10.nNH4+ => a = 0,05 và ne = 0,04.10 + 0,05.8 = 0,8 mol => nMg = 0,8/2 = 0,4 mol => nMg(NO3)2 = 0,02 mol Vậy dung dịch Y chứa : 0,42 mol Mg2+ , 0,05 mol NH4+ , 0,98 mol Cl- và K+ : 0,09 mol => m = 0,42.24 + 0,05.18+ 0,98.35,5 + 0,09.39 = 49,28 gam Đáp án A Câu hỏi 4 : Hòa tan hoàn toàn 30,4 g chất rắn X gồm Cu, CuS, Cu2S và S bằng dung dịch HNO3 dư, thấy thoát ra 20,16 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào Y được m gam kết tủa. Giá trị m gần nhất với giá trị nào sau đây?
Đáp án: C Phương pháp giải: Qui đổi, bảo toàn e Lời giải chi tiết: Cách giải: Qui hỗn hợp X về x mol Cu và y mol S => mX = 64x + 32y = 30,4g Bảo toàn e : 2nCu + 6nS = 3nNO => 2x + 6y = 2,7 mol => x = 0,3 ; y = 0,35 mol Chất kết tủa gồm 0,3 mol Cu(OH)2 và 0,35 mol BaSO4 => m = 110,95g Đáp án C Câu hỏi 5 : Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lít khí (đktc) hỗn hợp khí X gồm các oxit của nito có tỉ khối so với H2 là x. Giá trị của x là:
Đáp án: C Phương pháp giải: Bảo toàn điện tích, bảo toàn nguyên tố, bảo toàn khối lượng Lời giải chi tiết: Cách giải: X chỉ chứa các muối trung hòa gồm Cu2+ ; Mg2+ ; K+ ; SO42- và NH4+ ( nếu có) Bảo toàn điện tích : 2.0,03 + 2.0,09 + 0,07 + nNH4 = 0,16.2 => nNH4 = 0,01 mol Bảo toàn H : 2nH2O = 2nH2SO4 – 4nNH4 = 0,28 mol => nH2O = 0,14 mol Bảo toàn khối lượng : mKL + mKNO3 + mH2SO4 – mH2O – mion muối = mkhí => mkhí = 1,96g => Mkhí = 39,2g => dKhí/H2 = 19,6 Đáp án C Câu hỏi 6 : Hòa tan hết m gam kim loại M cần dùng 136 gam dung dịch HNO3 31,5%. Sau khi kết thúc phản ứng thu được dung dịch X và 0,12 mol khí NO duy nhất. Cô cạn dung dịch X thu được (2,5m + 8,49) gam muối khan. Kim loại M là
Đáp án: C Phương pháp giải: - Bảo toàn khối lượng, bảo toàn electron - Công thức tính nhanh với đề bài cho hỗn hợp rắn phản ứng với HNO3 tạo hỗn hợp sản phẩm khử của Nito: nH+ = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4+ Lời giải chi tiết: nHNO3 = 0,68 mol Vì để tạo 0,12 mol NO thì cần 0,48 mol H+ < 0,68 mol NO3- + 4H+ + 3e → NO + 2H2O => Có tạo NH4+ NO3- + 10H+ + 8e → NH4+ + 3H2O Có: nH+ = 4nNO + 10nNH4+ => nNH4+ = 0,02 mol => nH2O = 0,02.3 + 0,12.2 = 0,3 mol Bảo toàn khối lượng => m + 0,68.63 = 2,5m + 8,49 + 0,12.30 + 0,3.18 => m = 16,9g Có: ne = 3nNO + 8nNH4+ = 0,52 mol Gọi n là hóa trị của M => MM = 16,9 : (0,52/n) =32,5n Với n = 2 thì MM = 65g (Zn) Đáp án C Câu hỏi 7 : Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
Đáp án: D Phương pháp giải: Tăng giảm khối lượng. Lời giải chi tiết:
Câu hỏi 8 : Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO3 a mol/l và Cu(NO3)2 2a mol/l, thu được 45,2 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 7,84 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
Đáp án: B Phương pháp giải: Lời giải chi tiết: \(\left\{ \begin{gathered} Giả sử chất rắn Y gồm Ag (a mol), Cu (2a mol) \({{\text{m}}_{\text{Y}}} = {{\text{m}}_{{\text{Ag}}}} + {{\text{m}}_{{\text{Cu}}}} \Leftrightarrow {\text{108a}} + {\text{64}}{\text{.2a}} = {\text{45}}{\text{,2}} \Leftrightarrow {\text{a}} = {\text{0}}{\text{,192}}\,{\text{mol}}\) \({{\text{n}}_{{\text{e}}\,{\text{nhuong}}}} = {{\text{n}}_{{\text{Ag}}}} + {\text{2}}{{\text{n}}_{{\text{Cu}}}} = {\text{0}}{\text{,192}} + {\text{2}}{\text{.2}}{\text{.0}}{\text{,192}} = {\text{0}}{\text{,96}} > {\text{2}}{{\text{n}}_{{\text{S}}{{\text{O}}_{\text{2}}}}} = {\text{2}}{\text{.0}}{\text{,35}} = {\text{0}}{\text{,7}}\) Mg và Al phản ứng hết và Cu2+ dư. Ta có hệ pt: \(\left\{ \begin{gathered} Đáp án B Câu hỏi 9 : Cho m (g) hỗn hợp Y gồm 2,8g Fe và 0,81g Al vào 200ml dung dịch C chứa AgNO3 và Cu(NO3)2. Khi phản ứng kết thúc được dung dịch D và 8,12g rắn E gồm 3 kim loại. Cho rắn E tác dụng với dd HCl dư thì được 0,672 lít H2(đktc). Tính nồng độ mol các chất trong dd C.
Đáp án: A Phương pháp giải: 3 kim loại gồm: Ag, Cu và Fe dư => nFe dư = nH2 = 0,03 mol Fe -2e →Fe 2+ Al -3e → Al3+ Ag+ +1e →Ag x x x Cu2+ +2e→Cu y 2y y 2H+ +2e→H2 Bảo toàn e => x+2y+0,06 = 0,1+0,09 => x+2y =0,13 (1) mrắn = mAg + mCu + mFe dư = 108x+ 64y + 0,03.56=8,12 => 108x+64y =6,44 (2) (1),(2) =>x,y Lời giải chi tiết: 3 kim loại gồm: Ag, Cu và Fe dư => nFe dư = nH2 = 0,03 mol Fe -2e →Fe 2+ 0,05 0,1 Al -3e → Al3+ 0,03 0,09 Ag+ +1e →Ag x x x Cu2+ +2e→Cu y 2y y 2H+ +2e→H2 0,06 0,03 Bảo toàn e => x+2y+0,06 = 0,1+0,09 => x+2y =0,13 (1) mrắn = mAg + mCu + mFe dư = 108x+ 64y + 0,03.56=8,12 => 108x+64y =6,44 (2) (1),(2) => x= 0,03, y=0,05 => [AgNO3]=0,15M, [Cu(NO3)2]=0,25M Đáp án A Câu hỏi 10 : Hai lá kim loại cùng chất có khối lượng bằng nhau hóa trị II, một được nhúng vào dung dịch Cd(NO3)2 và một được nhúng vào dung dịch Pb(NO3)2. Sau một thời gian người ta lấy các lá kim loại ra khỏi dung dịch nhận thấy khối lượng lá kim loại nhúng vào Cd(NO3)2 tăng 0,47%. Còn lá kia tăng 1,42%. Biết lượng kim loại tham gia 2 phản ứng là bằng nhau. Xác định tên của lá kim loại đã dùng?
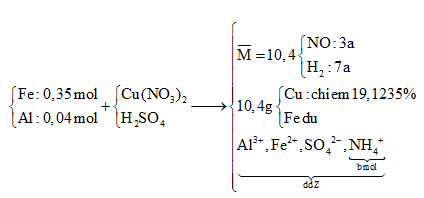
Đáp án: A Phương pháp giải: M + Cd2+ → M2+ + Cd x x 112x-Mx = 0,0047m => (1) M + Pb2+ → M2+ + Pb x x 207x-Mx= 0,0142m (2) (1), (2) => M Lời giải chi tiết: M + Cd2+ → M2+ + Cd x x 112x-Mx = 0,0047m => (1) M + Pb2+ → M2+ + Pb x x 207x-Mx= 0,0142m (2) lấy (1) chia cho (2) => \(\frac{{112 - M}}{{207 - M}} = \frac{{0,0047}}{{0,0142}} \to M = 65(Zn)\) Đáp án A Câu hỏi 11 : Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500 mol dung dịch Y gồm AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn, thu được 20 gam chất rắn Z và dung dịch E. Cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa và nung ngoài không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là
Đáp án: A Phương pháp giải: Lời giải chi tiết: + Thứ tự phản ứng: Mg, Fe AgNO3, Cu(NO3)2 + Do khi cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa và nung ngoài không khí đến khối lượng không đổi, thu hỗn hợp 2 oxit nên AgNO3 và Cu(NO3)2 phản ứng hết, Mg hết. Gọi số mol AgNO3 và Cu(NO3)2 lần lượt là x, y. + 2 oxit: Fe2O3 và MgO (0,15) => mFe2O3 = 8,4-0,15.40 = 2,4 gam => nFe2O3 = 0,015 mol => nFe pư = 0,015.2 = 0,03 mol + Khối lượng chất rắn Z: mZ = mFe dư + mAg + mCu => 0,07.56 + 108x + 64y = 20 (1) + BT e: 2nMg pư + 2nFe pư = nAg + 2nCu => 2.0,15 + 2.0,03 = x+2y (2) Giải (1) và (2) => x = 0,06; y = 0,15 Nồng độ AgNO3 và Cu(NO3)2 ban đầu là 0,12M và 0,3M Đáp án A Câu hỏi 12 : Cho hỗn hợp X gồm 0,35 mol Fe và 0,04 mol Al tác dụng với dung dịch chứa Cu(NO3)2 và H2SO4, thu được dung dịch Y, hỗn hợp hai khí NO và H2 (có tỉ khối so với H2 bằng 5,2) và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại yếu hơn chiếm 19,1235% theo khối lượng). Cô cạn dung dịch Y, thu được hỗn hợp muối khan Z. Phần trăm khối lượng muối nhôm trong Z gần nhất với
Đáp án: C Phương pháp giải:
nCu = (10,4. 0,191235 )/64= 0,03 (mol) => nCu(NO3)2 = 0,03 => nFe dư = 0,145 (mol) => nFe pư = 0,205 (mol) Bảo toàn nguyên tố N ta có: nNO + nNH4+ = 2nCu(NO3)2 => 3a + b = 0,03.2 (1) Bảo toàn e: 2nFe pư + 3nAl = 3nNO + 2nH2 + 8nNH4+ + 2nCu2+ => 23a + 8b = 0,47 (2) Từ (1) và (2) => a = ? và b = ? Bảo toàn điện tích với dung dịch Y gồm Al3+ (0,04 ); Fe2+: (0,205); NH4+ (0,03) và SO42- => nSO4 = ? (mol) => mmuối = mAl3+ + mFe2+ + mNH4+ + mSO42- => % Al2(SO4)3 = ? Lời giải chi tiết: nCu = (10,4. 0,191235 )/64= 0,03 (mol) => nCu(NO3)2 = 0,03 => nFe dư = ( 10,4 -0,03.64)/56 = 0,145 (mol) => nFe pư = 0,35 – 0,145 = 0,205 (mol) Hỗn hợp khí có M = 10,4 => Dùng quy tắc đường chéo => nNO = 3a và nH2 = 7a (mol) Bảo toàn nguyên tố N ta có: nNO + nNH4+ = 2nCu(NO3)2 => 3a + b = 0,03.2 (1) Bảo toàn e: 2nFe pư + 3nAl = 3nNO + 2nH2 + 8nNH4+ + 2nCu2+ => 2.0,205 + 3. 0,04 = 3.3a + 2.7a + 8b + 2. 0,03 => 23a + 8b = 0,47 (2) Từ (1) và (2) => a = 0,01 và b = 0,03 (mol) Bảo toàn điện tích với dung dịch Y gồm Al3+ (0,04 ); Fe2+: (0,205); NH4+ (0,03) và SO42- => 3.0,04 + 2.0,205 = 0,03 + 2nSO4 => nSO4 = 0,28 (mol) => mmuối = mAl3+ + mFe2+ + mNH4+ + mSO42- = 0,04.27 + 0,205.56 + 0,03.18 + 0,28.96 = 39,98 (g) % Al2(SO4)3 = (0,02. 342) :39,98 ).100% = 17,11% ≈ 17,15% Đáp án C Câu hỏi 13 : Cho 22,08 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch chứa AgNO3 x mol/l và Cu(NO3)2 2x mol/lít, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hoàn toàn Y bằng dung dịch H2SO4 đặc nóng (dư), thu được 15,12 lít SO2 (đktc, sản phẩm khử duy nhất). Cho Z tác dụng với NaOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 21,6 gam hỗn hợp rắn E. Giá trị của x là
Đáp án: B Phương pháp giải: Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết Lời giải chi tiết: Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
\(\begin{gathered} Đáp án B Câu hỏi 14 : Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
Đáp án: D Phương pháp giải: Tính được nAgNO3; nCu(NO3)2 Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e. Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = ? => nMg dư = ? Ta có: mX + mY = m + mAg + mCu + mMg dư => m = ? Lời giải chi tiết: nAgNO3 = 0,036 mol nCu(NO3)2 = 0,024 mol Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e. Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol => nMg dư = 0,08 – 0,042 = 0,038 mol Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24 => m = 2,7 gam Đáp án D Câu hỏi 15 : Cho 5,10 gam hỗn hợp gồm Al và Mg vào dung dịch gồm AgNO3 3aM và Cu(NO3)2 4aM, phản ứng hoàn toàn thu được dung dịch X và 29,68 gam chất rắn Y gồm 2 kim loại. Cho Y tác dụng với dung dịch HNO3 đặc, nóng (dư), thu được 11,2 lít khí NO2 (ở đktc, là sản phẩm khử duy nhất). Cho NaOH dư vào dung dịch X, thu được m gam kết tủa. Giá trị m là
Đáp án: A Phương pháp giải: Bảo toàn e, bảo toàn khối lượng Lời giải chi tiết: \(\begin{gathered} Đáp án A Câu hỏi 16 : Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2 thu được chất rắn Y (gồm 3 kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X là:
Đáp án: D Phương pháp giải: Chất rắn sau khi nung chỉ nặng 8,4 gam nên toàn bộ Mg và Fe không thể chuyển hết về oxit vì lúc đó mrắn > 9,2 gam, tức là trong Y phải có chứa Fe dư → AgNO3 và Cu(NO3)2 phản ứng hết Ta có nSO2 = 0,285 mol Đặt x, y, z là số mol Mg, Fe phản ứng và Fe dư → 24x + 56y + 56z = 9,2 gam Bảo toàn electron ta có: 2x + 2y + 3z = 2.0,285 Chất rắn cuối bài gồm MgO: x mol và Fe2O3: y/2 mol → 40x + 160.y/2 = 8,4 gam Giải hệ trên ta có: x; y và z. Lời giải chi tiết: Chất rắn sau khi nung chỉ nặng 8,4 gam nên toàn bộ Mg và Fe không thể chuyển hết về oxit vì lúc đó mrắn > 9,2 gam, tức là trong Y phải có chứa Fe dư → AgNO3 và Cu(NO3)2 phản ứng hết Ta có nSO2 = 0,285 mol Đặt x, y, z là số mol Mg, Fe phản ứng và Fe dư → 24x + 56y + 56z = 9,2 gam Viết quá trình cho e và nhận e cho quá trình X + AgNO3, Cu(NO3)2 → Y . Sau đó Y+ H2SO4: QT cho e: Mg → Mg2++ 2e Fe → Fe2++ 2e Fe → Fe3++ 3e QT nhận e: S+6+ 2e → S+4 Giải hệ trên ta có: x = 0,15; y = 0,03 và z = 0,07 → nFe = 0,1 mol → %mFe = 60,87% Đáp án D Câu hỏi 17 : Cho 9,2 gam hỗn hợp bột X gồm Mg, Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, sau phản ứng thu được chất rắn Y chứa ba kim loại và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư) thu được 6,384 lít khí SO2 (đktc). Cho dung dịch NaOH dư vào dung dịch Z, thu được kết tủa T. Nung T trong không khí đến khi khối lượng không đổi thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm theo khối lượng của Mg trong hỗn hợp X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 18 : Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là:
Đáp án: C Phương pháp giải: Lập sơ đồ cả quá trình diễn biến phản ứng trong đề bài, từ đó biện luận chất rắn cuối cùng gồm thành phần gì, chất nào dư sau phản ứng => thành phần các chất trong các hỗn hợp. Áp dụng định luật bảo toàn electron, bảo toàn nguyên tố để tìm số mol các chất trong X => %mFe(X) Lời giải chi tiết:
- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+ => T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36) => Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước) => kết tủa Y gồm Cu, Ag, Fe. - Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1) - Bảo toàn e cho phản ứng trao đổi muối : 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b - Khi Y + H2SO4 đặc nóng (Fe → Fe3+) Bảo toàn electron : 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol => 2a + 2b + 3c = 0,45 (2) - Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3. Bảo toàn nguyên tố : nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b => mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3) Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol => mFe(X) = 56.(0,03 + 0,05) = 4,48g => %mFe(X) = 4,48 : 7,36 = 60,87% Đáp án C Câu hỏi 19 : Cho 3,72 gam hỗn hợp gồm Mg và Al vào V ml dung dịch chứa AgNO3 x (mol/l) và Cu(NO3)2 y (mol/l). Sau khi kết thúc phản ứng, thu được dung dịch X và 20 gam chất rắn Y. Cho dung dịch NaOH dư vào X, thấy lượng NaOH phản ứng là 18,4 gam. Lọc lấy kết tủa, nung ngoài không khí đến khối lượng không đổi, thu được 7,6 gam hỗn hợp gồm hai oxit. Tỉ lệ x : y là
Đáp án: A Phương pháp giải: Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO => Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư Sơ đồ:
mMg + mAl = 24a + 27b = 3,72 (1) mAg + mCu = 108c + 64e = 20 (2) nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3) mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4) BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5) Giải hệ thu được a, b, c, d, e => x : y = c : d Lời giải chi tiết: Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO => Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư Sơ đồ:
mMg + mAl = 24a + 27b = 3,72 (1) mAg + mCu = 108c + 64e = 20 (2) nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3) mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4) BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5) Giải 5 phương trình trên thu được a = 0,11; b = 0,04; c = 0,12; d = 0,15; e = 0,11 => x : y = c : d = 0,12 : 0,15 = 4 : 5 Đáp án A Câu hỏi 20 : Cho m gam hỗn hợp kim loại gồm Fe và 0,025 mol Mg tác dụng với dung dịch chứa 0,01 mol Fe(NO3)3 và 0,02 mol Cu(NO3)2. Kết thúc phản ứng thu được hỗn hợp Z gồm dung dịch Y và 1,28 gam một kim loại. Cho thêm vào Z 0,1 mol HCl, phản ứng kết thúc thu được V lít khí NO duy nhất (đktc) và dung dịch M. Cho M tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Giá trị của m là
Đáp án: D Phương pháp giải: Vì mkim loại= 1,28 = mCu = 0,02.64→ kim loại chỉ có Cu → dung dịch chỉ chứa Mg(NO3)2 và Fe(NO3)2 → nMg(NO3)2 = ? Bảo toàn điện tích có 2nFe2+ + 2nMg2+ = nNO3-→ nFe2+ = 0,04 mol Z + HCl thì 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O 3Fe +2 + 4H+ + NO3- → 3Fe3+ + NO +2 H2O →tính theo dư hết tìm thành phần trong M Fe2+ + Ag+ → Fe3+ +Ag Ag+ +Cl- → AgCl →m = mAg + mAgCl Lời giải chi tiết: Vì mkim loại= 1,28 = mCu = 0,02.64→ kim loại chỉ có Cu → dung dịch chỉ chứa Mg(NO3)2 và Fe(NO3)2 Ta có nMg(NO3)2 = 0,025 mol( =nMg) Bảo toàn điện tích có 2nFe2+ + 2nMg2+ = nNO3- → 2.0,025 +2 nFe2+ = 0,03.3 + 0,02.2 = 0,13 → nFe2+ = 0,04 mol Z + HCl thì 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O Trước PƯ 0,02 0,1 0,13 Sau PƯ 0 0,467 0,117 3Fe +2 + 4H+ + NO3- → 3Fe3+ + NO +2 H2O Trước PƯ: 0,04 0,0467 0,117 Sau PƯ 0,005 0 0,105 mol Dung dịch M chứa 0,005 mol Fe2+, 0,035 mol Fe3+, 0,1 mol Cl-; 0,025 mol Mg2+; 0,02 mol Cu2+; 0,105 mol NO3- M + AgNO3 thì Fe2+ + Ag+ → Fe3+ +Ag Ag+ +Cl- → AgCl →m = mAg + mAgCl = 0,005.108 + 0,1.143,5 = 14,89 g Đáp án D Câu hỏi 21 : Cho 9,2 gam hỗn hợp X gồm Mg và Fe cho vào dung dịch AgNO3 và Cu(NO3)2 được chất rắn Y gồm 3 kim loại và dung dịch . Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng thu được 6,384 lít SO2 (đktc) – sản phầm khử duy nhất. Cho NaOH dư vào Z thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 8,4 gam hỗn hợp rắn khan. Các phản ứng xảy ra hoàn toàn . % khối lượng Fe ban đầu là
Đáp án: B Phương pháp giải: \(Mg,Fe + (A{g^ + },C{u^{2 + }}) \to \left\langle \begin{gathered}Y:Ag,Cu,Fe\xrightarrow{{ + {H_2}S{O_4}dac,{t^0}}}\underbrace {S{O_2}}_{0,285\,mol} + (F{e^{3 + }},C{u^{2 + }},A{g^ + }) \\Z:M{g^{2 + }},Z{n^{2 + }}\xrightarrow{{ + NaOH}}\underbrace{Mg{{(OH)}_2},Fe{{(OH)}_2}}_T\xrightarrow{{{t^0}}}\underbrace {MgO,F{e_2}{O_3}}_{8,4\,(g)}\\\end{gathered} \right.\) Gọi số mol Mg là x; Fe trong Y là y và Fe trong Z là z →pt m hỗn hợp ban đầu Bảo toàn e : 2x + 3y + 2z = 2nSO2 Pt khối lương T Lời giải chi tiết: \(Mg,Fe + (A{g^ + },C{u^{2 + }}) \to \left\langle \begin{gathered}Y:Ag,Cu,Fe\xrightarrow{{ + {H_2}S{O_4}dac,{t^0}}}\underbrace {S{O_2}}_{0,285\,mol} + (F{e^{3 + }},C{u^{2 + }},A{g^ + }) \\Z:M{g^{2 + }},Z{n^{2 + }}\xrightarrow{{ + NaOH}}\underbrace{Mg{{(OH)}_2},Fe{{(OH)}_2}}_T\xrightarrow{{{t^0}}}\underbrace {MgO,F{e_2}{O_3}}_{8,4\,(g)} \\\end{gathered} \right.\) Gọi số mol Mg là x; Fe trong Y là y và Fe trong Z là z → mX = 24x + 56y + 56z = 9,2 (1) Bảo toàn e : 2x + 3y + 2z = 2nSO2= 2.0,285 = 0,57 (2) mchất rắn = 40x + 80z = 8,4 (3) giải hệ (1), (2) và (3) ⇒ x = 0,15 ; y = 0,07 ; z = 0,03 → %Fe = (0,1.56.100)/9,2 = 60,87% Đáp án B Câu hỏi 22 : Cho 7,22 gam hỗn hợp X gồm Fe và Al (tỉ lệ số mol tương ứng là 5:3) tác dụng với 400ml dung dịch Y chứa Cu(NO3)2 và AgNO3, sau phản ứng thu được dung dịch Z và 16,24 gam chất rắn T gồm 3 kim loại. Cho dung dịch HCl dư vào T thu được 1,344 lít (đktc) khí H2. Biết các phản ứng xảy ra hoàn toàn. Nồng độ mol/l của Cu((NO3)2 và AgNO3 trong Y lần lượt là:
Đáp án: C Phương pháp giải: Cho hh X (Fe, Al) tác dụng với dd Y (Ag+, Cu2+) sau phản ứng thu được rắn T gồm 3 kim loại => rắn T chứa Ag, Cu và Fe dư => Al phản ứng hết. Dùng bảo toàn e Lời giải chi tiết: Đặt nFe = 3a (mol) => nAl = 3a (mol) => 5a.56 + 3a.27 = 7,22 => a = 0,02 (mol) => nFe = 0,1(mol) ; nAl = 0,06 (mol) Cho hh X (Fe, Al) tác dụng với dd Y (Ag+, Cu2+) sau phản ứng thu được rắn T gồm 3 kim loại => rắn T chứa Ag, Cu và Fe dư => Al phản ứng hết. T phản ứng với HCl chỉ có Fe phản ứng tạo ra khí H2: 0,06 (mol) BT e: nFe dư = nH2 = 0,06 (mol) => nFe pư với dd Y = 0,1 - 0,06 = 0,04 (mol) Đặt số mol của Ag+ và Cu2+ lần lượt là x và y (mol) Ta có hệ phương trình: \(\left\{ \matrix{ \( \Rightarrow \left\{ \matrix{ Đáp án C Câu hỏi 23 : Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
Đáp án: C Phương pháp giải: - Khi hỗn hợp A gồm Fe, Zn tác dụng với dung dịch chứa AgNO3, Cu(NO3)2 thì: Bảo toàn khối lượng: mY = m + mAgNO3 + mCu(NO3)2 – mX = 6,422 + m (1) - Cho 0,08 mol một Mg vào dung dịch Y thu được dung dịch T có chứa Mg2+, NO3- và có thể có chứa thêm các ion kim loại trong dung dịch Y. Biện luận kiểm tra xem dung dịch muối cuối cùng gồm những chất nào ? => Chỉ có Mg(NO3)2 Bảo toàn khối lượng: mY + mMg = mMg(NO3)2 + mZ Thay (1) vào => m Lời giải chi tiết: - Khi hỗn hợp A gồm Fe, Zn tác dụng với dung dịch chứa AgNO3, Cu(NO3)2 thì: Bảo toàn khối lượng: mY = m + mAgNO3 + mCu(NO3)2 – mX = 6,422 + m (1) - Cho 0,08 mol một Mg vào dung dịch Y thu được dung dịch T có chứa Mg2+, NO3- và có thể có chứa thêm các ion kim loại trong dung dịch Y. Theo giả thuyết: nMg = nMg2+ = 0,08 mol và nNO3 = 2nCu(NO3)2 + nAgNO3 = 0,084 mol Ta thấy: 2nMg2+ > nNO3 (Vô lý vì không thỏa mãn bảo toàn điện tích) => T chỉ chứa Mg(NO3)2: 0,042 mol Bảo toàn khối lượng: mY + mMg = mMg(NO3)2 + mZ Thay (1) vào ta được: 6,422 + m + 1,92 = 0,042.148 + 4,826 => m = 2,7g Đáp án C Câu hỏi 24 : Cho 11,04 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch chứa AgNO3 a mol/lít và Cu(NO3)2 2a mol/lít, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hoàn toàn Y bằng dung dịch H2SO4 đặc nóng dư thu được 7,56 lít khí SO2 (đktc) (sản phẩm khử duy nhất). Cho Z tác dụng với NaOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 10,8 gam hỗn hợp rắn E. Giá trị của a là:
Đáp án: C Phương pháp giải: Chất rắn sau khi nung nặng 10,8 gam nên toàn bộ lượng Mg và Fe không chuyển hết về oxit trong E được (Lúc đó khối lượng chất rắn E phải lớn hơn 11,04 gam). Vậy trong Y phải có Fe dư → AgNO3 và Cu(NO3)2 đã phản ứng hết. Đặt số mol Mg, Fe phản ứng và Fe dư lần lượt là x, y, z mol Ta có: mhỗn hợp X = 24x + 56y + 56z = 11,04 gam (1) Chất rắn Y gồm: a mol Ag; 2a mol Cu; z mol Fe dư. Dung dịch Z chứa Mg2+ và Fe2+ Quá trình cho e: Mg → Mg2++ 2e Fe → Fe2++ 2e Quá trình nhận e: Ag++ 1e → Ag Cu2++ 2e → Cu Áp dụng bảo toàn electron ta có: 2x+2y =0,15 a + 2.0,3a Khi cho Y tác dụng với H2SO4 đặc nóng dư theo bảo toàn electron ta có: nAg+ 2.nCu+ 3.nFe dư = 2.nSO2 => 0,15 a + 2.0,3a + 3.z = 2.0,3375 (*) => 2x + 2y + 3z = 0,675 (2) Hỗn hợp rắn E gồm x mol MgO và y/2 mol Fe2O3 → 40x + 160.y/2 = 10,8 gam (3) Giải hệ 3 phương trình trên ta có: x; y và z Thay z vào (*) => a Lời giải chi tiết: Ta có: nAgNO3 = 0,15a mol; nCu(NO3)2 = 0,15.2a = 0,3a mol; nSO2 = 0,3375 mol Chất rắn sau khi nung nặng 10,8 gam nên toàn bộ lượng Mg và Fe không chuyển hết về oxit trong E được (Lúc đó khối lượng chất rắn E phải lớn hơn 11,04 gam). Vậy trong Y phải có Fe dư. → AgNO3 và Cu(NO3)2 đã phản ứng hết. Đặt số mol Mg, Fe phản ứng và Fe dư lần lượt là x, y, z mol Ta có: mhỗn hợp X = 24x + 56y + 56z = 11,04 gam (1) Chất rắn Y gồm: a mol Ag; 2a mol Cu; z mol Fe dư. Dung dịch Z chứa Mg2+ và Fe2+ Quá trình cho e: Mg → Mg2++ 2e Fe → Fe2++ 2e Quá trình nhận e: Ag++ 1e → Ag Cu2++ 2e → Cu Áp dụng bảo toàn electron ta có: 2x+2y =0,15 a + 2.0,3a Khi cho Y tác dụng với H2SO4 đặc nóng dư theo bảo toàn electron ta có: nAg+ 2.nCu+ 3.nFe dư = 2.nSO2 ↔0,15 a + 2.0,3a + 3.z = 2.0,3375 (*) ↔2x + 2y + 3z = 0,675 (2) Hỗn hợp rắn E gồm x mol MgO và y/2 mol Fe2O3 → 40x + 160.y/2 = 10,8 gam (3) Giải hệ 3 phương trình trên ta có: x = 0,18; y = 0,045 và z = 0,075 Thay z vào (*) ta có: a = 0,6 Đáp án C Câu hỏi 25 : Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
Đáp án: D Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: AgNO3 : x (mol) Cu(NO3)2 : y (mol) Dd Y : Cu(NO3)2 : 0,5x + y (mol) Dd Z : Fe(NO3)2 : 0,5x + y (mol) Vì sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn nên : 2b = a + c =>2 ( 0,5. x + y). 64 = 108x + 64y + (0,5x + y).56 => 72x = 8y => 9x = y => x : y = 1: 9 Đáp án D Câu hỏi 26 : Cho m gam Al vào dung dịch chứa a mol FeCl3 và a mol CuCl2 thu được 19,008 gam hỗn hợp 2 kim loại. Cho m gam Al vào dung dịch chứa 3a mol AgNO3 và a mol Cu(NO3)2 thu được 69,888 gam hỗn hợp 2 kim loại. Tổng khối lượng của Cu tạo ra trong 2 thí nghiệm gần nhất với:
Đáp án: D Phương pháp giải: Bảo toàn electron Lời giải chi tiết: TN1 thu được 2 kim loại Cu và Fe; TN2 thu được 2 kim loại Ag và Cu ⟹ 2 thí nghiệm Al đều hết Mà 2 thí nghiệm dùng lượng Al như nhau nên lượng e trao đổi của 2 thí nghiệm cũng như nhau *TN1: Kim loại gồm Cu (a mol) và Fe (giả sử là b mol) → mKL(TN1) = 64a + 56b = 19,008 (1) Bảo toàn Fe → nFe2+ = nFe3+ - nFe = a - b (mol) Như vậy, ne nhận (TN1) = 2nCu + 3nFe + nFe2+ = 2a + 3b + (a - b) = 3a + 2b (mol) = ne nhận (TN2) *TN2: Kim loại gồm Ag (3a mol) và Cu ne nhận (TN2) = nAg + 2nCu → nCu = [(3a + 2b) - 3a]/2 = b mol → mKL (TN2) = 108.3a + 64b = 69,888 (2) Giải hệ (1) (2) được a = 0,192 và b = 0,12 Vậy tổng khối lượng Cu của 2 thí nghiệm là: ∑mCu = (0,192 + 0,12).64 = 19,968 gam Đáp án D Câu hỏi 27 : Cho m gam Mg vào dung dịch X gồm 0,036 mol Zn(NO3)2 và 0,060 mol Cu(NO3)2, sau một thời gian thu được 6,300 gam kim loại và dung dịch Y. Cho dung dịch NaOH vào dung dịch Y, thu được lượng kết tủa lớn nhất là 8,004 gam. Giá trị của m là
Đáp án: A Phương pháp giải: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 - Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}}\) - Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = {n_{O{H^ - }(ket\,\,tua)}}\) - Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = {m_{hi{\rm{dr}}oxit}} - {m_{O{H^ - }(hi{\rm{dr}}oxit)}}\) - Bảo toàn khối lượng cho kim loại và ion kim loại để tính m: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) Lời giải chi tiết: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}} = 2.0,036 + 2.0,06 = 0,192(mol)\) Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = 0,192(mol) = {n_{O{H^ - }(ket\,\,tua)}}\) Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = 8,004 - 0,192.17 = 4,74(g)\) Bảo toàn khối lượng cho kim loại và ion kim loại: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) \( \Leftrightarrow m + 0,036.65 + 0,06.64 = 6,3 + 4,74\) \( \Leftrightarrow m = 4,86(g)\) Đáp án A Câu hỏi 28 : Cho m gam hỗn hợp gồm bột Fe và Mg có tỉ lệ mol tương ứng 3 : 1 vào dung dịch chứa Cu(NO3)2 1,2M và AgNO3 0,8M. Kết thúc phản ứng thu được dung dịch X và 22,84 gam rắn Y. Để tác dụng tối đa các chất tan có trong dung dịch X cần dùng dung dịch chứa 0,36 mol NaOH. Giá trị m là
Đáp án: B Phương pháp giải: nCu(NO3)2 : nAgNO3 = 1,2 : 0,8 = 3/2 Đặt nCu(NO3)2 = 3x và nAgNO3 = 2x (mol) X tác dụng với lượng tối đa NaOH tạo thành NaNO3 => nNaNO3 = nNaOH BTNT “N”: 2nCu(NO3)2 + nAgNO3 = nNaNO3 => x => nCu(NO3)2 và nAgNO3 Ta thấy: mCu max + mAg max < 22,84 gam => Cu(NO3)2 và AgNO3 hết, KL dư ĐặtnFe = 3y và nMg = y (mol) TH1: Mg dư, Fe chưa phản ứng TH2: Mg hết, Fe dư Lời giải chi tiết: nCu(NO3)2 : nAgNO3 = 1,2 : 0,8 = 3/2 Đặt nCu(NO3)2 = 3x và nAgNO3 = 2x (mol) X tác dụng với lượng tối đa NaOH tạo thành NaNO3 => nNaNO3 = nNaOH = 0,36 mol BTNT “N”: 2nCu(NO3)2 + nAgNO3 = nNaNO3 => 2.3x + 2x = 0,36 => x = 0,045 => nCu(NO3)2 = 0,135 mol và nAgNO3 = 0,09 mol Ta thấy: 0,135.64 + 0,09.108 = 18,36 gam < 22,84 gam => Cu(NO3)2 và AgNO3 hết, KL dư ĐặtnFe = 3y và nMg = y (mol) TH1: Mg dư, Fe chưa phản ứng BTe: 2nMg = 2nCu + nAg => 2nMg pư = 2.0,135 + 0,09 => nMg pư = 0,18 mol => nMg dư = y – 0,18 mol (y > 0,18 mol) m rắn = mMg dư + mFe + mCu + mAg => 22,84 = 24(y-0,18) + 56.3y + 18,36 => y = 11/240 < 0,18 (loại) TH2: Mg hết, Fe dư m rắn = m Cu + mAg + mFe dư => mFe dư = m rắn – (mCu + mAg) = 22,84 – 18,36 = 4,48 gam => nFe dư = 0,08 mol => nFe pư = 3y – 0,08 (mol) BTe: 2nMg + 2nFe = 2nCu + nAg => 2.y + 2.(3y – 0,08) = 2.0,135 + 0,09 => y = 0,065 => nFe = 0,195 mol và nMg = 0,065 mol => m = 0,195.56 + 0,065.24 = 12,48 gam Đáp án B Câu hỏi 29 : Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3loãng, thu được 5,376 lít (đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2bằng 18. Giá trị của m là
Đáp án: B Phương pháp giải: -Bảo toàn e -Kim loại phản ứng với HNO3 tạo sản phẩm khử thì áp dụng : Công thức : ne = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3
Lời giải chi tiết: Cách giải Có : MX = 36g , nX = 0,24 mol => nN2 = nN2O = 0,12 mol Al sẽ chuyển hết thành Al(NO3)3 => nAl(NO3)3 = nAl = m/27 (mol) => mAl(NO3)3 = 7,89m < 8m => có NH4NO3 => nNH4NO3 = m/720 (mol) Bảo toàn e : 3nAl = 8nN2O + 10nN2 + 8nNH4NO3 => 3.m/27 = 8.0,12 + 10.0,12 + 8.m/720 => m = 21,6g Đáp án B Câu hỏi 30 : Cho m gam bột Fe vào 100 ml dung dịch chứa hai muối AgNO3 0,2M và Cu(NO3)2 0,15M, sau một thời gian thu được 2,16 gam hỗn hợp kim loại và dung dịch X. Cho 4,875 gam bột Zn vào dungdịch X sau khi phản ứng xảy ra hoàn toàn, thu được 5,45 gam hỗn hợp kim loại và dung dịch Y. Giá trị của m là.
Đáp án: C Phương pháp giải: Lời giải chi tiết: Phương pháp: Bảo toàn nguyên tố, bảo toàn khối lượng Lời giải: Bảo toàn N : nNO3(dd dầu) = nNO3(dd Y) = 0,05 mol nZn = 0,075 mol > nNO3 => Zn dư => Y chỉ có 0,025 mol Zn(NO3)2 Bảo toàn khối lượng : mmuối X + mZn = mrắn(2) + mZn(NO3)2 => mmuối X = 5,3g Bảo toàn khối lượng : mmuối (dd đầu) + mFe = mrắn(1) + mmuối X => mFe = 1,24g Đáp án C
|