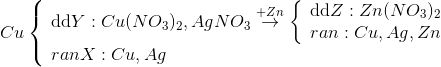20 bài tập một kim loại tác dụng với một muối có lời giải (phần 1)Làm bàiCâu hỏi 1 : Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng?
Đáp án: B Phương pháp giải: Lời giải chi tiết: nAgNO3 = 0,02 mol 2Ag+ + Zn → 2Ag + Zn2+ 0,02 0,01 0,02 m tăng = mAg – mZn = 0,02 . 108 – 0,01 . 65 = 1,51g Đáp án B Câu hỏi 2 : Cho vào cốc thủy tinh chứa 100 ml dung dịch CuSO4 0,1M một mẩu kim loại sắt có khối lượng 5,6 gam. Sau khi phản ứng hoàn toàn, khối lượng (gam) kim loại có trong cốc là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Số mol Fe = 0,1 mol ; Cu2+ = 0,01 mol. PT pứ: Fe + Cu2+ → Fe2+ + Cu Số mol Fe phản ứng = 0,01 mol và dư 0,09 mol ; tạo thành 0,01 mol Cu . => ∑ khối lượng kim loại trong cốc là: = 5,68 gam. Đáp án B Câu hỏi 3 : Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Fe + CuSO4 -> FeSO4 + Cu nFe = 0,04 mol ; nCuSO4 = 0,01 mol => chất rắn gồm : 0,01 mol Cu và 0,03 mol Fe => m = 2,32g Đáp án B Câu hỏi 4 : Khuấy kĩ dung dịch chứa 13,60g AgNO3 với m gam Cu rồi thêm tiếp 100 ml dung dịch H2SO4 loãng dư . Đun nóng tới khi phản ứng hoàn toàn thu được 9,28g kim loại và V lit khí NO. Giá trị của m và V là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: nAgNO3 = 0,08 mol Cu + 2Ag+ → Cu2+ + 2Ag Mol 0,04 → 0,08 → 0,08 mKL = 9,28g = mAg + mCu => nCu dư= 0,01 mol Sau phản ứng có Cu dư nên => NO3- hết 3Cu + 8H+dư + 2NO3- → 3Cu2+ + 2NO + 4H2O Mol 0,12 ← 0,08 → 0,08 => mCu = 10,88g ; VNO = 1,792 l Đáp án C Câu hỏi 5 : Cho m gam Cu vao dd chứa 0,04 mol AgNO3 một thời gian thu được dd Y và 3,88 g chất rắn X. Cho 2,925 g Zn vào dd Y đến phản ứng hoàn toàn thu được dd Z và 3,217 g chất rắn T. Tính m :
Đáp án: D Phương pháp giải: Phương pháp : Bảo toàn khối lượng Bảo toàn điện tích Lời giải chi tiết:
Hướng dẫn giải : nZn =0,052 > nAgNO3 → dd Z chỉ chứa Zn(NO3)2 Bảo toàn số mol NO3 thì nZn(NO3)2(Z) =0,02 mol→ rắn T có mZn = 2,925-0,02.65=1,625g Trong rắn T đặt nCu =x, nAg =y → 64x + 108y=3,217-1,625 = 1,592(g) Bảo toàn điện tích trong dd Y có 2x + y =0,04 → x =0,018 mol y =0,004 mol Bảo toàn khối lượng Cu và Ag trong phản ứng td với AgNO3 có m + 0,04.108=mCu(Y) +mAg(Y) +3,88 → m =0,018.64+0,004.108+3,88-0,04.108=1,152 (g) Đáp án D Câu hỏi 6 : Nhúng thanh Mg vào dung dịch chứa 0,1 mol muối sunfat trung hòa của một kim loại M, sau phản ứng hoàn toàn lấy thanh Mg ra thấy khối lượng thanh Mg tăng 4,0 gam. Số muối của kim loại M thỏa mãn là
Đáp án: A Phương pháp giải: Phương pháp : Tăng giảm khối lượng Lời giải chi tiết:
Hướng dẫn Giải : Với 0,1 mol sẽ tăng 0,1 . ( MM – MMg ) = 4 => MM = 24 + 40 = 64 => là Cu => Ngoài muối CuSO4 còn có thể là CuCl2 , Cu(NO3)2 ( các muối tan của đồng ) ( Bản chất của phản ứng là kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối , còn gốc muối gì cũng được miễn là phải tan trong nước ) Đáp án A Câu hỏi 7 : Cho 6,5 gam bột Zn vào dung dịch CuSO4 dư, sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 8 : Cho 2a mol bột sắt Fe vào dung dịch chứa 5a mol AgNO3, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các muối nào?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag 2a → 4a → 2a Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag a ← a → a Vậy dd thu được gồm Fe(NO3)2: a mol và Fe(NO3)3: a mol Đáp án D Câu hỏi 9 : Ngâm lá kẽm trong 100ml dung dịch AgNO3 0,1M. Biết phản ứng xảy ra hoàn toàn. Khi phản ứng kết thúc, khối lượng lá kẽm tăng lên là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: nAgNO3 = 0,01 mol Do Zn dư nên AgNO3 phản ứng hết. Zn + 2AgNO3 → Zn(NO3)2 + 2Ag 0,005 ← 0,01 → 0,01 (mol) m lá kẽm tăng = mAg bám vào – mZn tan ra = 0,01.108 – 0,005.65 = 0,755 gam Đáp án C Câu hỏi 10 : Cho 0,01 mol Fe vào 50 ml dung dịch AgNO3 1M. Sau khi phản ứng kết thúc thì lượng Ag thu được
Đáp án: B Phương pháp giải: Lời giải chi tiết: nAgNO3 = 0,05 mol Fe + 2Ag+ → Fe2+ + 2Ag Bđ: 0,01 0,05 Pư: 0,01 → 0,02 → 0,01 → 0,02 (mol) Sau: 0 0,03 0,01 0,02 Fe2+ + Ag+ → Fe3+ + Ag 0,01 → 0,01 → 0,01 nAg = 0,02 + 0,01 = 0,03 mol => mAg = 0,03.108 = 3,24 gam Đáp án B Câu hỏi 11 : Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
Đáp án: D Phương pháp giải: Zn + 2Fe3+ → Zn2+ + 2Fe2+ 0,12….0,24…………….0,24 Zn + Fe2+ → Zn2+ + Fe x……………………x → mdd tăng = mZn - mFe= 65(0,12 + x) – 56x = 9,6 → x => nZn ban đầu Lời giải chi tiết: \(\begin{gathered}{n_{F{{\text{e}}_2}{{(S{O_4})}_3}}} = 0,24.0,5 = 0,12mol \hfill \\n{}_{F{{\text{e}}^{3 + }}} = 0,24 \hfill \\\end{gathered} \) Zn + 2Fe3+ → Zn2+ + 2Fe2+ 0,12….0,24…………….0,24 Zn + Fe2+ → Zn2+ + Fe x……………………x → mdd tăng = mZn - mFe= 65(0,12 + x) – 56x = 9,6 → x = 0,2 => nZn ban đầu = 0,12+ 0,2 = 0,23 mol => mZn = 0,32.65 =28,8 gam Đáp án D Câu hỏi 12 : Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là
Đáp án: A Phương pháp giải: Mg + 2FeCl3→ MgCl2 + 2FeCl2 0,06 0,12 0,12 Giả sử FeCl2 hết => mrắn = mFe + mMg dư = 0,12.56 + mMg dư = 6,72 + mMg dư > 3,36 => Mg hết , FeCl2 dư. Chất rắn sau phản ứng là Fe => n Fe dư = 3,36:56 = 0,06 Mg + FeCl2→MgCl2 + Fe 0,06 0,06 => mMg Lời giải chi tiết: Mg + 2FeCl3→ MgCl2 + 2FeCl2 0,06 0,12 0,12 Giả sử FeCl2 hết => mrắn = mFe + mMg dư = 0,12.56 + mMg dư = 6,72 + mMg dư > 3,36 => Mg hết , FeCl2 dư. Chất rắn sau phản ứng là Fe => n Fe dư = 3,36:56 = 0,06 Mg + FeCl2→MgCl2 + Fe 0,06 0,06 => mMg =(0,06+0,06).24=2,88(g) Đáp án A Câu hỏi 13 : Cho m gam bột sắt vào dung dịch hỗn hợp gồm0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kimloại. Giá trị của m là
Đáp án: D Phương pháp giải: Fe + Cu2+ → Fe2+ + Cu 0,15 0,15 0,15 Fe + 2H+ → Fe2+ + H2 0,1 0,2 Thu được hỗn hợp kim loại => Fe còn dư → mhh = m – mFe p/u + mCu = 0,725m → m Lời giải chi tiết: Fe + Cu2+ → Fe2+ + Cu 0,15 0,15 0,15 Fe + 2H+ → Fe2+ + H2 0,1 0,2 Thu được hỗn hợp kim loại => Fe còn dư → mhh = m – mFe p/u + mCu = m – ( 0,15 + 0,1 ).56 + 0,15.64 = 0,725m → m = 16 gam. Đáp án D Câu hỏi 14 : Một thanh kim loại M hóa trị II nhúng vào 1 lít dd CuSO4 0,5M sau khi lấy thanh M ra khỏi dd thấy khối lượng tăng 1,6g, nồng độ CuSO4 gỉam còn 0,3M. Xác định M?
Đáp án: B Phương pháp giải: Viết PT ion rút gọn, tính toán theo phương trình \({n_{C{u^{2 + }}}} = 1.(0,5 - 0,3) = 0,2mol\) M+ Cu2+ → M2+ + Cu mthanh KL tăng => M Lời giải chi tiết: \({n_{C{u^{2 + }}}} = 1.(0,5 - 0,3) = 0,2mol\) M+ Cu2+ → M2+ + Cu 0,2 0,2 0,2 => mthanh KL tăng = 1,6= 64.0,2- 0,2.M => M= 56(Fe) Đáp án B Câu hỏi 15 : Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7 gam hỗn hợp rắn X và dung dịch Y. Lọc tách X, rồi thêm 3,9 gam bột Zn vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được 6,14 gam chất rắn. Giá trị của m là
Đáp án: A Phương pháp giải: Lời giải chi tiết: nZn = 0,06 mol > ½ nNO3 => Zn dư , dung dịch muối Y chỉ có Zn(NO3)2 với số mol là 0,04 mol Bảo toàn khối lượng : mZn + mY = mZn(NO3)2 + mrắn => my = 9,8g Và : mCu + mAgNO3 = mX + mY => mCu = m = 3,2g Câu hỏi 16 : Cho m gam bột Zn vào 100 ml dung dịch Fe2(SO4)3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 2,85 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Khối lượng dung dịch tăng = khối lượng thanh kim loại giảm Zn → Zn 2+ + 2e Fe3+ +1e → Fe2+ 0,03 + x ←0,06+ 2x 0,06 → 0,06 Fe2+ + 2e → Fe 2x← x => mdd tăng = 65 ( 0,03 + x) – 56x = 9x + 1,95 = 2,85 => x = 0,1 => m = 8,45 Đáp án A Câu hỏi 17 : Cho 8,96 gam Fe vào 440 ml dung dịch AgNO3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X và m gam kim loại. Khối lượng muối Fe(NO3)2 có trong dung dịch là
Đáp án: B Phương pháp giải: Viết và tính theo PTHH. Fe + 2Ag+ → Fe2+ + 2Ag Chú ý phản ứng sau: Fe2+ + Ag+ → Fe3+ + Ag Lời giải chi tiết: nFe = 8,96 : 56 = 0,16 mol; nAgNO3 = 0,44 mol Fe + 2Ag+ → Fe2+ + 2Ag 0,16 → 0,32dư 0,12 → 0,16 → 0,32 (mol) Fe2+ + Ag+ → Fe3+ + Ag 0,12dư 0,04 ← 0,12 → 0,12 (mol) Vậy mFe(NO3)2 = 0,04.180 = 7,2 gam Đáp án B Câu hỏi 18 : Ngâm một thanh kim loại M hóa trị II trong 200 ml dung dịch Cu(NO3)2 0,4M đến khi dung dịch hết màu xanh. Biết rằng toàn bộ Cu sinh ra đều bám hết lên thanh M, khối lượng thanh M tăng 0,64 gam. Nguyên tử khối của M là:
Đáp án: B Phương pháp giải: Tính toán theo phương trình ion: M + Cu2+ → M2+ + Cu Lời giải chi tiết: Vì dung dịch hết màu xanh sau phản ứng => Cu2+ phản ứng hết nCu2+ = 0,2.0,4 = 0,08 mol PT ion: M + Cu2+ → M2+ + Cu => nM = nCu = nCu2+ = 0,08 mol => mKL tăng = mCu - mM pứ => 64.0,08 - 0,08M = 0,64 => M = 56 (Fe) Đáp án B Câu hỏi 19 : Ngâm một đinh sắt trong 200 ml dung dịch CuSO4 xM. Sau khi phản ứng hoàn toàn, lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 1,6 gam. Giả sử tất cả lượng Cu sinh ra đều bám hết vào đinh sắt. Giá trị của x là
Đáp án: D Phương pháp giải: Fe + CuSO4 → FeSO4 + Cu↓ Khối lượng đinh sắt tăng là mđinh sắt tăng = mCu sinh ra - mFe phản ứng Từ đó tìm được giá trị x. Lời giải chi tiết: Fe + CuSO4 → FeSO4 + Cu↓ Theo PTHH ta có: nCu = nFe phản ứng = nCuSO4 = 0,2x mol Khối lượng đinh sắt tăng là mđinh sắt tăng = mCu sinh ra - mFe phản ứng = 64. 0,2x - 56. 0,2x = 1,6 gam Giải phương trình trên tìm được x = 1,0 M Đáp án D Câu hỏi 20 : Tiến hành hai thí nghiệm sau: - Thí nghiệm 1: Cho m gam bột Fe (dư) vào V1 lít dung dịch Cu(NO3)2 1M. - Thí nghiệm 2: Cho m gam bột Fe (dư) vào V2 lít dung dịch AgNO3 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm đều bằng nhau. Biểu thức biểu diễn mối quan hệ giữa V1 và V2 là
Đáp án: B Phương pháp giải: - TN1: Tính khối lượng chất rắn thu được m1 = m + mCu – mFe - TN2: Tính khối lượng chất rắn thu được m2 = m + mAg - mFe - m1 = m2 → Mối liên hệ V1 và V2 Lời giải chi tiết: Do Fe dư nên cả hai trường hợp muối đều phản ứng hết. Thí nghiệm 1: Khối lượng rắn thu được là: \({m_1} = m + \left( {64-56} \right).{V_1}\left( g \right)\) Thí nghiệm 2: Khối lượng rắn thu được là: \({m_2} = m + (108.0,1.{V_2} - 56.\frac{{0,1 \times {V_2}}}{2})(g)\) Mà m1 = m2 → V1 = V2 Đáp án B
|