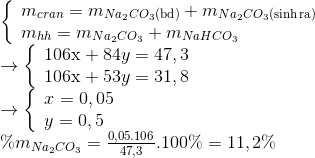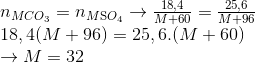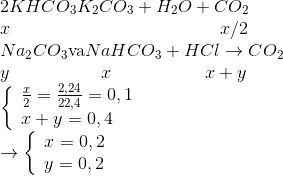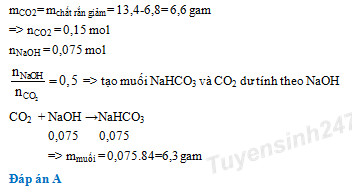40 bài tập về muối cacbonat có lời giảiLàm bàiCâu hỏi 1 : Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Đáp án: D Phương pháp giải: Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết: Phản ứng xảy ra theo thứ tự sau: CO32- + H+ → HCO3- (1) 0,15 → 0,15dư 0,05 → 0,15 (mol) HCO3- + H+ → CO2 + H2O (2) 0,05 ← 0,05 → 0,05 (mol) → V = 1,12 lít Đáp án D Câu hỏi 2 : Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
Đáp án: D Phương pháp giải: Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết: Phản ứng xảy ra theo thứ tự sau: CO32- + H+ → HCO3- (1) 0,02mol → 0,02mol → 0,02mol HCO3- + H+ → CO2 + H2O(2) 0,01mol← 0,01mol→ 0,01mol Sau phản ứng (2) HCO3- còn dư 0,03 mol Vậy số mol CO2 là 0,01 mol. Đáp án D Câu hỏi 3 : Nhỏ từ từ từng giọt dung dịch chứa 0,05 mol HCl vào dung dịch chứa 0,06 mol Na2CO3. Thể tích khí CO2 thu được (đktc) thu được bằng:
Đáp án: A Phương pháp giải: Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết: Na2CO3 + HCl →NaHCO3 + NaCl(1) 0,05mol ← 0,05mol Sau phản ứng (1) không còn axit nên không tạo khí CO2 Đáp án A Câu hỏi 4 : Hoà tan hoàn toàn 19,2 hỗn họp gồm CaCO3 và MgCO3 trong dung dịch HCl dư thấy thoát ra V (lít) CO2 (đktc) và dung dịch sau phản ứng có chứa 21,4 gam hỗn hợp muối. Xác định V:
Đáp án: C Phương pháp giải: Lời giải chi tiết:
Câu hỏi 5 : Cho 200 ml dung dịch HCl từ từ vào 200 ml dung dịch Na2CO3 thấy thoát ra 2,24 lít CO2 (đktc). Thêm nước vôi trong dư vào thấy xuất hiện 10 gam kết tủa nữa. Vậy nồng độ mol/l của dung dịch HCl và dung dịch Na2CO3 tương ứng là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Phương pháp: Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải: nCO2 = 0,1 mol n CaCO3 = 0,1 mol Bảo toàn C => nNa2CO3 = 0,2 mol => CM = 1M nHCl = nNa2CO3 + nCO2 = 0,2 + 0,1 = 0,3 mol => CM = 1,5M Đáp án C Câu hỏi 6 : Cho 150ml dung dịch Na2CO3 1M và K2CO3 0,5M vào 250ml dung dịch HCl 2M thì thể tích khí CO2 sinh ra ở đktc là bao nhiêu lít:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Phương pháp: Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải: nCO32- = 0,225mol nH+ = 0,5mol > 2nCO32- => nCO2 = nCO32- = 0,225mol => V = 5,04 lít Đáp án D Câu hỏi 7 : Cho 10 gam CaCO3 tác dụng với axit HCl dư rồi dẫn sản phẩm khí đi qua 60 gam dung dịch NaOH 10% cho phản ứng xảy ra hoàn toàn được dung dịch B. Khối lượng muối có trong dung dịch B là
Đáp án: C Phương pháp giải: Bài toán hấp thụ CO2 vào dung dịch kiềm: (*) = nOH-/nCO2 + Nếu (*) ≤ 1 thì chỉ tạo muối HCO3- CO2 + OH- → HCO3- + Nếu 1 < (*) < 2 => Tạo HCO3- và CO32- CO2 + 2OH- → CO32- + H2O CO2 + OH- → HCO3- nCO2 = nCO32- + nHCO3- (1) nOH- = 2nCO32- + nHCO3- (2) (2) – (1) => nCO32- = nOH- - nCO2 2x(1) - (2)=> nHCO3- = 2nCO2 – nOH- + Nếu (*) ≥ 2 => tạo muối CO32- Lời giải chi tiết: - Khi cho CaCO3 phản ứng với HCl dư: nCO2 = nCaCO3 = 10/100 = 0,1 mol (BTNT "C") - Hấp thụ 0,1 mol CO2 vào 0,15 mol NaOH: Ta thấy: 1 < nOH-/nCO2 = 0,15/0,1 = 1,5 < 2 => Tạo Na2CO3 và NaHCO3 Giả sử: nNa2CO3 = x và nNaHCO3 = y (mol) BTNT "Na": nNaOH = 2x + y = 0,15 (1) BTNT "C": nCO2 = x + y = 0,1 (2) Giải hệ (1) và (2) được x = y = 0,05 => mmuối = 0,05.106 + 0,05.84 = 9,5 gam Đáp án C Câu hỏi 8 : Cho 20 gam CaCO3 tác dụng với axit HCl dư rồi dẫn sản phẩm khí đi qua 120 gam dung dịch NaOH 10% cho phản ứng xảy ra hoàn toàn được dung dịch B. Khối lượng muối có trong dung dịch B là
Đáp án: A Phương pháp giải: Bài toán hấp thụ CO2 vào dung dịch kiềm: (*) = nOH-/nCO2 + Nếu (*) ≤ 1 thì chỉ tạo muối HCO3- CO2 + OH- → HCO3- + Nếu 1 < (*) < 2 => Tạo HCO3- và CO32- CO2 + 2OH- → CO32- + H2O CO2 + OH- → HCO3- nCO2 = nCO32- + nHCO3- (1) nOH- = 2nCO32- + nHCO3- (2) (2) – (1) => nCO32- = nOH- - nCO2 2x(1) - (2)=> nHCO3- = 2nCO2 – nOH- + Nếu (*) ≥ 2 => tạo muối CO32- Lời giải chi tiết: - Khi cho CaCO3 phản ứng với HCl dư: nCO2 = nCaCO3 = 20/100 = 0,2 mol (BTNT "C") - Hấp thụ 0,2 mol CO2 vào 0,3 mol NaOH: Ta thấy: 1 < nOH-/nCO2 = 0,3/ 0,2 = 1,5 < 2 => Tạo Na2CO3 và NaHCO3 Giả sử: nNa2CO3 = x và nNaHCO3 = y (mol) BTNT "Na": nNaOH = 2x + y = 0,3 (1) BTNT "C": nCO2 = x + y = 0,2 (2) Giải hệ (1) và (2) được x = y = 0,1 => m muối = 0,1.106 + 0,1.84 = 19 gam Đáp án A Câu hỏi 9 : Cho từ từ 100 ml dung dịch hỗn hợp gồm Na2CO3 0,2M và KHCO3 0,1M vào 100 ml dung dịch HCl 0,2M , khuấy đều phản ứng hoàn toàn thu được V ml khí CO2 (dktc). Giá trị của V là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Vì Cho từ từ muối vào axit lúc đầu axit rất dư nên các chất phản ứng theo tỷ lệ mol nNa2CO3 : nNaHCO3 = 0,2 : 0,1 = 2 : 1 = 2x : x CO32- + 2H+ → CO2 + H2O HCO3- + H+ →CO2 + H2O => nHCl = 4x + x = 0,02 => x = 0,004 mol => nCO2 = 2x + x = 0,012 mol => V = 0,2688 lit = 268,8 ml Đáp án B Câu hỏi 10 : Nung nóng 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khối lượng không đồi còn lại 69 gam chất rắn. Thành phần % khối lượng mỗi chất trong hỗn hợp đầu là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: 2NaHCO3 H2O + Na2CO3 + CO2 2a a a m chất rắn giảm = mCO2 + mH2O = 100 – 69 = 31g = 44a + 18a => a = 0,5mol => %NaHCO3 = [(0,5 . 2 . 84) : 100] . 100% = 84% Đáp án A Câu hỏi 11 : Cho từ từ 150 ml dung dịch Na2CO3 1M vào 100 ml dung dịch H2SO4 1M. Sau phản ứng thu được dung dịch X. Cho BaCl2 dư vào X thu được m gam kết tủa. Giá trị của m là:
Đáp án: D Phương pháp giải: Phương pháp: Na2CO3: 0,15 (mol) H2SO4: 0,1 (mol)
CO32- + 2H+ → CO2 + H2O So sánh số mol. Tính theo chất hết => Thành phần dung dịch X Cho X+ dung dịch BaCl2 dư => mkết tủa Lời giải chi tiết:
Hướng dẫn giải: Na2CO3: 0,15 (mol) H2SO4: 0,1 (mol)
CO32- + 2H+ → CO2 + H2O Ban đầu: 0,15 0,2 (CO32- dư) Phản ứng: 0,1 0,2 0,1 Sau: 0,05 0 0,1 Dung dịch X chứa: CO32- 0,05 (mol) và SO42- 0,1 (mol). Ba2+ + CO32- -> BaCO3 0,05 0,05 Ba2+ + SO42- -> BaSO4 0,1 0,1 => m = mBaCO3 + mBaSO4 =0,05.197 + 0,1.233 = 33,15 (gam) Đáp án D Câu hỏi 12 : Cho 18,4 gam muối cacbonat của kim loại hóa trị II vào dung dịch HCl vừa đủ, sau phản ứng thu được 4,48 lít khí ở đktc. Cô cạn dung dịch sau phản ứng thu được lượng muối khan là
Đáp án: A Phương pháp giải: Phương pháp: MCO3 + 2HCl -> MCl2 + CO2 +H2O 0,2 0,4 0,2 0,2 Theo ĐLBTKL mmuối cacbonat + mHCl = mmuối clorua + mCO2 + mH2O => mkhan Lời giải chi tiết:
Hướng dẫn giải: MCO3 + 2HCl -> MCl2 + CO2 + H2O 0,2 0,4 0,2 0,2 Theo ĐLBTKL mmuối cacbonat + mHCl = mmuối clorua + mCO2 + mH2O => mkhan = 18,4+ 0,4.36,5 - 44,0,2 - 18.0,2 = 20,6 gam Đáp án A Câu hỏi 13 : Cho m gam hỗn hợp gồm hai muối KHCO3 và K 2CO3 tác dụng với BaCl2 dư thì tạo ra 19,7 gam kết tủa. Mặt khác, nếu cho hỗn hợp này tác dụng với Ba(OH)2 dư thu được 7,88 gam kết tủa. Giá trị của m
Đáp án: B Phương pháp giải: Phương pháp: K2CO3 + BaCl2 -> BaCO3 + 2KCl 0,01 0,01 2KHCO3 + BaCl2 ->Không phản ứng
2KHCO3 + Ba(OH)2 ->BaCO3 + K2CO3 + H2O x x/2 x/2 K2CO3 + Ba(OH)2 ->BaCO3 + 2KOH
mkết tủa = x+0,01 = > x => m Lời giải chi tiết:
Hướng dẫn giải: K2CO3 + BaCl2 -> BaCO3 + 2KCl 0,01 0,01 2KHCO3 + BaCl2 ->Không phản ứng
2KHCO3 + Ba(OH)2 -> BaCO3 + K2CO3 + H2O x x/2 x/2 K2CO3 + Ba(OH)2 -> BaCO3 + 2KOH
mkết tủa = x+0,01 = 7,88:197=0,04 mol = > x= 0,03 mol => m= 0,01.138+ 0,03.100=4,38gam Đáp án B Câu hỏi 14 : Nung 47,3 gam hỗn hợp X gồm Na2CO3 và NaHCO3 cho đến khi khối lượng hỗn hợp không đổi được 31,8 gam chất rắn. Thành phần % khối lượng Na2CO3 trong X
Đáp án: C Phương pháp giải: Phương pháp: Na2CO3 x mol NaHCO3 y mol 2NaHCO3 -> Na2CO3 + H2O + CO2 y y/2 y/2 Lập hệ => x,y => % mNa2CO3 Lời giải chi tiết:
Hướng dẫn giải: Na2CO3 x mol NaHCO3 y mol 2NaHCO3 -> Na2CO3 + H2O + CO2 y y/2 y/2 Đáp án C Câu hỏi 15 : Cho 18,4g hỗn hợp gồm 2 muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II tác dụng với dung dịch H2SO4 loãng dư, thu được 25,6g kết tủa. Hai kim loại là
Đáp án: C Phương pháp giải: Phương pháp: MCO3 + H2SO4→ MSO4 + CO2 +H2O => 2 kim loại Lời giải chi tiết:
Hướng dẫn giải: MCO3 + H2SO4→ MSO4 + CO2 +H2O => 2 kim loại là Mg, Ca Đáp án C Câu hỏi 16 : Nhiệt phân hoàn toàn m gam hỗn hợp gồm K2CO3 và NaHCO3 thu được 2,24 lít khí CO2(đktc). Mặt khác, nếu cho m gam hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc). Giá trị của m là
Đáp án: B Phương pháp giải: Phương pháp: Lập hệ PT, tìm x,y => m= mK2CO3+mNaHCO3 Lời giải chi tiết:
Hướng dẫn giải: => m = mK2CO3+mNaHCO3 = 138.0,2 + 84.0,2 = 44,4 gam Đáp án B Câu hỏi 17 : Nhỏ rất từ từ đến hết 200ml dung dịch X chứa đồng thời H2SO4 aM và HCl 0,15M vào 100ml dung dịch chứa đồng thời NaOH 0,5M và Na2CO3 0,4M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,448 lít khí (đktc). Giá trị của a là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Thứ tự phản ứng : H+ + OH- -> H2O H+ + CO32- -> HCO3- H+ + HCO3- -> H2O + CO2 => nH+ = 2nH2SO4 + nHCl = nOH + nCO3 + nCO2 => 0,2.(2a + 0,15) = 0,05 + 0,04 + 0,02 => a = 0,2M Đáp án D Câu hỏi 18 : Cho 200 ml dung dịch HCl từ từ vào 200 ml dung dịch Na2CO3 thấy thoát ra 2,24 lít CO2 (đktc). Thêm nước vôi trong dư vào thấy xuất hiện 10 gam kết tủa nữa. Vậy nồng độ mol/1 của dung dịch HC1 và dung dịch Na2CO3 tương ứng là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: nCO2 = 0,1 mol n CaCO3 = 0,1 mol Bảo toàn C => nNa2CO3 = 0,2 mol => CM = 1M nHCl = nNa2CO3 + nCO2 = 0,2 + 0,1 = 0,3 mol => CM = 1,5M Đáp án C Câu hỏi 19 : Hoà tan hoàn toàn 19,2 hỗn họp gồm CaCO3 và MgCO3 trong dung dịch HCl dư thấy thoát ra V (lít) CO2 (đktc) và dung dịch sau phản ứng có chứa 21,4 gam hỗn hợp muối. Xác định V:
Đáp án: D Phương pháp giải: Lời giải chi tiết: CO32- + 2HCl → CO2 + 2Cl- + H2O 1mol 2mol 1mol 2mol \[{n_{C{O_2}}} = \frac{{{m_{clorua}}\, - \,{m_{cacbonat}}}}{{71 - 60}} = \frac{{21,4 - 19,2}}{{11}} = 0,2mol\] => V = 4,48 lít Đáp án C Câu hỏi 20 : Nhiệt phân hoàn toàn 5,25 gam một muối cacbonat kim loại hóa trị 2 thu được 2,94 gam chất rắn. Muối cacbonat của kim loại đã dùng là
Đáp án: D Phương pháp giải: \(M = \frac{{{m_{muoi}}}}{{{n_{muoi}}}}\) mCO2 = mmuối - mchất rắn => nCO2 MCO3 \(\mathop \to \limits^{{t^0}} \)MO + CO2 => M Lời giải chi tiết: \(M = \frac{{{m_{muoi}}}}{{{n_{muoi}}}}\) mCO2 = mmuối - mchất rắn=5,25-2,94= 2,31 gam =>\({n_{C{O_2}}} = \frac{{2,31}}{{44}} = 0,0525\) MCO3 \(\mathop \to \limits^{{t^0}} \) MO + CO2 0,0525 0,0525 Mmuối =5,25:0,0525= 100= M+60 => M=40 (Ca) Đáp án D Câu hỏi 21 : Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối khan thu được sau phản ứng là
Đáp án: A Phương pháp giải: mCO2= mchất rắn giảm => nCO2 = 0,15 mol nNaOH = 0,075 mol $\frac{{{n_{NaOH}}}}{{n_{C{O_2}}^{}}} = 0,5$ => tạo muối NaHCO3 và CO2 dư tính theo NaOH => mmuối Lời giải chi tiết:
Câu hỏi 22 : Dung dịch X gồm KHCO3 1M và Na2CO3 1M. Dung dịch Y gồm H2SO4 1M và HCl 1M. Nhỏ từ từ 100 ml dung dịch Y vào 200 ml dung dịch X, thu được V lít khí CO2 và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và V lần lượt là
Đáp án: C Phương pháp giải: Khi nhỏ từ từ H+ vào dd hỗn hợp CO32- và HCO3- xảy ra thứ tự phản ứng sau: H+ + CO32- → HCO3- HCO3- + H+→ CO2 + H2O => nH+ = nCO32- + nCO2 => nCO2 = ? Khi cho Ba(OH)2 phản ứng với E Bảo toàn C => nBaCO3 = nHCO3- + nCO32- - nCO2 = ? Bảo toàn S => nBaSO4 = 0,1 => m↓ = mBaCO3 + mBaSO4 = ? Lời giải chi tiết: - X gồm nKHCO3 = nNa2CO3 = 0,2 => nHCO3- = nCO32- = 0,2 - Y gồm nH2SO4 = nHCl = 0,1 => nH+ = 0,3 - Khi nhỏ Y từ từ vào X H+ + CO32- → HCO3- HCO3- + H+→ CO2 + H2O => nH+ = nCO32- + nCO2 => nCO2 = 0,1 => V = 2,24 lít - Khi cho Ba(OH)2 phản ứng với E Bảo toàn C => nBaCO3 = nHCO3- + nCO32- - nCO2 = 0,3 Bảo toàn S => nBaSO4 = nH2SO4= 0,1 => m↓ = mBaCO3 + mBaSO4 = 82,4 (g) Đáp án C Câu hỏi 23 : Hòa tan hoàn toàn m gam hỗn hợp Na2CO3; K2CO3; BaCO3 bằng dung dịch HCl dư thu được khí X và dung dịch Y. - Để hấp thụ hoàn toàn khí X cần lượng tối thiểu 150 ml dung dịch Ba(OH)2 1M - Cô cạn dung dịch Y thu được 51,15 gam muối khan. Giá trị của m là
Đáp án: C Phương pháp giải: Vì hấp thu CO2 với lượng tối thiểu => cần dùng ít Ba(OH)2 để hấp thụ hết => xảy ra tạo muối axit 2CO2 + Ba(OH)2 → Ba(HCO3)2 0,3 ← 0,15 (mol) nCl- (trong muối)= 2nCO2 = ? (mol) => mKL trong muối = mY - mCl- = ? (g) => m = mKL trong muối + mCO32- = ? Lời giải chi tiết: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O K2CO3 + 2HCl → 2KCl + CO2↑ + H2O BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O Khí X là khí CO2 - nBa(OH)2 = 0,15.1 = 0,15 (mol) Vì hấp thu CO2 với lượng tối thiểu => cần dùng ít Ba(OH)2 để hấp thụ hết => xảy ra tạo muối axit 2CO2 + Ba(OH)2 → Ba(HCO3)2 0,3 ← 0,15 (mol) - Dung dịch Y thu được gồm: NaCl, KCl, BaCl2: 51,15 (g) Từ các PTHH trên ta thấy: nCl- (trong muối)= 2nCO2 = 2.0,3 = 0,6 (mol) => mKL trong muối = mY - mCl- = 51,15 - 0,6.35,5 = 29,85 (g) => m = mKL trong muối + mCO32- = 29,85 + 0,3.60 = 47,85 (g) Đáp án C Câu hỏi 24 : Hòa tan 4g hỗn hợp gồm : ACO3 và BCO3 vào dung dịch HCl thấy thoát ra V lit khí CO2 (dktc). Dung dịch tạo thành đem cô cạn thu được 5,1g muối khan. Giá trị của V là :
Đáp án: B Phương pháp giải: Phương pháp tăng giảm khối lượng Ta thấy sự chênh lệch khối lượng muối chính là sự chênh lệch của gốc Cl- và CO32- Lời giải chi tiết: ACO3 + 2HCl → ACl2 + CO2 + H2O x → x → x BCO3 + 2HCl → BCl2 + CO2 + H2O y → y → y mmuối clorua - mmuối cacbonat = (A + 71)x + (B + 71)y – (A + 60)x – (B + 60)y => 5,1 – 4 = 11(x + y) => x + y = 0,1 mol => nCO2 = x + y = 0,1 mol => VCO2 = 0,1.22,4 = 2,24 lit Đáp án B Câu hỏi 25 : Nhỏ dung dịch Ba(OH)2 dư vào dung dịch chứa m gam hỗn hợp gồm NH4HCO3 và (NH4)2CO3, đun nóng, thu được 1,12 lít khí NH3(đktc) và 5,91 gam kết tủa.Giá trị của m là
Đáp án: A Phương pháp giải: Ba(OH)2 + NH4HCO3 → BaCO3↓ + NH3↑+ 2H2O x → x → x (mol) Ba(OH)2 + (NH4)2CO3 → BaCO3↓ + 2NH3↑+ 2H2O y → y → 2y (mol) Ta có hệ phương trình:\(\left\{ \matrix{{n_{BaC{O_3}}} = x + y = 0,03 \hfill \cr {n_{N{H_3}}} = x + 2y = 0,05 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = ?\,(mol) \hfill \cr y = ?\,(mol) \hfill \cr} \right. \to m = ?\) Lời giải chi tiết: nNH3(đktc) =1,12 :22,4 = 0,05 (mol); nBaCO3 = 5,91:197 = 0,03 (mol) Đặt số mol NH4HCO3 và (NH4)2CO3 lần lượt là x và y (mol) Ba(OH)2 + NH4HCO3 → BaCO3↓ + NH3↑+ 2H2O x → x → x (mol) Ba(OH)2 + (NH4)2CO3 → BaCO3↓ + 2NH3↑+ 2H2O y → y → 2y (mol) Ta có hệ phương trình:\(\left\{ \matrix{{n_{BaC{O_3}}} = x + y = 0,03 \hfill \cr {n_{N{H_3}}} = x + 2y = 0,05 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = 0,01\,(mol) \hfill \cr y = 0,02\,(mol) \hfill \cr} \right.\) → m = mNH4HCO3 + m(NH4)2CO3 = 0,01.79 + 0,02.96 = 2,71 (g) Đáp án A Câu hỏi 26 : Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Giá trị của V là
Đáp án: B Phương pháp giải: Đặt nNa2CO3 = x và nCaCO3 = y (mol) m hh = mNa2CO3 + mCaCO3 = 106x + 100y = 20,6 (1) BTNT “Na”: nNaCl = 2nNa2CO3 = 2x (mol) BTNT “Ca”: nCaCl2 = nCaCO3 = y (mol) m muối = mNaCl + mCaCl2 = 58,5.2x + 111y = 22,8 (2) Giải (1) (2) thu được x, y BTNT “C” => nCO2 = nNa2CO3 + nCaCO3 => V Lời giải chi tiết: Đặt nNa2CO3 = x và nCaCO3 = y (mol) m hh = mNa2CO3 + mCaCO3 = 106x + 100y = 20,6 (1) BTNT “Na”: nNaCl = 2nNa2CO3 = 2x (mol) BTNT “Ca”: nCaCl2 = nCaCO3 = y (mol) m muối = mNaCl + mCaCl2 = 58,5.2x + 111y = 22,8 (2) Giải (1) và (2) được x = 0,1 và y = 0,1 BTNT “C” => nCO2 = nNa2CO3 + nCaCO3 = 0,1 + 0,1 = 0,2 mol => V = 4,48 lít Đáp án B Câu hỏi 27 : Cho từ từ đến hết 100 ml dung dịch H2SO4 2M vào 100 ml dung dịch chứa Na2CO3 1,5M và KHCO3 2M. Sau phản ứng kết thúc thu được V lít khí (đktc). Tính giá trị của V. Phương pháp giải: Tính được nH2SO4; nNa2CO3; nKHCO3 → nH+; nCO32-; nHCO3- Khi cho từ từ H+ vào {CO32-, HCO3-} thứ tự các phản ứng là: (1) H+ + CO32- → HCO3- (2) H+ + HCO3- → H2O + CO2 Lời giải chi tiết: Ta có: nH2SO4 = 0,2 mol; nNa2CO3 = 0,15 mol; nKHCO3 = 0,2 mol → nH+ = 0,4 mol; nCO32- = 0,15 mol; nHCO3- = 0,2 mol Khi cho từ từ H+ vào {CO32-, HCO3-} thứ tự các phản ứng là: (1) H+ + CO32- → HCO3- Bđ: 0,2 0,15 0,2 mol Pư: 0,15 ← 0,15 → 0,15 mol Sau pư: 0,05 0 0,35 mol (2) H+ + HCO3- → H2O + CO2 Bđ: 0,05 0,35 mol Pư: 0,05 → 0,05 → 0,05 mol Sau pư: 0 0,3 0,05 mol → V = 0,05.22,4 = 1,12 lít Câu hỏi 28 : Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Đáp án: D Phương pháp giải: - Khi nhỏ từ từ H+ vào hỗn hợp {CO32-; HCO3-} thì các phản ứng xảy ra theo thứ tự: (1) H+ + CO32- → HCO32- (2) H+ + HCO3- → H2O + CO2 - Tính toán theo các PT ion để xác định thể tích khí CO2 thu được. Lời giải chi tiết: \({n_{{H^ + }}} = {n_{HCl}} = 0,2(mol)\) \({n_{C{O_3}^{2 - }}} = {n_{N{a_2}C{O_3}}} = 0,15(mol)\) \({n_{HC{O_3}^ - }} = {n_{NaHC{O_3}}} = 0,1(mol)\) Khi nhỏ từ từ H+ vào hỗn hợp {CO32-; HCO3-} thì các phản ứng xảy ra theo thứ tự: (1) H+ + CO32- → HCO32- 0,15 ← 0,15 → 0,15 (mol) Lúc này: \({n_{{H^ + }}} = 0,2 - 0,15 = 0,05(mol);{n_{HC{O_3}^{2 - }}} = 0,1 + 0,15 = 0,25(mol)\) (2) H+ + HCO3- → H2O + CO2 0,05 → 0,05 → 0,05 (mol) → V = 0,05.22,4 = 1,12 lít Đáp án D Câu hỏi 29 : Hỗn hợp Y gồm R2CO3 và RHCO3. Chia 44,7 gam Y thành 3 phần bằng nhau: - Phần 1: Tác dụng với dung dịch Ba(OH)2 dư thu được 35,46 gam kết tủa. - Phần 2: Tác dụng với dung dịch BaCl2 dư thu được 7,88 gam kết tủa. - Phần 3: Tác dụng với V ml dung dịch KOH 2M. Giá trị của V là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 30 : Hòa tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dung dịch HCl dư, thu được 3,36 lít khí CO2 (đktc) và dung dịch chứa m gam muối KCl. Giá trị của m là
Đáp án: C Phương pháp giải: Ta nhận thấy NaHCO3 và MgCO3 có cùng phân tử khối là 100 (g/mol) Do đó ta đặt: \(\left\{ \begin{array}{l}{n_{NaHC{O_3}}}_{ + MgC{O_3}} = a(mol)\\{n_{KHC{O_3}}} = b\,(mol)\end{array} \right.\) Lập hệ với khối lượng hh X và số mol CO2 giải ra được a và b BTNT”K” nKCl = nKHCO3 = ?. Từ đó tính được mKCl Lời giải chi tiết: nCO2 (đktc) = V/22,4 = 3,36/22,4 = 0,15 (mol) Ta nhận thấy NaHCO3 và MgCO3 có cùng phân tử khối là 100 (g/mol) Do đó ta đặt: \(\left\{ \begin{array}{l}{n_{NaHC{O_3}}}_{ + MgC{O_3}} = a(mol)\\{n_{KHC{O_3}}} = b\,(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_X}:84a + 100b = 14,52\\BTNT\,'C':a + b = 0,15\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,03\\b = 0,12\end{array} \right.\) BTNT “K”: nKCl = nKHCO3 = 0,12 (mol) ⟹ mKCl = nKCl.MKCl = 0,12. 74,5 = 8,94 (g) Đáp án C Câu hỏi 31 : (Dành cho lớp A) Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc) và dung dịch Y. Hãy: a/ Tìm V. b/ Cô cạn dd Y, Tính khối lượng muối khan trong Y. Phương pháp giải: Lời giải chi tiết: a/ nCO3 2- = 0,1.1,5 = 0,15 mol, nHCO3- = 0,1.1 = 0,1 mol, nH+ = 0,2.1 = 0,2 mol Khi nhỏ từ từ H+ vào dung dịch hỗn hợp CO32- và HCO3- thì thứ tự phản ứng là: H+ + CO32- → HCO3- 0,15dư 0,05 ← 0,15 → 0,15 (mol) H+ + HCO3- → H2O + CO2 0,05 → 0,05 → 0,05 (mol) nHCO3- sau phản ứng = 0,1 + 0,15 – 0,05 = 0,2 mol a/ VCO2 = 0,05.22,4 = 1,12 lít b/ Dung dịch thu được chứa: \(\left\{ \begin{gathered} Khi cô cạn HCO3- bị phân hủy:
\(\begin{gathered} Hỗn hợp muối sau khi cô cạn gồm: \(\left\{ \begin{gathered} m muối = 0,3.23 + 0,1.39 + 0,1.60 + 0,2.35,5 = 23,9 gam Câu hỏi 32 : X là dung dịch HCl nồng độ x (M). Y là dung dịch Na2CO3 nồng độ y(M). Nhỏ từ từ 100 ml dung dịch X vào 100 ml dung dịch Y, thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml dung dịch Y vào 100 ml dung dịch X, thu được V2 lít CO2(đktc), biết tỉ lệ V1: V2 = 3 : 5. Tỉ lệ x : y là
Đáp án: B Phương pháp giải: nHCl = 0,1x (mol) ; nNa2CO3 = 0,1y (mol) TN1: Nhỏ từ từ HCl vào dd Na2CO3 xảy ra theo phương trình: HCl + Na2CO3 → NaCl + NaHCO3 HCl + NaHCO3 → NaCl + CO2↑ + H2O TN2: Nhỏ từ từ dd Na2CO3 vào dd HCl xảy ra phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O \(\frac{{{n_{C{O_2}}}_{(T{N_1})}}}{{{n_{C{O_2}}}_{(T{N_2})}}} = \frac{{0,1x - 0,1y}}{{0,05x}} = \frac{3}{5} \Rightarrow \frac{x}{y} = ?\) Lời giải chi tiết: nHCl = 0,1x (mol) ; nNa2CO3 = 0,1y (mol) TN1: Nhỏ từ từ HCl vào dd Na2CO3 xảy ra theo phương trình: HCl + Na2CO3 → NaCl + NaHCO3 HCl + NaHCO3 → NaCl + CO2↑ + H2O => nCO2(TN1)= nHCl – nNa2CO3 => nCO2(TN1) = 0,1x – 0,1y TN2: Nhỏ từ từ dd Na2CO3 vào dd HCl xảy ra phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 0,1x → 0,05x (mol) nCO2(TN2) = 1/2nHCl = 0,05x (mol) Ta có: \(\begin{gathered} Đáp án B Câu hỏi 33 : Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là:
Đáp án: B Phương pháp giải: Phương pháp: Gọi công thức trung bình của hai muối là: M2CO3. Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa à H+ hết và dư CO32- Các phản ứng xảy ra: CO32- + 2H+ -> CO2 + H2O CO32-dư + Ba2+ -> BaCO3
Lời giải chi tiết:
Hướng dẫn giải: Gọi công thức trung bình của hai muối là: M2CO3. Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa à H+ hết và dư CO32- Các phản ứng xảy ra: CO32- + 2H+ → CO2 + H2O 0,2 0,4 CO32-dư + Ba2+ -> BaCO3 0,05 0,05 0,05
Đáp án B Câu hỏi 34 : Cho 4,2g muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100 ml dung dịch Ba(OH)2 0,46M thu được 8,274 gam kết tủa. Kim loại là
Đáp án: A Phương pháp giải: Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp có thể xảy ra * TH1: Khi Ba(OH)2 dư, tính theo lượng kết tủa * TH2: Khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan Lời giải chi tiết: Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp * TH1: khi Ba(OH)2 dư, tính theo lượng kết tủa Gọi công thức muối là MCO3 CO2 + Ba(OH)2 → BaCO3 + H2O 0,042 ← 0,042 MCO3 + 2 HCl → MCl2 + CO2 + H2O 0,042 ← 0,042 Mmuối = M + 60 = 4,2/0,042 = 100 => M = 40 (Ca) * TH2: khi Ba(OH)2 thiếu, Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan CO2 + Ba(OH)2 → BaCO3 + H2O 0,046 ← 0,046 → 0,046 nkết tủa bị hòa tan = 0,046 - 0,042 = 0,004 mol BaCO3 + CO2 + H2O → Ba(HCO3)2 0,004 → 0,004 => nCO2 = 0,004 + 0,046 = 0,05 mol MCO3 +2 HCl → MCl2 + CO2 + H2O 0,05 ← 0,05 Mmuối = M + 60 = 4,2/0,05 = 84 => M = 24 (Mg) Đáp án A Câu hỏi 35 : Hòa tan hoàn toàn hỗn hợp gồm MgO, Zn(OH)2, Al, FeCO3, Cu(OH)2, Fe trong dung dịch H2SO4 loãng dư, sau phản ứng thu được dung dịch X. Cho vào dung dịch X một lượng Ba(OH)2 dư thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được hỗn hợp chất rắn Z, sau đó dẫn luồng khí CO dư (ở nhiệt độ cao) từ từ đi qua Z đến khi phản ứng xảy ra hoàn toàn thu được chất rắn G. Trong G chứa:
Đáp án: A Phương pháp giải: Dựa vào tính chất hóa học của các chất để viết các phương trình hóa học xảy ra. Từ đó xác định được thành phần dung dịch X, kết tủa Y, chất rắn Z. Dựa vào tính chất khử oxit kim loại ở nhiệt độ cao để xác định thành phần chất rắn G. Lời giải chi tiết: Sơ đồ phản ứng: \(\left\{ \begin{array}{l}MgO\\Zn{\left( {OH} \right)_2}\\Al\\FeC{O_3}\\Cu{\left( {OH} \right)_2}\\Fe\end{array} \right.\)\(\overset{+{{H}_{2}}S{{O}_{4}}loangdu}{\mathop{\to }}\,\)\({\rm{dd}}X\left\{ \begin{array}{l}MgS{O_4}\\ZnS{O_4}\\A{l_2}{(S{O_4})_3}\\FeS{O_4}\\CuS{O_4}\\{H_2}S{O_4}\end{array} \right.\)\(\overset{+Ba{{(OH)}_{2}}du}{\mathop{\to }}\,\)\(\left\{ \begin{array}{l}Mg{(OH)_2}\\Fe{(OH)_2}\\Cu{(OH)_2}\\BaS{O_4}\end{array} \right.\)\(\overset{+{{O}_{2}},{{t}^{o}}}{\mathop{\to }}\,\)\(\left\{ \begin{array}{l}MgO\\F{e_2}{O_3}\\CuO\\BaS{O_4}\end{array} \right.\)\(\overset{+CO,{{t}^{o}}}{\mathop{\to }}\,\)\(\left\{ \begin{array}{l}MgO\\Fe\\Cu\\BaS{O_4}\end{array} \right.\) Vậy chất rắn G gồm MgO, Fe, Cu và BaSO4. Lưu ý Zn(OH)2 và Al(OH)3 tan trong dung dịch kiềm dư. Đáp án A Câu hỏi 36 : : Cho 4 lọ dung dịch riêng biệt X, Y, Z, T chứa các chất khác nhau trong số 4 chất: (NH4)2CO3, NaHCO3, NaNO3, NH4NO3. Thực hiện nhận biết 4 dung dịch trên bằng dung dịch Ba(OH)2 thu được kết quả sau
Nhận xét nào sau đây là đúng?
Đáp án: C Phương pháp giải: Lời giải chi tiết: PTHH khi cho 4 chất tác dụng với dung dịch Ba(OH)2 là: \(\begin{gathered} NaNO3 không phản ứng với dung dịch Ba(OH)2. Z là NaNO3. Đáp án C Câu hỏi 37 : Cho các chất: AgNO3; Cu(NO3)2, MgCO3, Ba(HCO3)2, NH4HNO3, NH4NO3, và Fe(NO3)2. Nếu nung các chất trên đến khối lượng không đổi trong các bình kín không có không khí, rồi cho nước vào bình, số bình có thể tạo lại chất ban đầu sau các thí nghiệm là
Đáp án: C Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Vậy có 5 chất là: AgNO3, Cu(NO3)2, CaCO3, Ba(HCO3)2, NH4HCO3 Đáp án C Câu hỏi 38 : Có 4 lọ dung dịch riêng biệt X, Y, Z, T chứa các chất khác nhau trong 4 chất sau: (NH4)2CO3, KHCO3, NaNO3, NH4NO3. Bằng cách dùng dung dịch Ca(OH)2 cho lần lượt vào từng dung dịch, thu được kết quả: 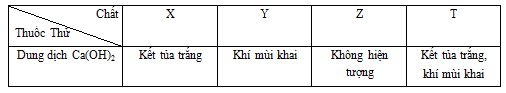
Nhận xét nào sau đây đúng:
Đáp án: B Phương pháp giải: Tính chất hóa học của các chất vô cơ Lời giải chi tiết: X + Ca(OH)2 tạo kết tủa và không tạo khí => X là KHCO3 Ca(OH)2 + 2KHCO3 → CaCO3 + K2CO3 + 2H2O Y + Ca(OH)2 chỉ tạo khí => Y là NH4NO3 Ca(OH)2 + 2NH4NO3 → Ca(NO3)2 + 2NH3 + 2H2O Z + Ca(OH)2 không có hiện tượng => Z là NaNO3 T + Ca(OH)2 tạo khí và kết tủa => (NH4)2CO3 Ca(OH)2 + (NH4)2CO3 → CaCO3 + 2NH3 + 2H2O Đáp án B Câu hỏi 39 : Cho từ từ đến hết 100 ml dung dịch H2SO4 2M vào 100 ml dung dịch chứa Na2CO3 1,5M và KHCO3 2M. Sau phản ứng kết thúc thu được V lít khí (đktc). Tính giá trị của V. Phương pháp giải: Tính được nH2SO4; nNa2CO3; nKHCO3 → nH+; nCO32-; nHCO3- Khi cho từ từ H+ vào {CO32-, HCO3-} thứ tự các phản ứng là: (1) H+ + CO32- → HCO3- (2) H+ + HCO3- → H2O + CO2 Lời giải chi tiết: Ta có: nH2SO4 = 0,2 mol; nNa2CO3 = 0,15 mol; nKHCO3 = 0,2 mol → nH+ = 0,4 mol; nCO32- = 0,15 mol; nHCO3- = 0,2 mol Khi cho từ từ H+ vào {CO32-, HCO3-} thứ tự các phản ứng là: (1) H+ + CO32- → HCO3- Bđ: 0,2 0,15 0,2 mol Pư: 0,15 ← 0,15 → 0,15 mol Sau pư: 0,05 0 0,35 mol (2) H+ + HCO3- → H2O + CO2 Bđ: 0,05 0,35 mol Pư: 0,05 → 0,05 → 0,05 mol Sau pư: 0 0,3 0,05 mol → V = 0,05.22,4 = 1,12 lít Câu hỏi 40 : Hãy xác định các sản phẩm thu được khi dẫn 4,48 lít (đktc) khí CO2 vào 427,5 gam dung dịch Ba(OH)2 6 %. Viết phương trình hóa học của các phản ứng đã xảy ra. Phương pháp giải: Xét tỷ lệ \(T = \frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}}\) + Nếu T < 1 → tạo thành muối \(HCO_3^ - \) và CO2 dư + Nếu T = 1 → tạo thành muối \(HCO_3^ - \) + Nếu 1 < T < 2 → tạo thành 2 muối \(HCO_3^ - \)và \(CO_3^{2 - }\) + Nếu T = 2 → tạo thành muối \(CO_3^{2 - }\) + Nếu T > 2 → tạo thành muối \(CO_3^{2 - }\)và OH- dư Lời giải chi tiết: \({n_{C{O_2}}} = \frac{{4,48}}{{22,4}} = 0,2\,\,mol\) \({m_{Ba{{(OH)}_2}}} = \frac{{427,5.6\% }}{{100\% }} = 25,65\,\,gam \to {n_{Ba{{(OH)}_2}}} = \frac{{25,65}}{{171}} = 0,15\,\,mol\) \( \to {n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} = 2.0,15 = 0,3\,\,mol\) Vì \(1 < \frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \frac{{0,3}}{{0,2}} = 1,5 < 2 \to \)phản ứng sinh ra 2 muối PTHH: \(2C{O_2} + Ba{(OH)_2} \to Ba{(HC{O_3})_2}\) \(C{O_2} + Ba{(OH)_2} \to BaC{{\rm{O}}_3} + {H_2}O\)
|