30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)Làm bàiCâu hỏi 1 : Để tinh chế ancol etylic (rượu etylic) C2H5OH có nhiệt độ sôi ts = 78,4OC từ hỗn hợp rượu và nước. Ta có thể sử dụng phương pháp:
Đáp án: B Phương pháp giải: Phương pháp chưng cất dùng để tách hỗn hợp gồm có các chất có nhiệt độ sôi khác nhau. Lời giải chi tiết: Để tách ancol etylic từ hỗn hợp rượu và nước ta có thể sử dụng phương pháp chưng cất. Đáp án B Câu hỏi 2 : Phương pháp dùng để tinh chế các chất có nhiệt độ sôi khác nhau (đủ lớn) là:
Đáp án: A Phương pháp giải: Dựa vào các phương pháp tinh chế các chất hữu cơ. Lời giải chi tiết: Phương pháp chưng cất được dùng để tinh chế các chất có nhiệt độ sôi khác nhau (đủ lớn). Đáp án A Câu hỏi 3 : Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 4 : Các chất hữu cơ có cấu tạo và tính chất tương tự nhau nhưng về thành phần phân tử khác nhau một hay nhiều nhóm -CH2- được gọi là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 5 : Cho các chất : C6H5OH (X) ; C6H5CH2OH (Y) ; HOC6H4OH (Z) ; C6H5CH2CH2OH (T). Hãy cho biết những chất nào thuộc cùng dãy đồng đẳng
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 6 : Phát biểu nào sau được dùng để định nghĩa công thức đơn giản nhất của hợp chất hữu cơ?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 7 : Cho các chất sau: (1): CH2Cl2 – CH2Cl2. (2): CH3Cl – CHCl3. (3): CCl2H2 – CH2Cl2. (4): CCl3H – CH2Cl2. Số chất có cùng CTPT:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 8 : Cho thí nghiệm sau : Phát biểu nào sau đây đúng :
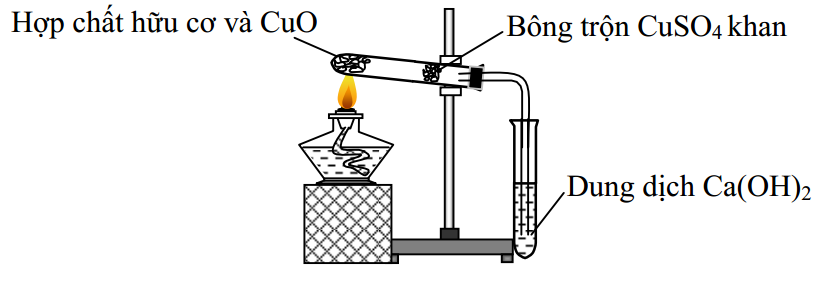
Đáp án: D Phương pháp giải: Lời giải chi tiết: Tác dụng của CuSO4 là để xác định phản ứng xảy ra chưa (H2O làm CuSO4 -> CuSO4.5H2O màu xanh lam) và ngăn H2O ra ngoài, chỉ cho CO2 thoát ra. Thí nghiệm trên để xác định Cacbon trong hợp chất hữu cơ. Đáp án D Câu hỏi 9 : Tỉ khối hơi của hợp chất hữu cơ A đối với hiđro bằng 23. Vậy khối lượng phân tử chất A là:
Đáp án: A Phương pháp giải: Dựa vào công thức tính tỉ khối để tìm khối lượng phân tử của chất A. Lời giải chi tiết: Tỉ khối hơi của hợp chất hữu cơ A đối với hiđro bằng 23. → dA/H2 = 23 → MA = 23.2 = 46 Đáp án A Câu hỏi 10 : Quá trình nào sau đây thuộc phương pháp kết tinh?
Đáp án: B Phương pháp giải: Lời giải chi tiết: - Ngâm rượu thuốc, giã lá chàm lấy nước để nhuộm vải: phương pháp chiết - Làm đường mía từ nước mía: phương pháp kết tinh - Nấu rượu: phương pháp chưng cất Đáp án B Câu hỏi 11 : Cho các phát biểu sau: 1) Trong các hợp chất hữu cơ chủ yếu là liên kết cộng hóa trị 2) Hợp chất hữu cơ thường có nhiệt độ sôi, nhiệt độ nóng chảy cao và tan nhiều trong nước 3) Các hợp chất hữu cơ thường kém bền với nhiệt và dễ cháy 4) Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau trong cùng một điều kiện. Các phát biểu đúng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: 2) Sai: Hợp chất hữu cơ thường có nhiệt độ sôi, nhiệt độ nóng chảy thấp và không tan trong nước Đáp án D Câu hỏi 12 : Hợp chất hữu cơ A có CTĐGN là CH2O. Biết phân tử khối của hợp chất bằng 180 g/ mol.Công thức phân tử của A là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B (CH2O)n = 180 => 30n = 180 => n = 6 => C6H12O6 Câu hỏi 13 : Đốt cháy hoàn toàn 0,9g A chứa C,H, O thu được 0,672 lít CO2( đktc) và 0,54g H2O. Tìm CTPT của A biết tỉ khối hơi của A so với O2 bằng 2,8125.
Đáp án: B Phương pháp giải: Tìm mol C, H, O có trong A Tìm CTĐGN qua công thức : x : y : z = nC : nH : nO Có CTĐGN và phân tử khối => Tìm được CTPT Lời giải chi tiết: Đặt CTPT : CxHyOz n H2O = 0,54 : 18 = 0,03 (mol) n CO2 = 0,672 : 22,4 = 0,03 (mol) n O = (0,9 – 0,03.2 – 0,03.12) : 16 = 0,03 (mol) => x : y : z = 0,03 : 0,06 : 0,03 = 1: 2 : 1 Có: (CH2O) n = 90 => n = 3 => CTPT : C3H6O3 Đáp án: B Câu hỏi 14 : Đốt cháy hoàn toàn 10,2g Y thu được 22g CO2 ; 9g H2O. dY/kk = 3,517. CTPT của Y là:
Đáp án: A Phương pháp giải: Tìm mol C, H, O có trong Y Tìm CTĐGN qua công thức : x : y : z = nC : nH : nO Có CTĐGN và phân tử khối => Tìm được CTPT Lời giải chi tiết: nCO2 =\({{22} \over {44}}\) = 0,5 mol ; nH2O =\({{9} \over {18}}\) = 0,5 mol CTPT : CxHyOz => nY = \({{{m_Y}} \over {{M_Y}}}\) dY/kk = \({{{M_Y}} \over {29}}\)=> MY = 3,517.29 = 102g => nY = 10,2 : 102 = 0,1 mol x =\({{{n_{C{O_2}}}} \over {{n_Y}}}\) =\({{0,5} \over {0,1}}\) = 5 y = \({{2{n_{{H_2}O}}} \over {{n_Y}}}\)=\({{2.0,5} \over {0,1}}\) = 10 MY = 5.12 + 10 + 16z = 102 => z = 2 => CTPT của Y : C5H10O2 Đáp án A Câu hỏi 15 : Đốt cháy hoàn toàn một hợp chất hữu cơ đơn chức X thu được sản phẩm cháy chỉ gồm CO2 và H2O với tỉ lệ khối lượng tương ứng là 44:27. Công thức phân tử của X là:
Đáp án: B Phương pháp giải: Phương pháp: Lập tỉ lệ CO2 và H2O từ đó tìm ra tỉ lệ C và H Lời giải chi tiết: Hướng dẫn giải: Gọi CTPT: Cx Hy O n CO2 = x (mol) => m CO2 = 44x ( g) n H2O = 0,5y (mol) => m H2O = 9y ( g) Ta có:\({{44x} \over {9y}}\, = \,{{44} \over {27}}\, = > \,{x \over y} = {1 \over 3}\) CTĐGN: (CH3)n O. Từ đáp án chọn n= 2 => C2H6O Đáp án: B Câu hỏi 16 : Bộ dụng cụ chiết dùng để tách hai chất lỏng X, Y được mô tả như hình vẽ:
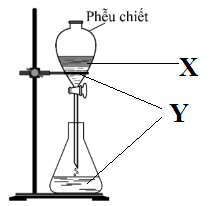
Hai chất X, Y tương ứng là
Đáp án: B Phương pháp giải: Phễu chiết dùng để tách 2 chất lỏng không tan vào nhau. Lời giải chi tiết: Phễu chiết dùng để tách 2 chất lỏng không tan vào nhau => X và Y là 2 chất lỏng không tan (1) Ta thấy X nổi bên trên Y => X phải là chất lỏng nhẹ hơn Y (2) Từ lập luận (1) và (2) => X, Y tương ứng là benzen và nước Đáp án B Câu hỏi 17 : Đặc điểm chung của các phần tử hợp chất hữu cơ là: 1. Thành phần nguyên tố phải có C và H 2. Có thể chứa nguyên tố khác như Cl, N, P, O 3. Liên kết hóa học chủ yếu là cộng hóa trị 4. Liên kết hóa học chủ yếu là ion 5. Dễ bay hơi, khó cháy 6. Phản ứng hóa học xảy ra nhanh Nhóm các ý đúng là:
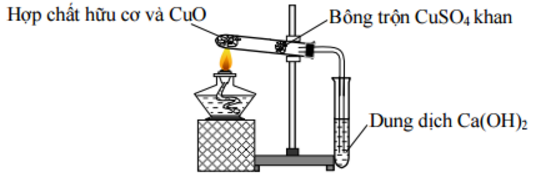
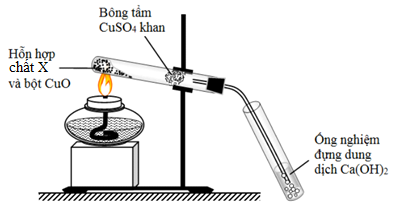
Đáp án: C Phương pháp giải: Lý thuyết về đặc điểm các hợp chất hữu cơ Lời giải chi tiết: 1. Thành phần nguyên tố phải có C và H => Sai vì có hợp chất là hợp chất hữu cơ nhưng không chứa H. VD: CCl4 2. Có thể chứa nguyên tố khác như Cl, N, P, O => Đúng 3. Liên kết hóa học chủ yếu là cộng hóa trị => Đúng 4. Liên kết hóa học chủ yếu là ion => Sai 5. Dễ bay hơi, khó cháy => Sai 6. Phản ứng hóa học xảy ra nhanh => Sai. Phản ứng hóa học xảy ra chậm, không theo hướng nhất định => Có 2 ý đúng là 2 và 3 Đáp án C Câu hỏi 18 : Để xác định các nguyên tố trong hợp chất hữu cơ trong phân tích định tính, người ta thực hiện một thí nghiệm được mô tả như hình vẽ bên.
Phát biểu nào sau đây đúng?
Đáp án: B Phương pháp giải: Dựa vào kĩ năng thực hành và quan sát hiện tượng Lời giải chi tiết: A. Sai, vì CuSO4 khan có màu trắng B. đúng, vì CuSO4 khan khi hấp thụ nước sẽ chuyển sang dạng CuSO4.5H2O (màu xanh) từ đó xác định được hợp chất hữu cơ ban đầu có chứa hidro. C. Sai, ống nghiệm chứa dung dịch Ca(OH)2 xuất hiện kết tủa màu trắng chứng tỏ hợp chất hữu cơ có chứa cacbon. D. Sai, thí nghiệm trên dùng để xác định cacbon và hidro có trong hợp chất hữu cơ. Đáp án B Câu hỏi 19 : Cho hình vẽ mô tả quá trình định tính các nguyên tố C và H trong hợp chất hữu cơ. Vai trò của CuSO4 (khan) và sự biến đổi màu của nó trong thí nghiệm là
Đáp án: D Phương pháp giải: Dựa vào kĩ năng quan sát hình vẽ thí nghiệm. CuSO4 rắn khan có màu trắng còn khi ở trạng thái dd sẽ có màu xanh. Lời giải chi tiết: CuSO4 (khan) có vai trò định tính nguyên tố H. Vì CuSO4(khan) gặp H2O sẽ chuyển sang dd CuSO4.5H2O có màu xanh→ từ việc xác định có mặt H2O → suy được chất hữu cơ ban đầu có H Đáp án D Câu hỏi 20 : Đốt cháy hoàn toàn 1,605 gam hợp chất hữu cơ A thu được 4,62 gam CO2; 1,215 gam H2O và 168ml N2(đktc). Tỷ khối hơi của A so với không khí không vượt quá 4. Công thức phân tử của A là:
Đáp án: A Phương pháp giải: Tìm mol C, H, N trong A Tìm CTĐGN theo CT: : x: y : z : t = nC : nH : nO : nN Có khoản phân tử khối => CTPT Lời giải chi tiết: Đặt CTPT : CxHyOzNt nCO2 = 4,62: 44 = 0,105 (mol) → nC = nCO2 = 0,105 mol nH2O = 1,215 : 18= 0,0675 (mol) → nH = 2nH2O = 0,135 mol nN2 = 0,168 : 22,4 = 7,5. 10-3 (mol) → nN = 2nN2 = 0,015 mol mO = mA – mC – mH – mN = 1,605 – 0,105.12 – 0,135.1 – 0,015.14 = 0 (g) => hợp chất không chứa O x:y:t = 0,105 : 0,135 : 0,015 = 7 : 9 : 1 (C7H9N)n < 4.29 =116 => n < 1,08 => n = 1 => C7H9N Đáp án: A Câu hỏi 21 : Chất X có CTPT là CnH2nO2. Đốt cháy hoàn toàn X cần 1,25V lít O2 thu được V lít CO2 (Thể tích khí đo ở cùng điều kiện). Vậy công thức phân tử của X là:
Đáp án: D Phương pháp giải: CnH2nO2 + \({{3n - 2} \over 2}\) O2→ n CO2 + n H2O Tỉ lệ về thể tích chính là tỉ lệ về số mol : \({{{V_{C{O_2}}}} \over {{V_{{O_2}}}}} = {1 \over {1,25}} = {{{n_{C{O_2}}}} \over {{n_{{O_2}}}}}\) Bảo toàn nguyên tố oxy : 2 n HCHC + 2 n O2 = 2 n CO2 + n H2O Lời giải chi tiết: Theo phương trình phản ứng n CO2 = n H2O = a => n O2 = 1.25 a 2n X+ 2 n O2 = 2 n CO2 + n H2O => n X = 0,25 a =>Số C = a : 0,25 a = 4 => X là C4H8O2 Đáp án D Câu hỏi 22 : Paracetamol (X) là thành phần chính của thuốc hạ sốt và giảm đau. Oxi hóa hoàn toàn 5,285 gam X bằng CuO dư, dẫn sản phẩm cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng Ba(OH)2 dư. Sau khi kết thúc thí nghiệm thấy khối lượng bình 1 tăng 2,835 gam, ở bình 2 tạo thành 55,16 gam kết tủa và còn 0,392 lít khí (đktc) thoát ra. CTPT (trùng với công thức đơn giản nhất ) của paracetamol là:
Đáp án: D Phương pháp giải: HCHC + [O] → CO2 + H2O + N2 +) Bình 1 đựng H2SO4 đặc hấp thụ nước +) Bình 2 đựng Ba(OH)2 dư hấp thụ CO2 Lời giải chi tiết: *Bình 1: m bình 1 tăng = mH2O = 2,835 gam => nH2O = 0,1575 mol => nH = 0,315 mol *Bình 2: nBaCO3 = nCO2 = 55,16 : 197 = 0,28 mol => nC = 0,28 mol *Khí thoát ra là N2: nN2 = 0,392 : 22,4 = 0,0175 mol => nN = 0,035 mol mO = mX – mC – mH – mN = 5,285 – 0,28.12 – 0,315.1 – 0,035.14 = 1,12 gam => nO = 0,07 mol Ta có: C : H : O : N = 0,28 : 0,315 : 0,07 : 0,035 = 8 : 9 : 2 : 1 Vậy công thức phân tử (trùng với CTĐGN) là C8H9O2N Đáp án D Câu hỏi 23 : Đốt cháy hoàn toàn a mol một chất hữu cơ X thu được 3,36 lít CO2 ở đktc và 4,5 gam H2O. Giá trị của a là
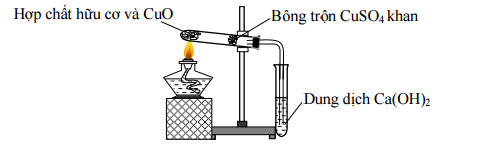
Đáp án: B Phương pháp giải: Ta thấy nH2O > nCO2 => Hợp chất hữu cơ có dạng CnH2n+2Oz Lời giải chi tiết: nCO2 = 3,36 : 22,4 = 0,15 mol nH2O = 4,5 : 18 = 0,25 mol Ta thấy nH2O > nCO2 => Hợp chất hữu cơ có dạng CnH2n+2Oz Khi đó: nX = nH2O – nCO2 = 0,25 – 0,15 = 0,1 mol Đáp án B Câu hỏi 24 : Hình vẽ mô tả thí nghiệm phân tích nguyên tố trong chất hữu cơ X (CxHyOzNt).
Cho các nhận xét sau: (a) Thí nghiệm trên nhằm mục đích xác định tính C, H, N trong hợp chất hữu cơ. (b) Bông tẩm CuSO4 khan nhằm phát hiện sự có mặt của hơi nước trong sản phẩm cháy. (c) ống nghiệm được lắp hơi chúi xuống để tránh quá trình ngưng tụ hơi nước chảy ngược trở lại. (d) ống nghiệm đựng nước vôi trong để hấp thụ khí CO2 và khí N2. (e) CuO được sử dụng để oxi hóa các chất hữu cơ. Số phát biểu đúng là
Đáp án: B Phương pháp giải: Dựa vào kiến thức dấu hiệu nhận biết C, H, N. Lời giải chi tiết: (a) sai, thí nghiệm trên nhằm mục đích xác định định tính C, H trong hợp chất hữu cơ. (b) đúng (c) đúng (d) sai, chỉ hấp thụ CO2 không hấp thụ khí N2 (e) đúng ⟹ Có 3 phát biểu đúng Đáp án B Câu hỏi 25 : Đốt cháy hoàn toàn 1,47 gam chất hữu cơ X (chỉ chứa C, H, O) bằng 1,0976 lít khí O2 (ở đktc) lượng dùng vừa đủ thì sau thí nghiệm thu được H2O; 2,156 gam CO2. Tìm CTPT của X, biết tỉ khối hơi của X so với không khí nằm trong khoảng 3 < dX/kk < 4.
Đáp án: B Phương pháp giải: +) Bảo toàn khối lượng: \({m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}}\) +) Bảo toàn nguyên tố C: \({n_C} = {n_{C{O_2}}}\) +) Bảo toàn nguyên tố H: \({n_H} = 2{n_{{H_2}O}}\) ⟹ nO(hchc) +) nC : nH : nO ⟹ CTĐGN của X +) Xét khoảng giá trị của n ⟹ CTPT của X Lời giải chi tiết: Ta có: \({n_{{O_2}}} = \frac{{1,0976}}{{22,4}} = 0,049\left( {mol} \right)\) và \({n_{C{O_2}}} = \frac{{2,156}}{{44}} = 0,049\left( {mol} \right)\) Bảo toàn khối lượng cho phản ứng cháy: \(\begin{array}{l}{m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}}\\ \Leftrightarrow 1,47 + 32.0,049 = 2,156 + 18{n_{{H_2}O}}\\ \Leftrightarrow {n_{{H_2}O}} = 0,049\end{array}\) Bảo toàn nguyên tố C: \({n_C} = {n_{C{O_2}}} = 0,049\left( {mol} \right)\) Bảo toàn nguyên tố H: \({n_H} = 2{n_{{H_2}O}} = 0,098\left( {mol} \right)\) Khối lượng của O: \({m_O} = {m_{hchc}} - {m_C} - {m_H} = 1,47 - 0,049.12 - 0,098 = 0,784\left( {mol} \right)\) \( \to {n_O} = \frac{{0,784}}{{16}} = 0,049\left( {mol} \right)\) Ta có: \({n_C}:{n_H}:{n_O} = 0,049:0,098:0,049 = 1:2:1\) ⟹ CTĐGN của X là CH2O Đặt công thức phân tử của X là (CH2O)n Theo đề bài: \(3 < {d_{X/kk}} < 4 \to 3 < \frac{{{M_X}}}{{29}} < 4 \to 3 < \frac{{30n}}{{29}} < 4 \to 2,9 < n < 3,87 \to n = 3\) Vậy công thức phân tử của X là C3H6O3. Chọn B. Câu hỏi 26 : Vitamin C là một loại vitamin tan trong nước, có nhiều trong trái cây họ cam quýt, kiwi, ớt chuông, đu đủ chín, súp lơ, … Loại vitamin này góp phần quan trọng trong việc tăng cường sức đề kháng cho cơ thể nên hiện nay được khuyên dùng trong mùa dịch viêm phổi cấp do virus corona chủng mới (nCoV-2019) gây ra. Tỉ lệ khối lượng của các nguyên tố trong vitamin C là mC : mH : mO = 9 : 1 : 12. Biết phân tử vitamin này được tạo nên từ 20 nguyên tử các nguyên tố. Công thức phân tử của Vitamin C là
Đáp án: A Phương pháp giải: - Dựa vào tỉ lệ khối lượng ta giả sử khối lượng của C, H, O. - Tính số mol mỗi nguyên tố. - Lập tỉ lệ số mol các nguyên tố. - Dựa vào dữ kiện tổng số nguyên tử để suy ra CTPT của Vitamin C. Lời giải chi tiết: Theo đề bài mC : mH : mO = 9 : 1 : 12 nên ta giả sử khối lượng của C, H, O lần lượt là 9 gam, 1 gam, 12 gam. \({n_C} = \frac{9}{{12}} = 0,75\left( {mol} \right)\) \({n_H} = \frac{1}{1} = 1\left( {mol} \right)\) \({n_O} = \frac{{12}}{{16}} = 0,75\left( {mol} \right)\) Suy ra: \({n_C}:{n_H}:{n_O} = 0,75:1:0,75 = 3:4:3\) Đặt công thức phân tử của Vitamin C là (C3H4O3)n Do phân tử vitamin này được tạo nên từ 20 nguyên tử các nguyên tố ⟹ (3 + 4 + 3).n = 20 ⟹ n = 2 Vậy CTPT của Vitamin C là C6H8O6. Chọn A. Câu hỏi 27 : Hỗn hợp X gồm 3 chất: CH2O2, C2H4O2, C4H8O2. Đốt cháy hoàn toàn một lượng hỗn hợp X, thu được 0,8 mol H2O và m gam CO2. Giá trị của m là
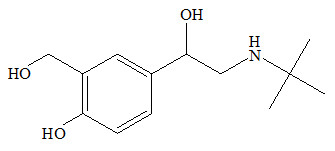
Đáp án: A Phương pháp giải: Các chất trong hỗn hợp đều có dạng CnH2nO2 ⟹ Mối quan hệ số mol CO2 và H2O Lời giải chi tiết: Các chất trong hỗn hợp đều có dạng CnH2nO2 nên khi đốt ta có: nH2O = nCO2 = 0,8 mol ⟹ m = 0,8.44 = 35,2 gam Đáp án A Câu hỏi 28 : Nhằm đạt lợi ích kinh tế, một số trang trại chăn nuôi heo đã dùng một số hóa chất cấm để trộn vào thức ăn với liều lượng cao, trong đó có Salbutamol. Salbutamol giúp heo lớn nhanh, tỉ lệ nạc cao, màu sắc thịt đỏ hơn. Nếu con người ăn phải thịt heo được nuôi có sử dụng Salbutanol thì sẽ gây ra nhược cơ, giảm vận động của cơ, khớp khiến có thể phát triển không bình thường. Salbutamol có công thức cấu tạo thu gọn nhất như sau:
Salbutalamol có công thức phân tử là
Đáp án: D Phương pháp giải: Áp dụng công thức tính độ bất bão hòa với hợp chất CxHyOzNt ta có: \(k = {{2x + 2 - y + t} \over 2}\) Lời giải chi tiết: Từ hình vẽ ta thấy có 12 Cacbon; Có 1 nguyên tố N; có 3 nguyên tố O Có 1 vòng + 3 liên kết pi => độ bội k = 4 Đặt cộng thức là: C13HyO3N Áp dụng công thức tính độ bất bão hòa với hợp chất CxHyOzNt ta có: \(k = {{2x + 2 - y + t} \over 2} \Rightarrow 4 = {{2.13 + 2 - y + 1} \over 2} \Rightarrow y = 21\) Vậy công thức của salbutalamol là: C13H21O3N Đáp án D Câu hỏi 29 : Từ ơgenol (trong tinh dầu hương nhu) điều chế được metylơgenol (M = 178 g/mol) là chất dẫn dụ côn trùng. Kết quả phân tích nguyên tố của metylơgenol cho thấy: %C = 74,16% ; %H = 7,86%, còn lại là oxi. Tổng số liên kết trong phân tử metylơgenol là: (Công thức tính số liên kết của hợp chất CxHyOz là: số liên kết pi = ( 2x+2 – y)/2).
Đáp án: A Phương pháp giải: Thiết lập công thức đơn giản nhất của hợp chất hữu cơ CxHyOzNt x : y : z : t = \({{\% C} \over {12}}:\,\,{{\% H} \over 1}:\,\,{{\% O} \over {16}}:\,{{\% N} \over {14}}\) Tìm được CTĐGN, có phân tử khối => Tìm được CTPT => Tìm được số liên kết pi theo công thức đã cho. Lời giải chi tiết: Gọi CTĐGN là CxHyOz %O = 100% - 74,16% - 7,86% = 17,98% x : y : z = \({{74,16} \over {12}}:{{7,86} \over 1}:{{17,98} \over {16}}\) = 6,18 : 7,86 : 1,12 = 11 : 14: 2 => CTĐGN = C11H14O2 Có: (C11H14O2 ) n = 178 => n = 1 => CTPT: C11H14O2 Số liên kết trong phân tử: k = ( 2.11+ 2 – 14)/2 = 5 Đáp án: A Câu hỏi 30 : Từ tinh dầu hồi, người ta tách được anetol- một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; % H = 8,1%, còn lại là oxi. CTPT của enatol là:
Đáp án: A Phương pháp giải: Thiết lập công thức đơn giản nhất của hợp chất hữu cơ CxHyOzNt x : y : z : t = \({{\% C} \over {12}}:\,\,{{\% H} \over 1}:\,\,{{\% O} \over {16}}:\,{{\% N} \over {14}}\) Tìm được CTĐGN, có phân tử khối của chất rồi sẽ tìm được CTPT Lời giải chi tiết: %O = 100% - 81,08% - 8,1% = 10, 82% x : y : z = \({{81,08} \over {12}}:{{8,1} \over 1}:{{10,82} \over {16}}\) = 6,76: 8,1: 0,676 = 10: 12: 1 => CTĐGN = C10H12O => (C10H12O)n = 148 => n = 1 => CTPT : C10H12O Đáp án: A
|