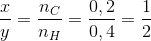30 bài tập về xác định công thức phân tử dựa vào quá trình phân tích định lượng có lời giảiLàm bàiCâu hỏi 1 : Đốt cháy hoàn toàn 4,6 gam một chất hữu cơ X, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Công thức đơn giản nhất (CTĐGN) của X là:
Đáp án: C Phương pháp giải: BTNT: nC = nCO2; nH = 2nH2O mO = mX – mC – mH Lời giải chi tiết: BTNT: nC = nCO2 = 0,2 mol; nH = 2nH2O = 2.0,3 = 0,6 mol mO = mX – mC – mH = 4,6 – 0,2.12 – 0,6.1 = 1,6 gam => nO = 0,1 mol => nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1 Công thức đơn giản nhất là C2H6O Đáp án C Câu hỏi 2 : Đốt cháy hoàn toàn 6,0 gam một chất hữu cơ X. Sau phản ứng dẫn hỗn hợp sản phẩm cháy qua lần lượt các bình: - Bình 1: đựng dung dịch H2SO4 đặc nóng. - Bình 2: đựng dung dịch nước vôi trong (Ca(OH)2) dư. Thấy khối lượng bình 1 tăng 7,2 gam. Bình 2 xuất hiện 30 gam kết tủa. Công thức đơn giản nhất của X là:
Đáp án: A Phương pháp giải: - H2SO4 hấp thụ H2O - Ca(OH)2 hấp thụ CO2 BTNT: nC = nCO2 = nCaCO3; nH = 2nH2O mO = mX – mC – mH Lời giải chi tiết: - H2SO4 hấp thụ H2O => mH2O = 7,2 gam => nH2O = 0,4 mol - Ca(OH)2 dư hấp thụ CO2 => nCO2 = nCaCO3 = 0,3 mol BTNT: nC = nCO2 = nCaCO3 = 0,3 mol; nH = 2nH2O = 0,8 mol mO = mX – mC – mH = 6 – 0,3.12 – 0,8.1 = 1,6 gam => nO = 0,1 mol => nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1 => Công thức đơn giản nhất : C3H8O Đáp án A Câu hỏi 3 : Đốt cháy hoàn toàn 6,0 gam một chất hữu cơ Y chỉ chứa C, H, O trong phẩn tử. Sau phản ứng thu được hỗn hợp sản phẩm cháy vào bình đựng nước vôi trong (Ca(OH)2) dư, thấy xuất hiện 20 gam kết tủa. Đồng thời, khối lượng bình tăng 12,4 gam so với ban đầu. Công thức đơn giản nhất (CTĐGN) của Y là:
Đáp án: B Phương pháp giải: BTNT: nCO2 = nCaCO3 ( do Ca(OH)2 dư) mbình tăng = mCO2 + mH2O => nH2O = ? BTNT: nC = nCO2 = nCaCO3; nH = 2nH2O mO = mX – mC – mH => nO Lời giải chi tiết: BTNT: nCO2 = nCaCO3 = 0,2 mol (do Ca(OH)2 dư) mbình tăng = mCO2 + mH2O => nH2O = 12,4 – 0,2.44 = 3,6 gam => nH2O = 0,2 mol BTNT: nC = nCO2 = nCaCO3 = 0,2 mol; nH = 2nH2O = 0,4 mol mO = mX – mC – mH = 6 – 0,2.12 – 0,4.1 = 3,2 gam => nO = 0,2 mol => nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2 : 1 Công thức đơn giản nhất là CH2O Đáp án B Câu hỏi 4 : Đốt cháy hoàn toàn 4,5 gam chất hữu cơ A, sau phản ứng thu được hỗn hợp sản phẩm cháy. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thì thấy xuất hiện 39,4 gam kết tủa trắng, đồng thời khối lượng dung dịch giảm 24,3 gam. Mặt khác, oxi hoàn toàn 6,75 gam A bằng CuO (to), sau phản ứng thu được 1,68 lít N2 (đktc). Biết A có công thức phân tử (CTPT) trùng với công thức đơn giản nhất (CTĐGN). Vậy CTPT của A là:
Đáp án: B Phương pháp giải: - Xét 6,75 gam: nN = 2nN2 => nN (4,5 gam) - Xét 4,5 gam: nCO2 = nBaCO3 => nC m dung dịch giảm = mBaCO3 – mCO2 – mH2O => mH2O => nH2O => nH mO = mA – mC – mH – mN => nO Lời giải chi tiết: - Xét 6,75 gam: nN = 2nN2 = 0,15 => nN = 0,1 (4,5 gam) - Xét 4,5 gam: + nCO2 = nBaCO3 = 0,2 mol => nC = 0,2 mol + m dung dịch giảm = mBaCO3 – mCO2 – mH2O => mH2O = 39,4 – 0,2.44 – 24,3 = 6,3 (g) => nH2O = 0,35 mol => nH = 0,7 mol + mO = mA – mC – mH – mN = 4,5 – 0,2.12 – 0,7.1 – 0,1.14 = 0 => A không chứa O Vậy : nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1 Công thức của A cũng là công thức đơn giản nhất là : C2H7N Đáp án B Câu hỏi 5 : Để đốt cháy hoàn toàn 4,45 gam hợp chất A cần dùng vừa hết 4,2 lít O2. Sản phẩm cháy gồm có 3,15 gam H2O và 3,92 lít hỗn hợp khí gồm CO2 và N2. Biết thể tích các khí đo ở đktc, trong phân tử của A có 1 nguyên tử nitơ (N). Công thức phân tử của A là:
Đáp án: A Phương pháp giải: Đặt ẩn là số mol của CO2 và N2 + BTKL => (1) + n(CO2 + N2) => (2) + Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 Lời giải chi tiết: nO2 = 0,1875 mol ; nH2O = 0,175 mol Đặt nCO2 = x; nN2 = y + Bảo toàn khối lượng : 44x + 28y = mA + mO2 – mH2O = 7,3g (1) + n(CO2 + N2) = 0,175 => x + y = 0,175 (2) => x = 0,15 ; y = 0,025 mol Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol => nC : nH : nO : nN = 0,15 : 0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1 Công thức phân tử của A chỉ có 1 nguyên tử N => A là C3H7O2N Đáp án A Câu hỏi 6 : Nung 4,65 gam một chất hữu cơ A trong dòng khí oxi thì thu được 13,20 gam CO2 và 3,15 gam H2O. Ở thí nghiệm khác, nung 5,58 gam chất hữu cơ với CuO thì thu được 0,67 lít khí N2 (đktc). Trong A có chứa nguyên tố:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đốt cháy A tạo CO2 và H2O => chắc chắn trong A có C và H. => nC = nCO2 = 0,3 mol ; nH = 2nH2O = 0,35 mol Xét 5,58g A phản ứng với CuO tạo nN2 = 0,03 mol => Trong 5,58g A có 0,06 mol N => Trong 4,65g A thì nN = 0,05 mol Ta có : mC + mH + mN = 4,65g => A chỉ có 3 nguyên tố là C, H , N. Đáp án B Câu hỏi 7 : Oxi hoá hoàn toàn 0,6 gam một hợp chất hữu cơ A thu được 0,672 lít CO2 (đktc) và 0,720 gam H2O. Công thức đơn giản nhất của A là:
Đáp án: B Phương pháp giải: BTNT “C”: nC = nCO2 BTNT “H”: nH = 2nH2O mO = mA – mC – mH Lời giải chi tiết: BTNT “C”: nC = nCO2 = 0,672 : 22,4 = 0,03 mol BTNT “H”: nH = 2nH2O = 2.0,72:18 = 0,08 mol mO = mA – mC – mH = 0,6 – 0,03.12 – 0,08.1 = 0,16 gam => nO = 0,16 : 16 = 0,01 mol => C : H : O = 0,03 : 0,08 : 0,01 = 3 : 8 : 1 Vậy CTĐG nhất của A là C3H8O Đáp án B Câu hỏi 8 : β-Caroten (chất hữu cơ có trong củ cà rốt) có màu da cam. Nhờ tác dụng của enzim trong ruột non, β-caroten chuyển thành vitamin A nên nó còn được gọi là tiền vitamin A. Oxi hoá hoàn toàn 0,67 gam β-caroten rồi dẫn sản phẩm cháy qua bình (1) đựng dung dịch H2SO4 đặc, sau đó qua bình (2) đựng dung dịch Ca(OH)2 dư. Kết quả thấy bình (1) tăng 0,63 gam, bình (2) có 5,00 gam kết tủa. Công thức đơn giản của -caroten là:
Đáp án: B Phương pháp giải: Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = ? => nH = ? CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = ? => nC : nH = ? => CTĐG nhất của b-caroten Lời giải chi tiết: Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = 0,63g => nH = 0,07 mol CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = 0,05 mol => nC : nH = 0,05 : 0,07 = 5 : 7 Vậy CTĐG nhất của b-caroten là C5H7 Đáp án B Câu hỏi 9 : Đốt cháy hoàn toàn 0,3 gam chất A, thu được 0,44 gam CO2, 0,18 gam H2O. Thể tích 0,3 gam A bằng thể tích của 0,16 gam khí oxi (O2) (ở cùng điều kiện nhiệt độ và áp suất). Công thức phân tử của A là:
Đáp án: C Phương pháp giải: BTNT “C”: nC = nCO2 BTNT “H”: nH = 2nH2O mO = mA – mC – mH Tính được tỉ lệ C : H : O => CTĐGN Dựa vào dữ kiện về khối lượng mol => CTPT Lời giải chi tiết: BTNT “C”: nC = nCO2 = 0,44 : 44 = 0,01 mol BTNT “H”: nH = 2nH2O = 2.0,18:18 = 0,02 mol mO = mA – mC – mH = 0,3 – 0,01.12 – 0,02.1 = 0,16 gam => nO = 0,16 : 16 = 0,01 mol => C : H : O = 0,01 : 0,02 : 0,01 = 1 : 2 : 1 => CTĐGN: CH2O *Tìm khối lượng mol: nA = nO2 = 0,16 : 32 = 0,005 mol => MA = mA : nA = 0,3 : 0,005 = 60 => 30n = 60 => n = 2 Vậy công thức phân tử của A là C2H4O2 Đáp án C Câu hỏi 10 : Đốt cháy hoàn toàn 4,6 gam một chất hữu cơ X, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Công thức đơn giản nhất (CTĐGN) của X là:
Đáp án: C Phương pháp giải: Bảo toàn nguyên tố, bảo toàn khối lượng. Lời giải chi tiết: BTNT: nC = nCO2 = 0,2 mol ; nH = 2nH2O = 0,6 mol Ta có: mX = mC + mH + mO => mO = 4,6 - 0,2.12 - 0,6 = 1,6 gam => nO = 0,1 mol => C: H : O = nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1 Vậy CTĐG nhất là C2H6O Đáp án C Câu hỏi 11 : Đốt cháy hoàn toàn 6,0 gam một chất hữu cơ X. Sau phản ứng dẫn hỗn hợp sản phẩm cháy qua lần lượt các bình: - Bình 1: đựng dung dịch H2SO4 đặc nóng. - Bình 2: đựng dung dịch nước vôi trong (Ca(OH)2) dư. Thấy khối lượng bình 1 tăng 7,2 gam. Bình 2 xuất hiện 30 gam kết tủa. Công thức đơn giản nhất của X là:
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố, bảo toàn khối lượng. Lời giải chi tiết: Đốt cháy X tạo CO2 và H2O Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol Bình 2 giữ lại CO2 => nCaCO3 = nCO2 = 0,3 mol Ta có: mO = mX - mC - mH = 6 - 0,3.12 - 0,8 = 1,6 gam => nO = 0,1 mol => nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1 Vậy CTĐG nhất của X là C3H8O Đáp án A Câu hỏi 12 : Đốt cháy hoàn toàn 6,0 gam một chất hữu cơ Y chỉ chứa C, H, O trong phân tử. Sau phản ứng thu được hỗn hợp sản phẩm cháy vào bình đựng nước vôi trong (Ca(OH)2) dư, thấy xuất hiện 20 gam kết tủa. Đồng thời, khối lượng bình tăng 12,4 gam so với ban đầu. Công thức đơn giản nhất (CTĐGN) của Y là:
Đáp án: B Phương pháp giải: Bảo toàn nguyên tố, bảo toàn khối lượng. Lời giải chi tiết: Do Ca(OH)2 dư nên ta có: nCaCO3 = nCO2 = 0,2 mol => nC = 0,2 mol Mặt khác: mbình tăng = mCO2 + mH2O => mH2O = 12,4 - 0,2.44 = 3,6 gam => nH2O = 0,2 mol => nH = 0,4 mol BTKL: mO = mX - mC - mH = 6 - 0,2.12 - 0,4 = 3,2 gam => nO = 0,2 mol => nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2 : 1 CTĐG nhất của Y là CH2O Đáp án B Câu hỏi 13 : Đốt cháy hoàn toàn 4,5 gam chất hữu cơ A, sau phản ứng thu được hỗn hợp sản phẩm cháy. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thì thấy xuất hiện 39,4 gam kết tủa trắng, đồng thời khối lượng dung dịch giảm 24,3 gam. Mặt khác, oxi hoàn toàn 6,75 gam A bằng CuO (to), sau phản ứng thu được 1,68 lít N2 (đktc). Biết A có công thức phân tử (CTPT) trùng với công thức đơn giản nhất (CTĐGN). Vậy CTPT của A là:
Đáp án: B Phương pháp giải: Bảo toàn nguyên tố. Lời giải chi tiết: nCO2 = nBaCO3 = 0,2 mol => nC = 0,2 mol mdd giảm = mBaCO3 – (nCO2 + nH2O) => nH2O = 0,35 mol => nH = 0,7 mol Xét 6,75 gam A phản ứng tạo 0,075 mol N2 => Vậy 4,5 gam A thì tạo 0,05 mol N2 => nN(A) = 2nN2 = 0,1 mol Ta có: mA = mC + mH + mO + mN => mO = 0 (Hợp chất không chứa O) => nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1 => CTĐG nhất và cũng là CTPT của A là C2H7N Đáp án B Câu hỏi 14 : Để đốt cháy hoàn toàn 4,45 gam hợp chất A cần dùng vừa hết 4,2 lít O2. Sản phẩm cháy gồm có 3,15 gam H2O và 3,92 lít hỗn hợp khí gồm CO2 và N2. Biết thể tích các khi đo ở đktc, trong phân tử của A có 1 nguyên tử nitơ (N). Công thức phân tử của A là:
Đáp án: A Phương pháp giải: Bảo toàn khối lượng, bảo toàn nguyên tố. Lời giải chi tiết: Ta có: nO2 = 0,1875 mol Bảo toàn khối lượng: mA + mO2 = mCO2 + mN2 + mH2O => mCO2 + mN2 = 7,3g Mặt khác: nCO2 + nN2 = 0,175 mol => nCO2 = 0,15; nN2 = 0,025 mol Bảo toàn O: nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol => nC : nH : nO : nN = 0,15 : 0,0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1 Vì A chỉ có 1 nguyên tử N nên A có CTPT là: C3H7O2N Đáp án A Câu hỏi 15 : Nung 4,65 gam một chất hữu cơ A trong dòng khí oxi thì thu được 13,20 gam CO2 và 3,15 gam H2O. Ở thí nghiệm khác, nung 5,58 gam chất hữu cơ với CuO thì thu được 0,67 lít khí N2 (đktc). Trong A có chứa nguyên tố:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đốt cháy A tạo CO2 và H2O => chắc chắn trong A có C và H. => nC = nCO2 = 0,3 mol ; nH = 2nH2O = 0,35 mol Xét 5,58g A phản ứng với CuO tạo nN2 = 0,03 mol => Trong 5,58g A có 0,06 mol N => Trong 4,65g A thì nN = 0,05 mol Ta có : mC + mH + mN = 4,65g => A chỉ có 3 nguyên tố là C , H , N. Đáp án B Câu hỏi 16 : Đốt cháy hoàn toàn 0,3 gam chất A, thu được 0,44 gam CO2, 0,18 gam H2O. Thể tích 0,3 gam A bằng thể tích của 0,16 gam khí oxi (O2) (ở cùng điều kiện nhiệt độ và áp suất). Công thức phân tử của A là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Xét 0,3g A : nA = nO2 = 0,005 mol => MA = 60 nCO2 = nC = 0,01 mol ; nH = 2nH2O = 0,02 mol Vậy trong 1 mol A có : số C = 0,01 : 0,005 = 2 Số H = 0,02 : 0,005 = 4 Vì A đốt cháy chỉ tạo CO2 và H2O nên A chỉ có C , H và có thể có O CTTQ của A là C2H4On => MA = 28 + 16n = 60 => n = 2 Vậy A là C2H4O2 Đáp án C Câu hỏi 17 : Đốt 0,15 mol một hợp chất hữu cơ thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Mặt khác đốt 1 thể tích hơi chất đó cần 2,5 thể tích O2. Các thể tích đo ở cùng điều kiện nhiệt độ, áp suất. CTPT của hợp chất đó là:
Đáp án: D Phương pháp giải: Gọi CTPT của X là : CxHyOz => x = nCO2/nX = VCO2 / VX => y = 2nH2O/nX = 2VH2O / VX Đốt 1 thể tích hơi chất đó cần 2,5 thể tích O2: VO2/VX = x + 0,25y – 0,5z = 2,5 => z Lời giải chi tiết: Gọi CTPT là CxHyOz x = nCO2/nX = VCO2 / VX =2 => y = 2nH2O/nX = 2VH2O / VX = 4 Đốt 1 thể tích hơi chất đó cần 2,5 thể tích O2: \({C_x}{H_y}{O_z} + (x + \frac{y}{4} - \frac{z}{2}){O_2}\xrightarrow{{{t^0}}}xC{O_2} + \frac{y}{2}{H_2}O\) VO2/VX = x + 0,25y – 0,5z = 2,5 => z = 1 => C2H4O Đáp án D Câu hỏi 18 : Đốt cháy hoàn toàn một hợp chất hữu cơ X (C, H, N) bằng lượng không khí vừa đủ (gồm 1/5 thể tích O2, còn lại là N2) được khí CO2 , H2O và N2. Cho toàn bộ sản phẩm cháy qua bình đựng dung dịch Ba(OH)2dư thấy có 39,4 gam kết tủa, khối lượng dung dịch giảm đi 24,3 gam. Khí thoát ra khỏi bình có thể tích 34,72 lít (đktc). Biết dX/O2 < 2. CTPT của X là:
Đáp án: A Phương pháp giải: Bảo toàn khối lượng, bảo toàn nguyên tố m dung dịch giảm = mBaCO3 – mCO2 – mH2O Lời giải chi tiết: Cho toàn bộ sản phẩm cháy qua bình đựng dung dịch Ba(OH)2 dư thấy có 39,4 gam kết tủa, khối lượng dung dịch giảm đi 24,3 gam => nC =nCO2 = nBaCO3 = 0,2 mol => mH2O = m¯ - (Dmgiảm +mCO2) = 39,4 – (24,3 + 0,2.44) = 6,3g => nH =2nH2O = 0,7 PTHH: CxHyNt +(x + 0,25y)O2 xCO2 + 0,5yH2O + 0,5tN2 BT nguyên tố Oxi trước và sau pứ : 2nO2 pứ = 2nCO2 + nH2O =2.0,2 + 0,35 =0,75 => nO2 pứ = 0,375 mol => VO2 pứ = 8,4 lít => VN2 trong kk = 4VO2 = 33,6 lít => VN2 sp cháy = 34,72 – 33,6 = 1,12 lít => nN2 =0,05 mol => nN = 0,1 mol => x : y : t = nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1 => CTPT có dạng (C2H7N)n Do < 2 => Mx < 64 => n = 1 Đáp án A Câu hỏi 19 : Oxi hóa hoàn toàn 4,02 gam một hợp chất hữu cơ X chỉ thu được 3,18 gam Na2CO3 và 0,672 lít khí CO2. CTĐGN của X là:
Đáp án: A Phương pháp giải: Bảo toàn khối lượng, bảo toàn nguyên tố Lời giải chi tiết: Gọi CTĐGN: CxOyNaz BT nguyên tố C : nC = nNa2CO3 + nCO2 = 0,03 + 0,03 = 0,06 mol nNa= 2nNa2CO3 = 0,06 mol bảo toàn khối lượng: mO = mX – mC – mNa = 4,02 – 0,06.12 – 0,06.23 = 1,92 => nO = 0,12mol => x : y : z = nC : nO : nNa = 0,06 : 0,12 : 0,06 = 1 : 2 : 1 => CTĐGN: CO2Na Đáp án A Câu hỏi 20 : Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X thu được 4,4 gam CO2 và 1,8 gam H2O. Biết tỉ khối của X so với He (MHe = 4) là 7,5. CTPT của X là:
Đáp án: D Phương pháp giải: + BTNT: nC = nCO2 nH = 2nH2O + BTKL: mO = mX – mC – mH => nO => CTĐGN Từ tỉ khối ta suy ra CTPT Lời giải chi tiết: + BTNT: nC = nCO2 = 0,1 mol nH = 2nH2O = 0,2 mol + BTKL: mO = mX – mC – mH = 3 – 0,1.12 – 0,2.1 = 1,6 g => nO = 0,1 mol Gọi CTĐGN là CxHyOz x : y : z = 0,1 : 0,2 : 0,1 = 1 : 2 : 1 => CTĐGN là CH2O => CTPT (CH2O)n Vì MX = 7,5.4 = 30 => n = 1 => X là CH2O Đáp án D Câu hỏi 21 : Đốt cháy 200 ml hơi một hợp chất hữu cơ X chứa C, H, O trong 900 ml O2, thể tích hỗn hợp khí thu được là 1,3 lít. Sau khi ngưng tụ hơi nước chỉ còn 700 ml. Tiếp theo cho qua dung dịch KOH dư chỉ còn 100 ml khí bay ra. Các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất. CTPT của Y là:
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố Lời giải chi tiết: Đặt công thức hợp chất hữu cơ X là CxHyOz (đk: x,y,z nguyên dương) Các chất đo cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích tương ứng với tỉ lệ về số mol Cách 1: 1,3 lít hỗn hợp thu được gồm: CO2, H2O có thể có O2 dư Ngưng tụ hơi nước còn 700 ml => VH2O = 1,3 – 0,7 = 0,6 lít => y = 2nH2O/nX = 2VH2O / VX = 6 Cho qua KOH còn 100ml khí “O2 dư” “CO2 bị hấp thụ” => VCO2 = 0,7 – 0,1 = 0,6 lít => x = nCO2/nX = VCO2 / VX = 3 V O2 pứ = 0,9 – 0,1 = 0,8 BTNT “O”: nO(trong X) = 2nCO2 + nH2O – 2nO2 pư = 2.0,6 + 0,6-2.0,8 = 0,2 (lít) => z = nO(trong X)/ nX = 0,2/0,2 = 1 => CT PT : C3H6O Cách 2: Đặt công thức hợp chất hữu cơ X là CxHyOz (đk: x,y,z nguyên dương) PTHH: CxHyOz + \((x + \frac{y}{4} - \frac{z}{2})\)O2 \(\xrightarrow{{{t^0}}}\) xCO2 + \(\frac{y}{2}\)H2O Theo PTHH: \(1\,\,\, \to (x + \frac{y}{4} - \frac{z}{2})\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \frac{y}{2}\) (mol) Theo PT: 200 800 600 600 (mol) Áp dụng quy tắc tam suất ta có: \(200 \times x = 600 \times 1 \Rightarrow x = \frac{{600}}{{200}} = 3\) \(200 \times \frac{y}{2} = 600 \times 1 \Rightarrow y = \frac{{600 \times 2}}{{200}} = 6\) \(\begin{array}{l}200 \times (x + \frac{y}{4} + \frac{z}{2}) = 800 \times 1\\ \Rightarrow x + \frac{y}{4} - \frac{z}{2} = 4\\ \Rightarrow 3 + \frac{6}{4} - \frac{z}{2} = 4\\ \Rightarrow 4,5 - \frac{z}{2} = 4\\ \Rightarrow \frac{z}{2} = 0,5\\ \Rightarrow z = 1\end{array}\) Vậy CTPT của X: C3H6O Đáp án A Câu hỏi 22 : Phân tích 1,5 gam chất hữu cơ X thu được 1,76 gam CO2 ; 0,9 gam H2O và 112 ml N2 đo ở 0oC và 2 atm. Nếu hóa hơi cũng 1,5 gam chất X ở 127o C và 1,64 atm người ta thu được 0,4 lít khí chất X. CTPT của X là:
Đáp án: C Phương pháp giải: Bảo toàn nguyên tố, bảo toàn khối lượng Lời giải chi tiết: nC = nCO2 = 0,04 mol ; nH = 2nH2O = 0,1 mol ; nN = 2nN2 = 2. P.V / T.0,082 =2. (2.0,112 / 273.0,082) = 0,02 mol Bảo toàn khối lượng: mO = mX – mC – mH – mN = 1,5 – 0,04.12 – 0,1.1 – 0,02.14 = 0,64 g => nO = 0,04 mol => x : y : z : t = nC : nH : nO : nN = 0,04 : 0,1 : 0,04 : 0,02 = 2 : 5 : 2 : 12 => CTĐGN : (C2H5O2N)n nX = P.V/T.0,082 = (1,64.0,4 / (127+273).0,082) = 0,02 mol => MX = 1,5/0,02 = 75 = (12.2 + 4 + 16.2+14).n => n = 1 Đáp án C Câu hỏi 23 : Khi đốt 1 lít khí X cần 6 lít O2 thu được 4 lít CO2 và 5 lít hơi H2O (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). CTPT của X là:
Đáp án: A Phương pháp giải: Gọi CTPT của X là : CxHyOz => x = nCO2/nX = VCO2 / VX => y = 2nH2O/nX = 2VH2O / VX Bảo toàn nguyên tố O: VO trong X = 2nVCO2 + nH2O – 2nO2 => z Lời giải chi tiết: Gọi CTPT của X là : CxHyOz => x = nCO2/nX = VCO2 / VX = 4 => y = 2nH2O/nX = 2VH2O / VX = 10 Bảo toàn nguyên tố O: VO trong X + 2.6 = 4.2 + 5 => VO trong X = 1 => z = 1 => CTPT của X là C4H10O. Đáp án A Câu hỏi 24 : Đốt cháy hoàn toàn 1,2 gam chất hữu cơ A thu được sản phẩm cháy gồm CO2 và H2O. Hấp thụ toàn bộ sản phẩm cháy trong dung dịch Ba(OH)2 dư thấy khối lượng bình chứa tăng 4,08 gam. Biết rằng số mol CO2 gấp 0,75 lần số mol của nước. Biết A có 1 nguyên tử oxi trong phân tử. CTPT của A là:
Đáp án: A Phương pháp giải: Đặt nCO2 = a và nH2O = b (mol) - Ta thấy CO2 và H2O bị giữ lại ở bình Ba(OH)2 nên làm cho khối lượng của bình tăng. Từ mbình tăng => (1) - Theo đề bài, số mol CO2 gấp 0,75 lần số mol của nước => (2) Giải hệ (1) và (2) được a, b BTNT "C": nCO2 = nC = ? BTNT "H": nH = 2nH2O = ? Mặt khác: mO = mA - (mC + mH) = ? => nO = ? Lập tỉ lệ C : H : O. Dựa vào dữ kiện A chỉ có 1O suy ra CTPT của A. Lời giải chi tiết: Đặt nCO2 = a và nH2O = b (mol) - Ta thấy CO2 và H2O bị giữ lại ở bình Ba(OH)2 nên làm cho khối lượng của bình tăng. => mbình tăng = 44a + 18b = 4,08 (1) - Theo đề bài, số mol CO2 gấp 0,75 lần số mol của nước => a = 0,75b (2) Giải hệ (1) và (2) được a = 0,06 ; b = 0,08 BTNT "C": nCO2 = nC = 0,06 mol BTNT "H": nH = 2nH2O = 0,16 mol Mặt khác: mO = mA - (mC + mH) = 1,2 - 0,06.12 - 0,16.1 = 0,32 gam => nO = 0,02 mol => nC : nH : nO = 0,06 : 0,16 : 0,02 = 3 : 8 : 1 Vì A chỉ có 1 nguyên tử O trong phân tử => CTPT của A là C3H8O Đáp án A Câu hỏi 25 : Đốt cháy hết một hidrocacbon A thu được hỗn hợp X gồm CO2 và H2O.Dẫn toàn bộ hỗn hợp X vào dung dịch Ca(OH)2 (dư) thu được 90 gam kết tủa đồng thời khối lượng dung dịch sau phản ứng giảm đi 39,6 gam. A là
Đáp án: C Phương pháp giải: Bảo toàn nguyên tố : n C = n CO2 , n H = 2 n H2O CxHy : m tủa = m CaCO3 , nCaCO3 = n CO2 , m dd giảm = m CaCO3 –( m CO2 + m H2O ) Lời giải chi tiết:
Hướng dẫn giải : n CaCO3 = 0,9 = nCO2 => mCO2 = 39.6 g m dd giảm = mCaCO3 – (mCO2 + mH2O ) = 39.6 =>mH2O = 10,8 => n H2O = 0,6 mol nC = nCO2= 0.9 mol nH = 2nH2O = 1,2 mol CxHy : Đáp án C Câu hỏi 26 : Đốt cháy hoàn toàn một hidrocacbon A thu được hỗn hợp X gồm CO2 và H2O.Dẫn toàn bộ hỗn hợp X vào trong bình đựng dung dịch Ba(OH)2 (dư) thu được 39,4 gam kết tủa đồng thời khối lượng bình tăng 12,4 gam.Vậy Acó thể là
Đáp án: B Phương pháp giải: Bảo toàn nguyên tố : nC = nCO2 , nH = 2 nH2O CxHy : m tủa = m BaCO3 , nBaCO3 = n CO2 , m bình tăng = m CO2 + m H2O Lời giải chi tiết:
Hướng dẫn Giải : n BaCO3 = n CO2 = 0,2 mol => m CO2 = 8,8 g =>m bình tăng = m CO2 + m H2O = 12.4 =>m H2O = 3.6 g => n H2O = 0.2 mol =>n C = n CO2= 0.2 mol =>n H = 2 n H2O = 0.4 mol CxHy : =>Công thức của hidrocacbon là C2H4 Đáp án B Câu hỏi 27 : Đốt cháy 5,8 gam một hợp chất hữu cơ đơn chức X cần 8,96 lít khí O2 (đktc), thu được CO2 và H2O có số mol bằng nhau. Công thức đơn giản nhất của X là:
Đáp án: B Phương pháp giải: Phương pháp: Bảo toàn khối lượng Tìm CTĐGN qua công thức : x : y : z = nC : nH : nO Lời giải chi tiết:
Hướng dẫn giải: Đặt CTPT : CxHyOz n O2 = 8,96: 22,4 = 0,4 ( mol) Gọi n H2O = n CO2 = a( mol) Bảo toàn khối lượng: 5,8 + 0,4.32 = 44a + 18a => a = 0,3 ( mol) n O (TRONG A) = ( 5,8 – 0,3.12 – 0,3.2) : 16 = 0,1 (mol) => x: y : z = 0,3 : 0.6 : 0,1 = 3: 6 : 1 Vậy CTPT C3H6O Đáp án: B Câu hỏi 28 : Đốt cháy hoàn toàn 1,12g chất hữu cơ A, rồi cho hấp thụ toàn bộ sản phẩm cháy trong dung dịch Ba(OH)2 dư thấy khối lượng bình chứa tăng 3,36g. Biết rằng số mol CO2 gấp 1,5 lần số mol của nước. CTPT của A là: (biết A có 1 nguyên tử oxi trong phân tử):
Đáp án: D Phương pháp giải: Khối lượng bình đựng Ba(OH)2 tăng lên chính là khối lượng của H2O và CO2. Số mol CO2 gấp 1,5 lần H2O nên sẽ tìm được số mol của CO2 và H2O. Từ đó tìm được công thức đơn giản nhất. Vì trong A có 1 nguyên tử O nên lập được công thức phân tử của A Lời giải chi tiết: Khối lượng bình đựng Ba(OH)2 tăng lên chính là khối lượng của H2O và CO2. Ta có mCO2 + mH2O =3,36 g và nCO2 = 1,5nH2O suy ra nH2O = 0,04 mol, nCO2 = 0,06 mol nC = 0,06 mol, nH =0,08 mol mO = 1,12 – 0,06.12 - 0,08 = 0,32 g → nO = 0,02 mol nC : nH : nO = 0,06 : 0,08 : 0,02 = 3 : 4 : 1 → Công thức đơn giản nhất của A là C3H4O Vì A có 1 nguyên tử O nên công thức phân tử của A là C3H4O Đáp án D Câu hỏi 29 : Đốt cháy hoàn toàn 5,8 gam chất A thu được 2,65 gam Na2CO3; 2,25 gam H2O và 12,1 gam CO2. Biết A có 1 nguyên tử O. Công thức phân tử của A là
Đáp án: B Phương pháp giải: Từ khối lượng các chất sau phản ứng tìm được số mol của các nguyên tử C, H, O, Na. Từ đó tìm được công thức đơn giản nhất của A. Biết trong A có 1 nguyên tử O nên tìm được công thức phân tử của A. Lời giải chi tiết: nNa2CO3 = 0,025 mol, nH2O = 0,125 mol, nCO2 = 0,275 mol suy ra nC = nNa2CO3 + nCO2 = 0,025 + 0,275 = 0,3 mol , nH = 0,25 mol nNa = 0,025.2 = 0,05 mol Ta có mC + mH + mNa =0,05.23 + 0,3.12 + 0,25.1 = 5 g → mO = 5,8 – 5 = 0,8 g → nO = 0,05 mol nC : nH : nO : nNa = 0,3 : 0,25 : 0,05 : 0,05 = 6 : 5 : 1 :1 Vậy công thức đơn giản nhất của A là C6H5ONa Đáp án B Câu hỏi 30 : Khi đốt cháy hoàn toàn 0,42 g một hiđrocacbon X thu toàn bộ sản phẩm qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư. Kết quả, bình 1 tăng 0,54 g; bình 2 tăng 1,32 g. Biết rằng khi hóa hơi 0,42 g X chiếm thể tích bằng thể tích của 0,192 g O2 ở cùng điều kiện. Tìm CTPT của X
Đáp án: D Phương pháp giải: - Khối lượng bình đựng H2SO4 tăng chính là khối lượng của H2O. - Khối lượng bình đựng KOH tăng là khối lượng CO2. - Áp dụng bảo toàn nguyên tố tìm được số mol và khối lượng của C và H. - Từ dữ kiện khi hóa hơi 0,42 g X chiếm thể tích bằng thể tích của 0,192 g O2 ở cùng điều kiện tìm được số mol X - Tính khối lượng phân tử của X => CTCT của X Lời giải chi tiết: 0,42g X có VX = VO2 của 0,192g O2 (cùng điều kiện) => nX = nO2 \( \Rightarrow \frac{{{m_X}}}{{{M_X}}} = \frac{{{m_{O2}}}}{{{M_{O2}}}} \Rightarrow {M_X} = \frac{{{m_X}.{M_{O2}}}}{{{m_{O2}}}} = \frac{{0,42.32}}{{0,192}} = 70\) * Gọi X : CxHy \({C_x}{H_y}{\text{ + }}\left( {{\text{x + }}\frac{y}{4}} \right){\text{ }}{{\text{O}}_{2{\text{ }}}} \to {\text{ xC}}{{\text{O}}_2}{\text{ + }}\frac{y}{2}{H_2}{O_{\text{ }}}\) MX 44x 9y (g) 0,42 mCO2 mH2O (g) Ta có : \({C_n}{H_{2n + 2}}{\text{ + }}\frac{{3n + 1}}{2}{\text{ }}{{\text{O}}_2}{\text{ }} \to {\text{nC}}{{\text{O}}_2}{\text{ + (n + 1)}}{{\text{H}}_2}O\)(1) - Bình 1 đựng dd H2SO4 đ sẽ hấp thụ H2O do đó độ tăng khối lượng bình 1 chính là khối lượng của H2O : Δm1 = mH2O = 0,54g (2) - Bình 2 đựng dd KOH dư sẽ hấp thụ CO2 do đó độ tăng khối lượng bình 2 chính là khối lượng của CO2 : Δm2 = mCO2 = 1,32g (3) (1), (2), (3) => \(\frac{{70}}{{0,42}} = \frac{{44x}}{{1,32}} = \frac{{9y}}{{0,54}}\) => x = 5 ; y = 10 Vậy CTPT X: C5H10 (M = 70đvC) Đáp án D
|













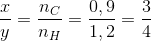 => Công thức của hidrocacbon là C6H8 ( vì ko có C3H4 )
=> Công thức của hidrocacbon là C6H8 ( vì ko có C3H4 )