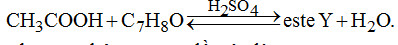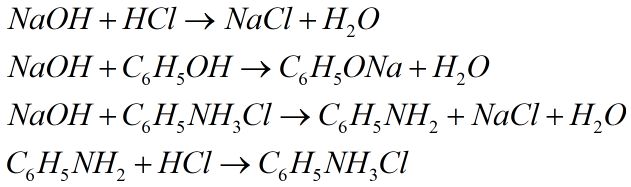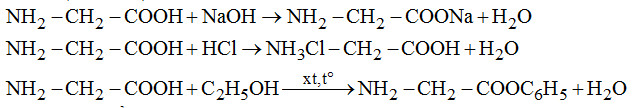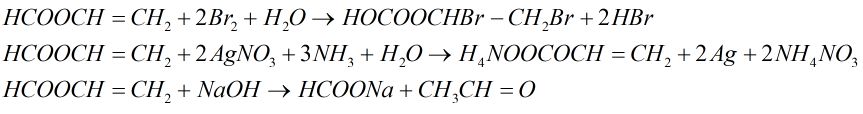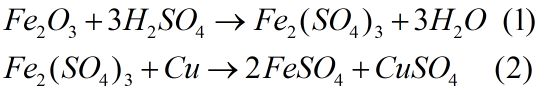Đề số 18 - Đề kiểm tra học kì 1 - Hóa học 12Đáp án và lời giải chi tiết Đề số 18 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 12 Đề bài I. PHẦN TRẮC NGHIỆM (3 điểm) Câu 1. Cho các dung dịch : \(HCl,\,AgN{O_3},\,{H_2}S{O_4}\) loãng, \({H_2}S{O_4}\) đặc nguội, \(Cu{(N{O_3})_2},Fe{(N{O_3})_2},\,HN{O_3}\) loãng. Số dung dịch co thể dùng (dư) để thu được Ag tinh khiết từ hỗn hợp rắn gồm Ag, CuO, Fe là A. 1. B. 2. C. 3. D. 4. Câu 2. Liên kết hóa học trong tinh thể Na là liên kết giữa A. các cặp electron dùng chung với các hạt nhân B. toàn bộ electron tự do với các ion duong natri ở các nút mạng C. các ion dương với các ion âm D. cả 3 kiểu trên Câu 3. Dãy nào gồm các chất rắn không tan trong \({H_2}O,\) nhưng tan trong dung dịch \({H_2}S{O_4}\) loãng dư \(\begin{array}{l}A.\,CuO,\,Cu,\,Fe,\,Cu{(OH)_2}.\\B.\,\,Na,\,N{a_2}O,\,N{a_2}C{O_3},\,CaC{O_3}\\C.\,Fe,\,FeS,\,F{e_3}{O_4},\,Fe{(OH)_2}\\ D.\,\,Al,\,A{l_2}{O_3},CaO,Mg{(OH)_2}\end{array}\) Câu 4. Nhúng các thanh Fe giống nhau cùng lúc vào các dung dịch dưới đây. Trường hợp nào thanh Fe bị ăn mòn nhanh nhất? A. 200 ml dung dịch \({H_2}S{O_4}\) 0,2M. B. 200 ml dung dịch \({H_2}S{O_4}\) 0,2 M có cho thêm lượng nhỏ \(CuS{O_4}.\) C. 200 ml dung dịch \({H_2}S{O_4}\) 0,25M. D. 200 ml dung dịch \({H_2}S{O_4}\) 0,25M có cho thêm lượng nhỏ dung dịch \(ZnS{O_4}.\) Câu 5. Cho các dung dịch: \(NaOH,\,HCl,\,{C_6}{H_5}OH,\,{C_6}{H_5}N{H_2}\)\(,\,{C_6}{H_5}N{H_3}Cl,B{r_2}\) lần lượt tác dụng với nhau từng đôi một. Số phản ứng xảy ra thuộc loại phản ứng axit – bazơ là A. 1. B. 3. C. 6. D. 4. Câu 6. Cho sơ đồ Số công thức cấu tạo của \({C_7}{H_8}O\) chứa vòng benzen thỏa mãn sơ đồ trên là A. 1. B. 3. C. 5. D. 4. II. PHẦN TỰ LUẬN (7 điểm) Câu 1. (2 điểm) Viết cấu hình eletron của Fe ( Z = 26) và các ion \(F{e^{2 + }},F{e^{3 + }}.\) Từ đó cho biết tính chất hóa học cơ bản của chúng. Mỗi trường hợp viết một phương trình minh họa. Câu 2. (1,5 điểm) Viết phương trình hóa học xảy ra khi cho glyxin \(({H_{_2}}N - C{H_2} - COOH)\) lần lượt tác dụng với: dung dịch NaOH, dung dịch HCl, \({C_2}{H_5}OH\) có mặt khí HCl bão hòa. Câu 3. (1,5 điểm) Este A có công thức phân tử \({C_3}{H_4}{O_2}.\) Thực hiện các phản ứng sau của A: + Cho A tác dụng với dung dịch brom. + Cho A tác dụng với dung dịch \(AgN{O_3}\) trong \(N{H_3}\) + Đun A với dung dịch NaOH. Viết các phương trình hóa học xảy ra ở dạng công thức cấu tạo. Câu 4. (2 điểm) Cho 28,8 gam hỗn hợp Cu và \(F{e_2}{O_3}\) tác dụng với dung dịch \({H_2}S{O_4}\) loãng dư thu được dung dịch A và 6,4 gam chất rắn không tan. a) Viết phương trình hóa học xảy ra. b) Tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu Lời giải chi tiết I. PHẦN TRẮC NGHIỆM (3 điểm) Câu 1. Chọn B. Chỉ dung dịch HCl loãng hoặc \({H_2}S{O_4}\) loãng dùng dư mới hòa tan hết tạp chất cả CuO và Fe, mà không hoàn tan Ag. Câu 2. Chọn B. Liên kết hóa học trong tinh thể Na là liên kết kim loại do toàn bộ electron tự do với các ion dương \(N{a^ + }\) ở nút mạng. Câu 3. Chọn C. Cu không tan trong cả \({H_2}O\) và dung dịch \({H_2}S{O_4}\) loãng dư \( \Rightarrow \) loại A. Na và CaO tan trong cả \({H_2}O\) và dung dịch \({H_2}S{O_4}\) loãng dư \( \Rightarrow \) loại B và D. Câu 4. Chọn B. Fe bị ăn mòn điện hóa (các trường hợp còn lại là ăn mòn hóa học) do: Fe đẩy Cu (khỏi \(CuS{O_4}\)) tạo cặp pin Fe – Cu trong đó Fe là cực âm. Câu 5. Chọn D. 4 phản ứng là phản ứng axit – bazơ là
Câu 6. Chọn A. Chỉ có thể là ancol thơm \({C_6}{H_5}C{H_2}OH\) (duy nhất). II. PHẦN TỰ LUẬN (7 điểm) Câu 1. (2 điểm) \(Fe:\left[ {Ar} \right]3{d^6}4{s^2}\) chất khử trung bình (tác dụng với dung dịch HCl tạo \(F{e^{2 + }}\), tác dụng \(HN{O_3}\) tạo \(F{e^{3 + }}\)): \(Fe + 2{H^ + } \to F{e^{2 + }} + {H_2}\) Ion \(F{e^{2 + }}:\left[ {Ar} \right]3{d^6}\) là chất khử (tác dụng với chất oxi hóa \(C{l_2},{\rm{dd}}AgN{O_3},...\)) hoặc chất oxi hóa (tác dụng với chất khử là kim loại trước Fe: Al, Zn): \(F{e^{2 + }} + C{l_2} \to F{e^{3 + }} + 2C{l^ - }\) Ion \(F{e^{3 + }}:\left[ {Ar} \right]3{d^5}\) là chất oxi hóa khá mạnh (tác dụng với chất khử kim loại, KI,…) Câu 2. (1,5 điểm) Câu 3. (1,5 điểm) A là \(HCOOCH = C{H_2}\) (có hai loại chức: este –COO– và chức anđehit –CH=O và liên kết đôi)
Câu 4. (2 điểm)
Cu dư 6,4 gam Theo (1) và (2): số mol Cu tan = số mol \(F{e_2}{O_3}\) trong hỗn hợp = a \(\begin{array}{l}{m_{F{e_2}{O_3}}} + {m_{Cu(\tan )}} = 28,8 - 6,4 = 22,4\\160a + 64a = 22,4 \Rightarrow a = 0,1mol\end{array}\) \( \Rightarrow {m_{Cu}}\) trong hỗn hợp là 12,8 gam chiếm 44,44% khối lượng còn \(F{e_2}{O_3}\) chiếm 55,56% khối lượng. HocTot.Nam.Name.Vn
|