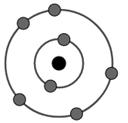
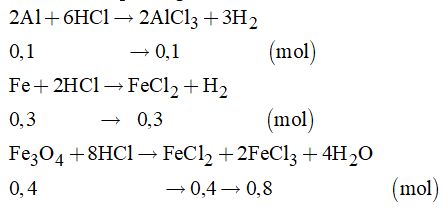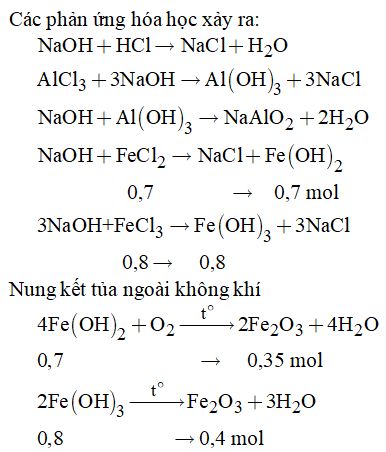Đề số 3 - Đề kiểm tra học kì 2 - Hóa học 10Đáp án và lời giải chi tiết Đề số 3 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 10 Đề bài Câu 1. Chọn câu đúng trong các câu sau? A.Có thể dùng các thùng bằng nhôm để đựng axit sunfuric loãng. B.Trong các hợp chất clo có các số oxi hóa là -1, +1, +3, +5, +7. C.Trong phòng thí nghiệm, người ta thường điều chế oxi bằng phương pháp chưng cất phân đoạn không khí lỏng. D.Khí H2S có thể làm quỳ tím ẩm chuyển sang màu xanh. Câu 2. Khí SO2 được điều chế trong phòng thí nghiệm bằng phản ứng \(\eqalign{ & A.N{a_2}S{O_3} + {H_2}S{O_4} \to N{a_2}S{O_4} + S{O_2} + {H_2}O. \cr & B.4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}. \cr & C.S + 2{H_2}S{O_{4\left( d \right)}} \to 3S{O_2} + 2{H_2}O. \cr & D.S + {O_2} \to S{O_2}. \cr} \) Câu 3. Hòa tan hoàn toàn hỗn hợp gồm 0,1 mol Al; 0,3 mol Fe và 0,4 mol Fe3O4 bằng dung dịch HCl dư thu được dung dịch A. Cho A tác dụng với dung dịch NaOH dư, rồi lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là A.96,0. B.106,8. C.120,0. D.130,2. Câu 4. Cho các dung dịch: H2SO4, NaOH, NaCl, BaCl2, Na2SO4 được đựng trong các lọ riêng biệt không có nhãn. Chỉ dùng quỳ tím có thể nhận biết được tối đa bao nhiêu chất? A.2. B.3. C.4. D.5. Câu 5. Cho nguyên tử của nguyên tử X có cấu tạo như sau: Vị trí của nguyên tố trên trong bảng tuần hoàn là A.ô số 7, chu kì 2, nhóm VIIA. B.ô số 7, chu kì 2, nhóm VA. C.ô số 5, chu kì 2, nhóm VA. D.ô số 5, chu kì 7, nhóm VIIA. Câu 6. Trong thí nghiệm, để điều chế một lượng nhỏ khí oxi người ta có thể nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt như KMnO4 (rắn), KClO3 (rắn),... Cho các bước tiến hành như sau 1.Kẹp ống nghiệm lên giá, đưa ống dẫn vào miệng bình thu khí. 2.Lấy một lượng nhỏ tinh thể KMnO4 cho vào ống nghiệm, thêm một nhúm bông ở gần miệng ống nghiệm. 3.Đậy miệng ống nghiệm bằng nút cao su có kèm ống dẫn. 4.Dùng đèn cồn hơ đều ống nghiệm sau đó tập trung đun tại chỗ có KMnO4. 5.Lấy đầy nước vào các bình thu khí, sau đó úp trong chậu nước. 6.Khi đã thu đủ lượng khí cần dùng thì rút ống dẫn khí, sau đó tắt đèn cồn. Thứ tự các thao tác tiến hành thí nghiệm là A.5 – 1 – 2 – 4 – 3 – 6. B.5 – 2 – 1 – 4 – 3 – 6. C.5 – 2 – 3 – 1 – 4 – 6. D.1 – 5 – 2 – 3 – 4 – 6. Câu 7. Cho các phản ứng hóa học sau: \(\eqalign{ & \left( a \right)S + {O_2} \to S{O_2} \cr & \left( b \right)S + 3{F_2} \to S{F_6} \cr & \left( c \right)S + Hg \to HgS. \cr & \left( d \right)S + 6HN{O_{3\left( d \right)}} \to {H_2}S{O_4} + 6N{O_2} + 2{H_2}O \cr} \) Số phản ứng trong đó S thể hiện tính khử là A.2. B.3. C.1. D.4. Câu 8. X và Y là hai nguyên tố thuộc cùng một chu kì và ở hai nhóm A liên tiếp. Số proton của ngyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng? A.Độ âm điện của X lớn hơn độ âm điện của Y. B.Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron. C.Đơn chất X là chất khí ở điều kiện thường. D.Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron. Câu 9. Chỉ ra nhận định không đúng trong những câu sau: A.Trong một chu kì, theo chiều điện tích hạt nhân tăng dần, tính kim loại giảm dần, tính phi kim tăng dần. B.Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. C.Bảng tuần hoàn các nguyên tố hóa học có 7 chu kì, chu kì 1, 2, 3 là các chu kì nhỏ, chu kì 4, 5, 6, 7 là các chu kì lớn. D.Nguyên tử của các nguyên tố cùng chu kì có số electron bằng nhau. Câu 10. Cho FeS tác dụng với dung dịch HCl thu được khí X. Nhiệt phân KClO3 có xúc tác MnO2 thu được khí Y. Cho Na2SO3 tác dụng với dung dịch HCl thu được khí Z. Các khí X, Y, Z lần lượt là \(\eqalign{ & A.{H_2}S,C{l_2},S{O_2}. \cr & B.{O_2},{H_2}S,S{O_2}. \cr & C.{H_2}S,{O_2},S{O_2}. \cr & D.{O_2},S{O_2},{H_2}S. \cr} \) Câu 11. Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là A.2. B.4. C.3. D.5. Câu 12. Cho phản ứng hóa học sau: \(Fe + CuS{O_4} \to FeS{O_4} + Cu.\) Trong phản ứng trên xảy ra A.sự khử Fe2+ và sự oxi hóa Cu. B.sự oxi hóa Fe và sự oxi hóa Cu. C.sự khử Fe2+ và sự khử Cu2+. D.sự oxi hóa Fe và sự khử Cu2+. Câu 13. Lấy 50 ml dung dịch HCl 1M vào một ống nghiệm rồi thả vào đó một mẩu quỳ tím. Nhỏ từ từ dung dịch KOH 2M vào ống nghiệm trên đến khi thấy màu giấy quỳ thành màu tím trở lại thì hết đúng V ml. Giá trị của V là A.0 ml. B.50 ml. C.25 ml. D.100 ml. Câu 14. Hấp thụ hoàn toàn 6,4 gam SO2 vào 150 ml dung dịch NaOH 2M thu được dung dịch X. Thành phần của dung dịch X là \(\eqalign{ & A.N{a_2}S{O_3},NaOH. \cr & B.NaHS{O_3},N{a_2}S{O_3}. \cr & C.NaHS{O_3},NaOH. \cr & D.NaHS{O_3}. \cr} \) Câu 15. Chỉ ra nhận định đúng nhất trong các câu sau Liên kết cộng hóa trị là liên kết A.trong đó cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện cao hơn. B.được hình thành do sự dùng chung electron của hai nguyên tử khác nhau. C.giữa các phi kim với nhau. D.được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Câu 16. Cho dãy các chất sau: NaCl, AgNO3, CO2, CuO, Fe(OH)3, Na, Ag, CaCO3. Số chất trong dãy có thể tác dụng với dung dịch HCl là A.3. B.5. C.4. D.6. Câu 17. Tính chất nào sau đây biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân? A.Số lớp electron. B.Số proton trong hạt nhân nguyên tử. C.Nguyên tử khối. D.Số electron lớp ngoài cùng. Câu 18. Nguyên tố X thuộc chu kì 4, nhóm VA. Cấu hình electron của nguyên tử nguyên tố X là \(\eqalign{ & A.1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^2}4{p^3}. \cr & B.1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^3}4{s^2}. \cr & C.1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^3}. \cr & D.1{s^2}2{s^2}2{p^6}3{s^2}3{p^3}. \cr} \) Câu 19. Cho các nguyên tố 20Ca, 12Mg, 13Al, 15P. Thứ tự tính kim loại giảm dần là A. Ca, Mg, Al, P. B. Mg, Ca, Al, P. C. Al, Mg, Ca, P. D. Ca, P, Al, Mg. Câu 20. X, Y, Z là những nguyên tố có số đơn vị điện tích hạt nhân lần lượt là 9, 19, 8. Nếu các cặp X và Y; Y và Z; X và Z tạo thành liên kết hóa học thì các cặp nào sau đây có thể tạo thành liên kết cộng hóa trị phân cực? A. Cặp X và Y, cặp Y và Z. B. Cặp X và Y, cặp X và Z. C. Cặp X và Z. D. Cả 3 cặp. Câu 21. Quá trình nào sau đây không sinh ra khí oxi? A.Cho MnO2 tác dụng với HCl đặc, nóng. B.Điện phân nước. C.Nhiệt phân KClO3, xúc tác MnO2 D.Cây xanh quang hợp. Câu 22. Cho các nhận định sau (1)Iot tan nhiều trong ancol etylic tạo thành cồn iot để sát trùng. (2)Số oxi hóa của N trong NH4+ và NH3 đều là -3. (3) H2S là một khí độc, không màu, mùi trứng thối. (4)Axit sunfuric đặc có tính háo nước nên được sử dụng để làm khô một số khí như O2, CO2... (5)Flo có thể tan trong nước tạo thành nước flo. (6)Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở nhiệt độ thường ta thu được clorua vôi. Số nhận định đúng là A.3. B.6. C.5. D.4. Câu 23. Trong các cân bằng sau, cân bằng nào không bị chuyển dịch khi thay đổi áp suất chung của hệ? \(\eqalign{ & A.C{H_{4\left( k \right)}} + {H_2}{O_{\left( k \right)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{O_{\left( k \right)}} + 3{H_{2\left( k \right)}}. \cr & B.2H{I_{\left( k \right)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_{2\left( k \right)}} + {I_{2\left( k \right)}}. \cr & C.2S{O_{2\left( k \right)}} + {O_{2\left( k \right)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3\left( k \right)}}. \cr & D.CaC{O_{3\left( r \right)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Ca{O_{\left( r \right)}} + C{O_{2\left( k \right)}}. \cr} \) Câu 24. Sắt là nguyên tố kim loại phổ biến nhất trong vũ trụ và cũng là kim loại được sử dụng nhiều nhất trong đời sống và sản xuất. Trong tự nhiên, sắt có 4 đồng vị bền là 54Fe, 56Fe, 57Fe và 58Fe với phần trăm số nguyên tử tương ứng là: 5,8%; 91,7%; 2,2%; 0,3%. Nguyên tử khối trung bình của sắt là A.56,0. B.55,921. C.55,912. D.55,129. Câu 25. Mưa axit là hiện tượng mà giá trị pH trong nước mưa dưới 5,6 (kiến thức về pH sẽ được học ở chương I, hóa học 11). Đây là hiện tượng rất nguy hại đến môi trường, đến sức khỏe con người, đến hệ thống cơ sở hạ tầng và đến việc bảo tồn các di tích lịch sử... Nguyên nhân gây mưa axit chủ yếu do các khí SO2 và NO2 ( được sinh ra do cháy rừng, núi lửa phun trào, nhưng phần lớn được sinh ra trong quá trình xả thải của các nhà máy...). các khí này hòa tan với nước với hơi nước trong không khí tạo thành axit H2SO4 và HNO3. Khi trời mưa, các hạt axit này sẽ lẫn vào nước mưa và tạo mưa axit. Quá trình hình thành H2SO4 và HNO3 trong mưa axit được biểu diễn bằng các phản ứng sau: +) Quá trinh hình thành H2SO4. \(\eqalign{ & 1.S + {O_2}\buildrel {t^\circ } \over \longrightarrow S{O_2}. \cr & 2.2S{O_2} + {O_2}\buildrel {t^\circ } \over \longrightarrow 2S{O_3}. \cr & 3.S{O_3} + {H_2}O \to {H_2}S{O_4}. \cr} \) +) Quá trình hình thành HNO3. \(\eqalign{ & 4.{N_2} + {O_2}\buildrel {t^\circ } \over \longrightarrow 2NO. \cr & 5.2NO + {O_2} \to 2N{O_2}. \cr & 6.3N{O_2} + {H_2}O \to 2HN{O_3} + NO. \cr} \) Trong các phản ứng trên số phản ứng không thuộc loại phản ứng oxi hóa khử là A.1. B.2. C.3. D.0. Câu 26. Nguyên tố X thuộc nhóm VIIA trong bảng tuần hoàn. Trong hợp chất khí của X với hidro (hợp chất Y) thì X chiếm 97,26% về khối lượng. X là A.F. B.Cl. C.Br. D.I. Câu 27. Hòa tan hoàn toàn 5,4 gam nhôm bằng dung dịch H2SO4 loãng thu được V lít khí H2 (đktc). Giá trị của V là A.3,36. B.4,48. C.6,72. D.2,24. Câu 28. Trong phản ứng \(2FeC{l_3} + {H_2}S \to 2FeC{l_2} + S + 2HCl.\) Cho biết vai trò của H2S A.chất oxi hóa. B.chất khử. C.axit. D.vừa axit vừa khử. Câu 29. Nhận xét nào sau đây không đúng? A.Ozon được dùng để điều chế oxi trong phòng thí nghiệm. B.Sắt tác dụng với axit sunfuaric đặc, nóng, dư thu được muối sắt (III). C.Khi sục khí SO2 từ từ đến dư vào dung dịch nước vôi trong thì lúc đầu thấy xuất hiện kết tủa màu tráng, sau đó kết tủa tan. D.Trong tự nhiên, lưu huỳnh tồn tại ở cả dạng đơn chất và hợp chất. Câu 30. Cho cân bằng trong bình kin sau: \(2N{O_{2\left( k \right)}} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_{4\left( k \right)}}\) (màu nâu đỏ) (không màu) Biết rằng khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng nghịch có A. \(\Delta H < 0\), phản ứng thu nhiệt. B. \(\Delta H < 0\), phản ứng tỏa nhiệt. C. \(\Delta H > 0\), phản ứng thu nhiệt. D. \(\Delta H > 0\), phản ứng thu nhiệt. Lời giải chi tiết
Câu 3: Cách 1: Tính toán theo phương trình
Dung dịch A gồm AlCl3, FeCl2, FeCl3 và HCl dư Cho A tác dụng với dung dịch NaOH
Vậy khối lượng chất rắn thu được là: \(m = \left( {0,35 + 0,4} \right).160 = 120g\) Cách : Bảo toàn nguyên tố \(\left\{ \matrix{ Al \hfill \cr Fe \hfill \cr F{e_3}{O_4} \hfill \cr} \right.\buildrel { + HCl} \over \longrightarrow {\rm{dd}}A\left\{ \matrix{ AlC{l_3} \hfill \cr FeC{l_2} \hfill \cr FeC{l_3} \hfill \cr} \right.\)\(\,\buildrel { + NaOH} \over \longrightarrow \left\{ \matrix{ Fe{\left( {OH} \right)_2} \hfill \cr Fe{\left( {OH} \right)_3} \hfill \cr} \right.\buildrel {t^\circ } \over \longrightarrow F{e_2}{O_3}\) Bảo toàn nguyên tố Fe ta có \(\eqalign{ & {n_{F{e_2}{O_3}}} = {1 \over 2}{n_{Fe}} + {3 \over 2}{n_{F{e_3}{O_4}}} \cr&\;\;\;\;\;\;= {1 \over 2}.0,3 + {3 \over 2}.0,4 = 0,75\left( {mol} \right) \cr & \to m = 0,75.160 = 120\left( g \right) \cr} \) Câu 4: Dùng quỳ tím nhận biết được + Dung dịch H2SO4 làm quỳ tím chuyển màu đỏ. + Dung dịch NaOH làm quỳ tím chuyển màu xanh. + Dung dịch NaCl, Na2SO4 và BaCl2 không làm quỳ tím chuyển màu. Lấy một ít dung dịch H2SO4 vừa nhận biết được cho tiếp vào 3 mẫu thử chứa NaCl, Na2SO4 và BaCl2 + Có kết tủa trắng thì dung dịch đó là BaCl2. + Không có hiện tượng gì là các dung dịch Na2SO4 và NaCl. Lấy một ít dung dịch BaCl2 vừa nhận biết được cho vào hai mẫu thử còn lại + có kết tủa trắng là Na2SO4 + Không hiện tượng là NaCl Như vậy dùng quỳ tím có thể nhận biết được 5 chất. Đáp án D Câu 6: Thứ tự các bước tiến hành thí nghiệm là: 5.Lấy đầy nước vào các bình thu khí, sau đó úp trong chậu nước. 2.Lấy một lượng nhỏ tinh thể KMnO4 cho vào ống nghiệm, thêm một nhúm bông ở gần miệng ống nghiệm. 3.Đậy miệng ống nghiệm bằng nút cao su có kèm ống dẫn. 4.Dùng đèn cồn hơ đều ống nghiệm sau đó tập trung đun tại chỗ có KMnO4. 6.Khi đã thu đủ lượng khí cần dùng thì rút ống dẫn khí, sau đó tắt đèn cồn. Đáp án C Câu 7: (a) \(S + {O_2} \to S{O_2}\) Số oxi hóa của S tăng từ 0 lên +4 nên S là chất khử. \(\left( b \right)S + 3F{e_2} \to S{F_6}\) Số oxi hóa của S tăng từ 0 lên +6 nên S là chất khử. \(\left( c \right)S + Hg \to HgS\) Số oxi hóa của S giảm từ 0 xuống -2 nên S là chất oxi hóa. \(\left( d \right)S + HN{O_3} \to {H_2}S{O_4} + 6N{O_2} + 2{H_2}O\) Số oxi hóa của S tăng từ 0 lên +6 nên S là chất khử. Câu 8: Vì X, Y thuộc cùng một chu kì và ở hai nhóm A liên tiếp nên số proton của chúng hơn kém nhau là 1 Theo đề bài ra ta có: \(\left\{ \matrix{ {p_X} - {p_Y} = 1 \hfill \cr {p_y} + {p_Y} = 33 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ {p_Y} = 17 \hfill \cr {p_X} = 16 \hfill \cr} \right.\) Cấu hình electron của X: 1s22s22p63s23p4 \( \Rightarrow \) có 6 electron ở lớp ngoài cùng \( \Rightarrow \) X là phi kim \( \Rightarrow \) loại D. Ở điều kiện thường X ở dạng rắn \( \Rightarrow \) loại C. Cấu hình của Y: \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^5} \Rightarrow \) có 7 electron lớp ngoài cùng \( \Rightarrow \) Y là phi kim\( \Rightarrow \) loại B. Đáp án A Câu 13: Ban đầu khi thả quỳ tím vào dung dịch HCl thì quỳ tím chuyển sang màu đỏ. Nhỏ dung dịch KOH vào thì màu đỏ nhạt dần cho đến khi dung dịch axit trung hòa hết thì giấy quỳ lại trở về màu tím. NHCl = 0,05 mol Phương trình hóa học: \(\eqalign{ & {\rm{ HCl + KOH}} \to {\rm{KCl + }}{{\rm{H}}_2}O \cr & {\rm{ 0,05}} \to {\rm{0,05 mol}} \cr & \to {{\rm{V}}_{KOH}} = {n \over {{C_M}}} = {{0,05} \over 2} = 0,25\left( l \right) = 25\left( {ml} \right) \cr} \) Đáp án C Câu 14: \(\eqalign{ & {n_{S{O_2}}} = 0,1mol;{n_{NaOH}} = 0,3mol \cr & \to {{{n_{NaOH}}} \over {{n_{S{O_2}}}}} = {{0,3} \over {0,1}} = 3 > 2 \cr} \) \( \Rightarrow \) sinh ra hai muối trung hòa và NaOH dư. Vậy dung dịch X gồm Na2SO3 và NaOH. Đáp án A Câu 19: Mg, Al, P cùng thuộc một chu kì \( \Rightarrow \) tính kim loại Mg > Al > P (1) Mg và Ca cùng thuộc một nhóm A \( \Rightarrow \) tính kim loại Mg < Ca (2) Từ (1) và (2) \( \Rightarrow \) tính kim loại của Ca > Mg > P. Đáp án A Câu 21: \(\eqalign{ & Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + {H_2}O \cr & 2{H_2}O\buildrel {dp} \over \longrightarrow 2{H_2} + {O_2} \cr & 2KCl{O_3}\mathrel{\mathop{\kern0pt\longrightarrow} \limits_{t^\circ }^{Mn{O_2}}} 2KCl + 3{O_2} \cr & 6C{O_2} + 6{H_2}O \to {C_6}{H_{12}}{O_6} + 6{O_2} \cr} \) Đáp án A Câu 22: (1)Iot tan nhiều trong ancol etylic tạo thành cồn iot để sát trùng: Đúng. (2)Số oxi hóa của N trong NH4+ và NH3 đều là -3: Đúng. (3) H2S là một khí độc, không màu, mùi trứng thối: Đúng. (4)Axit sunfuaric đặc có tính háo nước nên được sử dụng để làm khô một số khí như O2, CO2: Đúng. (5)Flo có thể tan trong nước tạo thành nước flo: Sai, vì flo có tính oxi hóa mạnh nên oxi hóa nước ngay ở nhiệt độ thường: \(2{F_2} + {H_2}O \to 4HF + {O_2}\) Do đó, không tạo được nước flo. (6)Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở nhiệt độ thường ta thu được clorua vôi: Sai, vì để tạo thành clorua vôi cần nhiệt độ cao. Các nhận định đúng là (1), (2), (3), (4) Đáp án D Câu 26: X thuộc nhóm VIIA \( \Rightarrow \) công thức hợp chất của X với hiđro là HX. \(\% X = \dfrac{{{M_X}}}{{{M_X} + 1}}.100 \) \(\Leftrightarrow 97,26 = \dfrac{{{M_X}}}{{{M_X} + 1}}.100\) \(\Rightarrow {M_X} = 35,5\) Vậy nguyên tố X cần tìm là clo (Cl) Đáp án B Câu 30: \(2N{O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_4}\left( k \right)\) Màu nâu đỏ không màu Khi tăng nhiệt độ, màu nâu đỏ nhạt dần chứng tỏ cân bằng chuyển dịch theo chiều thuận. Vậy chiều thuận là phản ứng thu nhiệt, \(\Delta H > 0\). Do đó phản ứng nghịch là phản ứng tỏa nhiệt, \(\Delta H < 0.\) Đáp án B HocTot.Nam.Name.Vn
|