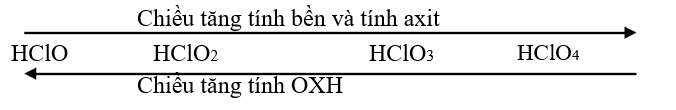
Đề cương ôn tập học kỳ II - Hóa học lớp 10Đề cương tóm tắt đầy đủ chương trình học kỳ II hóa 10 A. NHÓM HALOGEN I. Vị trí trong bảng HTTH các nguyên tố. + Gồm có các nguyên tố 9F 17Cl 35Br 53I 85At. + Thuộc nhóm VIIA, dễ nhận thêm một electron để đạt cấu hình bền vững của khí hiếm khi tham gia phản ứng hóa học => X + 1e → X- (X : F , Cl , Br , I ) + Phân tử dạng X2 như F2 khí màu lục nhạt, Cl2 khí màu vàng lục, Br2 lỏng màu nâu đỏ, I2 tinh thể tím + F có độ âm điện lớn nhất , chỉ có số oxi hoá –1. Các halogen còn lại ngoài số oxi hoá –1 còn có số oxi hoá dương như +1 , +3 , +5 , +7 II. CLO + Là chất khí, màu vàng , mùi xốc , độc và nặng hơn không khí. + Phân tử Cl2 có một liên kết cộng hóa trị, dễ dàng tham gia phản ứng hóa học. + Clo có tính oxh mạnh, tuy nhiên nó cũng thể hiện tính khử trong một số phản ứng hóa học 1.Tính chất hoá học a. Tác dụng với kim loại Clo tác dụng với hầu hết các kim loại tạo ra muối clorua (KL sau phản ứng có hóa trị cao nhất) 2Na + Cl2\(\xrightarrow{{{t}^{0}}}\) 2NaCl 2Fe + 3Cl2 \(\xrightarrow{{{t}^{0}}}\) 2FeCl3 Cu + Cl2 \(\xrightarrow{{{t}^{0}}}\) CuCl2 b. Tác dụng với phim kim (cần có nhiệt độ hoặc có ánh sáng) H2 + Cl2 \(\xrightarrow{{{t}^{0}}}\) 2HCl 2P + 3Cl2 \(\xrightarrow{{{t}^{0}}}\) 2PCl3 Cl2không tác dụng trực tiếp với O2. c. Tác dụng với một số hợp chất có tính khử: H2S + Cl2 → 2HCl + S 3Cl2 + 2NH3 → N2 + 6HCl Cl2 + SO2 + 2H2O → H2SO4 + 2HCl d. Cl2 còn tham gia phản ứng với vai trò vừa là chất oxh, vừa là chất khử. + Tác dụng với nước : Khi hoà tan vào nước , một phần Clo tác dụng (Thuận nghịch) Cl2 + H2O \(\rightleftarrows \)HCl + HClO( Axit hipoclorơ) Axit hipoclorơ có tính oxy hoá mạnh, nó phá hủy các màu vì thế nước clo hay clo ẩm có tính tẩy màu. + Tác dụng với dung dịch bazơ Cl2 + 2NaOH → NaCl + NaClO + H2O ( nước javel) 2Cl2 + 2Ca(OH)2 → Ca(ClO)2 + CaCl2 + H2O 3Cl2 + 6KOH \(\xrightarrow{{{t}^{0}}}\) KClO3 + 5KCl + 3H2O + Tác dụng với muối Cl2+ 2NaBr → 2NaCl + Br2 3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3 2.Điều chế : Nguyên tắc là khử các hợp chất Cl- tạo Cl0 a. Trong phòng thí nghiệm: Cho HCl đậm đặc tác dụng với các chất oxh mạnh 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O 2NaCl+2H2O\(\xrightarrow{dp\text{dd}/cmn}\) 2NaOH + Cl2 + H2 2NaCl \(\xrightarrow{dpnc}\)2Na+ Cl2 b. Trong công nghiệp: Điện phân dung dịch NaCl bão hòa có màng ngăn III. AXIT CLOHIDRIC (HCl) : Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh 1. Tính chất hóa học a. Tác dụng chất chỉ thị Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit) b. Tác dụng kim loại (đứng trước H trong dãy hoạt động hóa học) sinh ra muối (với hóa trị thấp của kim loại) và giải phóng khí H2 Fe + 2HCl → FeCl2 + H2 Cu không tác dụng với HCl c. Tác dụng oxit bazơ , bazơ tạo muối và nước NaOH HCl → NaCl + H2O d. Tác dụng muối (theo điều kiện phản ứng trao đổi) CaCO3 + 2HCl → CaCl2 + H2O + CO2 AgNO3 + HCl → AgCl + HNO3 ( dùng để nhận biết gốc clorua ) Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4 , MnO2 …… 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O 2. Điều chế Phương pháp sunfat: Cho NaCl tinh thể vào H2SO4 đặc 2NaCltt + H2SO4 \(\xrightarrow{{{t}^{0}}>{{400}^{0}}C}\) Na2SO4 + 2HCl NaCltt + H2SO4 \(\xrightarrow{{{t}^{0}}<{{250}^{0}}C}\) NaHSO4 + HCl Phương pháp tổng hợp: Cho hidro tác dụng với clo H2 + Cl2 \(\xrightarrow{as}\) HCl IV. MUỐI CLORUA Chứa ion âm clorua (Cl-) và các ion dương kim loại Một số muối clorua thông dụng: + NaCl dùng để ăn, sản xuất khí clo, NaOH, axit HCl + KCl phân kali + ZnCl2 tẩy gỉ khi hàn, chống mục gổ + CaCl2 chất chống ẩm V. HỢP CHẤT CHỨA OXI CỦA CLO NƯỚC JAVEN là hỗn hợp gồm NaCl, NaClO và H2O có tính ôxi hóa mạnh, có tính tẩy màu, được điều chế bằng cách dẫn khí Clo vào dung dịch NaOH (KOH) Cl2 + 2NaOH → NaCl + NaClO + H2O NaClO + CO2 + H2O → NaHCO3 + HClO ( có tính tẩy màu) (Cl2 + 2KOH →KCl + KClO + H2O) 2.KALI CLORAT công thức phân tử KClO3 là chất oxh mạnh thường dùng điều chế O2 trong phòng thí nghiệm 2KClO3 \(\xrightarrow{{{t}^{0}}}\)2KCl + O2 KClO3 được điều chế khi dẫn khí clo vào dung dịch kiềm đặc đã được đun nóng đến 1000c 3Cl2 + 6KOH \(\xrightarrow{{{t}^{0}}}\) 5KCl + KClO3 + 3H2O 3.CLORUA VÔI là muối hỗn tạp công thức phân tử CaOCl2 là chất oxh mạnh, được điều chế bằng cách dẫn clo vào dung dịch Ca(OH)2 đặc: Cl2 + Ca(OH)2(đ) → CaOCl2 + H2O 2Ca(OH)2(l) + 2Cl2 → CaCl2 + Ca(OCl)2 + 2H2O 5. MỘT SỐ AXIT CÓ CHỨA NGUYÊN TỬ CLO HClO: axit hipo cloro HClO2: axit cloro HClO3: axit cloric HClO4: axit pecloric VI. FLO là chất OXH mạnh, tham gia phản ứng với các kim loại và hợp chất 1. Hoá tính a.Tác dụng với kim loại và phi kim Ca + F2 → CaF2 2Ag + F2 → 2AgF 3F2 + 2Au → 2AuCl3 3F2+ S → SF6 b.Tác dụng với hidro Phản ứng xảy ra mạnh hơn các halogen khác. Hỗn hợp H2 ,F2 nổ mạnh trong bóng tối H2 + F2 → 2HF Khí HF tan vào nước tạo dung dịch HF. Dung dịch HF là axit yếu, đặc biệt là hòa tan được SiO2 4HF + SiO2 →2H2O + SiF4 (sự ăn mòn thủy tinh được ứng dụng trong kĩ thuật khắc trên kính như vẽ tranh khắc chữ). c.Tác dụng với nước Khí flo qua nước sẽ làm bốc cháy nước (do giải phóng O2). 2F2 + 2H2O → 4HF + O2 Phản ứng này giải thích vì sao F2 không đẩy Cl2 , Br2 , I2 ra khỏi dung dịch muối hoặc axit trong khi flo có tính oxh mạnh hơn . 2.Điều chế HF bằng phương pháp sunfat CaF2(tt) + H2SO4(đđ) → CaSO4 + 2HF VII. BROM VÀ IOT 1.Tác dụng với kim loại 2Na + Br2→2NaBr 2Na + I2 → 2NaI 2.Tác dụng với hidro H2 + Br2 →2HBr H2+I2 ↔ 2HI (phản ứng thuận nghịch) HBr, HI tan trong nước tạo thành dung dịch axit Tính axit : HI > HBr > HCl
VIII. NHẬN BIẾT dùng Ag+ (AgNO3) để nhận biết các gốc halogenua B. NHÓM OXI - LƯU HUỲNH I. OXI 1. Đơn chất oxi - Nằm ở ô số 8, chu kì 2, nhóm VI A - CTPT : O = O => Là một phi kim điển hình, có tính OXH mạnh (độ âm điện chỉ sau F) * Tính chất vật lý Là chất khí, không màu, không mùi, không tan trong nước, nặng hơn không khí. Duy trì sự sống và sự cháy. * Tính chất hóa học +, Tác dụng với hầu hết kim loại (trừ Au, Pt) tạo ra oxit kim loại +, T/d với hidro: H2 + O2 → H2O +, Tác dụng với phi kim khác: S + O2 → SO2 +, Tác dụng với một số hợp chất: 2O2 + CH4 → CO2 + 2H2O * Vai trò : Duy trì sự sống cho động, thực vật * Điều chế: +, Trong PTN: KMnO4 \(\xrightarrow{{{t}^{0}}}\) K2MnO4 + MnO2 + O2 +, Trong CN: - Chưng cất phân đoạn không khí lỏng. - Điện phân nước có mắt chất điện li +, Trong tự nhiên 6CO2 + 6H2O \(\xrightarrow[xt]{as}\) C6H12O6 + 6O2 2. Ozon - CTPT: O3 * Tính chất vật lý Là chất khí, ở thể lỏng có màu xanh nhạt, tan tốt trong nước hơn so với oxi * Tính chất hóa học Ozon có tính oxh mạnh hơn so với O2 Một số phản ứng hóa hoc chứng minh điều này: O3 + 2Ag → Ag2O + O2 O3 + 2KI + H2O → I2 + 2KOH + O2 * Ứng dụng - Khử trùng nước, chữa sâu răng, tẩy trắng,... II. LƯU HUỲNH 1. Đơn chất lưu huỳnh (S) * Tính chất vật lý - Là chất rắn, màu vàng có 2 dạng thù hình chính: Tà phương và đơn tà - Không tan trong nước nhưng tan trong dung môi hữu cơ, có nhiệt độ sôi và nhiệt độ nóng chảy khá cao * Tính chất hóa học Là một phi kim trung bình. S đơn chất có số OXH = 0 => S vừa có tính khử và tính OXH +, Tính khử: Tác dụng với phi kim: S + O2→ SO2 S + 3F2 → SF6 +, Tính OXH: Tác dụng với H2 và kim loại Hg + S → HgS Fe + S \(\xrightarrow{{{t}^{0}}}\)FeS H2 + S \(\xrightarrow{{{t}^{0}}}\) H2S 2. Hidro sunfua và axit sunfuhidric * Tính chất vật lý: Là chất khí, không màu, có mùi trứng thối, nặng hơn không khí. * Tính chất hóa học: - Axit sunfuhidric là một axit yếu, nó mang đầy đủ tính chất của 1 axit +, Làm quỳ tím chuyển sang màu hồng +, tác dụng với bazơ => muối + nước H2S + NaOH → NaHS + H2O H2S + 2NaOH → Na2S + 2H2O +, Tác dụng với dung dịch muối H2S + CuCl2 → CuS + 2HCl - Axit sunfuhidric có tính khử mạnh +, Tác dụng với chất có tính OXH mạnh 2H2S + O2 → 2S + 2H2O (phản ứng thiếu oxi hoặc ở nhiệt độ thường) 2H2S + 3O2 → 2SO2 + 2H2O (phản ứng dư oxi) H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl * Trạng thái tự nhiên: Có trong nước suối, khí núi lửa, xác chết người, động vật 3. Lưu huỳnh dioxit * Tính chất vật lý: Là chất khí, không màu, mùi hắc, rất độc * Tính chất hóa học: Là một oxit axit => Mang đầy đủ tính chất của một oxit axit - SO2 tác dụng với nước, bazơ và oxit bazơ SO2 + H2O → H2SO3 SO2 + NaOH → NaHSO3 SO2 + 2 NaOH → Na2SO3 + H2O SO2 + CaO → CaSO3 - Vừa có tính khử, vừa có tính oxi hóa Tính khử: SO2 + Cl2 + H2O → H2SO4 + HCl Tính oxi hóa: SO2 + H2S → S + H2O 4. Lưu huỳnh trioxit Tính chất vật lý: Là chất lỏng, không màu, tan vô hạn trong nước và axit sunfuric Tính chất hóa học: Lưu huỳnh trioxit là một oxit axit điển hình Một số phản ứng hóa học: SO3 + H2O → H2SO4 SO3 + CaO → CaSO4 SO3 + 2 NaOH → Na2SO4 + H2O 5. Axit sunfuric * Tính chất vật lý: Là chất lỏng sánh, không màu, không bay hơi, rất háo nước, tan vô hạn trong nước * Tính chất hóa học a) H2SO4 loãng mang đầy đủ tính chất của một axit thông thường - Làm quỳ tím chuyển thành đỏ - Tác dụng với kim loại hoạt động → giải phóng H2 H2SO4 + Fe → FeSO4 + H2 H2SO4 + Cu (không phản ứng) - Tác dụng với bazơ, oxit bazơ → Muối + nước H2SO4 + CuO → CuSO4 + H2O H2SO4 + Cu(OH)2 → CuSO4 + 2H2O - Tác dụng với muối → Muối mới và axit mới H2SO4 + CaCO3 → CaSO4 + H2O + CO2 b) H2SO4 đặc có một số tính chất đặc trưng - Tính oxi hóa mạnh: Tác dụng hầu hết các kim loại (Trừ Au, Pt) và nhiều phi kim SO2, S, H2S Cu +2H2SO4(đ)→ CuSO4 + SO2 + 2H2O - Tính háo nước: Chiếm nước của nhiều muối kết tinh, phân hủy nhiều hợp chất hữu cơ chứa O, H CuSO4.5H2O \(\xrightarrow{{{H}_{2}}S{{O}_{4(đ)}}}\) CuSO4 + 5H2O C6H12O6 \(\xrightarrow{{{H}_{2}}S{{O}_{4(đ)}}}\) 6C + 6H2O c) Sản xuất H2SO4: Bằng phương pháp tiếp xúc gồm 3 giai đoạn - Sản xuất SO2: S + O2 → SO2 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 - Sản xuất SO3: - Sản xuất H2SO4 nSO3 + H2SO4(98%) → H2SO4.nSO3 (oleum) H2SO4.nSO3 + nH2O → (n+1)H2SO4 d) Chú ý - H2SO4 loãng: ion H+ đóng vai trò chất oxi hóa giải phóng H2 . Kim loại đạt số oxh thấp. - H2SO4 đặc: * S đóng vai trò chất oxi hóa nên không giải phóng H2. Kim loại đạt số oxh cao. * Sau phản ứng tạo SO2, S, H2S. Kim loại càng mạnh, S có số oxh càng thấp. * Kim loại sau H, chỉ tạo ra SO2. - Al, Fe, Cr bị thụ động trong H2SO4 đặc nguội. Nguồn: Sưu tầm HocTot.Nam.Name.Vn
|
|||||