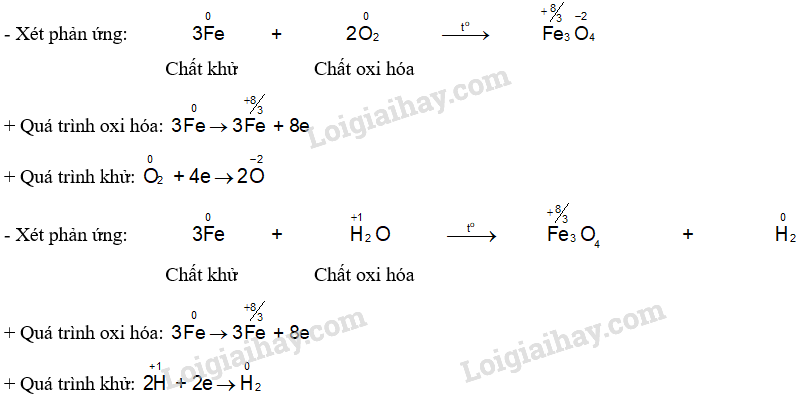Bài 16. Hợp kim và sự ăn mòn kim loại trang 85, 86, 87 Hóa 12 Chân trời sáng tạoThiết bị, vật dụng, công trình làm bằng kim loại thường bị hư hỏng
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 85 MĐ Trả lời câu hỏi Mở đầu trang 85 SGK Hóa 12 Chân trời sáng tạo Thiết bị, vật dụng, công trình làm bằng kim loại thường bị hư hỏng sau một thời gian do sự ăn mòn kim loại.Tuy nhiên, nếu hiểu rõ nguyên nhân của quá trình ăn mòn kim loại, con người có thể giảm thiểu tác động của quá trình ăn mòn. Ăn mòn kim loại là gì? Làm thế nào để chống ăn mòn kim loại? Phương pháp giải: Nêu khái niệm ăn mòn kim loại, cách phòng chống ăn mòn kim loại. Lời giải chi tiết: - Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường. Có hai loại ăn mòn chính: ăn mòn hoá học và ăn mòn điện hoá. - Có hai phương pháp thường dùng để chống ăn mòn kim loại: phương pháp bảo vệ bề mặt và phương pháp điện hoá. CH tr 85 TL Trả lời câu hỏi Thảo luận trang 85 SGK Hóa 12 Chân trời sáng tạo Hãy kể tên một số hợp kim thường gặp trong cuộc sống. Phương pháp giải: Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. Hợp kim có nhiều tính chất cơ học, tính chất vật lí vượt trội so với kim loại, ngày càng được sử dụng phổ biến trong các ngành kinh tế quốc dân. Lời giải chi tiết: Các hợp kim thường gặp: - Hợp kim của sắt như gang, thép, inox,… - Hợp kim của nhôm như dural,… CH tr 86 TL1 Trả lời câu hỏi Thảo luận 1 trang 86 SGK Hóa 12 Chân trời sáng tạo Nêu một số ví dụ về tính chất của hợp kim mà em biết. Phương pháp giải: Tính chất của hợp kim phụ thuộc vào thành phần của nó. Nhiều hợp kim rất bền dù ở nhiệt độ cao, ít bị ăn mòn; hợp kim thường cứng hơn các đơn chất thành phần; độ dẫn điện, dẫn nhiệt của hợp kim thường kém hơn độ dẫn điện, dẫn nhiệt của đơn chất thành phần;... Lời giải chi tiết: - Tính chất hóa học của hợp kim tương tự như tính chất hóa học của các đơn chất thành phần. - Hợp kim còn có các tính chất khác hơn so với các đơn chất thành phần như bền dù ở nhiệt độ cao, ít bị ăn mòn; cứng hơn; độ dẫn điện, dẫn nhiệt của hợp kim thường kém hơn;... CH tr 86 TL2 Trả lời câu hỏi Thảo luận 2 trang 86 SGK Hóa 12 Chân trời sáng tạo Hãy so sánh thành phần, tính chất và ứng dụng của gang và thép. Phương pháp giải: - Gang là hợp kim của Fe và C, trong đó C chiếm khoảng từ 2% - 5% về khối lượng. Trong gang có một lượng nhỏ các nguyên tố khác như: Si, S, Mn, P,... - Thép là hợp kim của Fe và C, trong đó C chiếm dưới 2% về khối lượng. Trong thép còn có thể có một số nguyên tố khác như: Si, Mn, Cr, Ni,... Lời giải chi tiết:
CH tr 87 Trả lời câu hỏi Thảo luận trang 87 SGK Hóa 12 Chân trời sáng tạo Hãy tìm hiểu và cho biết các yếu tố nào có thể gây nên sự ăn mòn kim loại. Cho biết bản chất của quá trình này. Phương pháp giải: Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường. Có hai loại ăn mòn chính: ăn mòn hoá học và ăn mòn điện hoá. Lời giải chi tiết: - Các yếu tố gây nên sự ăn mòn kim loại: hơi nước, khí oxygen, acid có trong nước mưa, không khí ẩm, muối có trong nước biển,… - Bản chất của quá trình ăn mòn là quá trình oxi hóa khử, trong đó kim loại là chất bị oxi hóa. CH tr 88 TL1 Trả lời câu hỏi Thảo luận 1 trang 88 SGK Hóa 12 Chân trời sáng tạo Xác định chất oxi hoá, chất khử trong các phản ứng ở Ví dụ 2. Viết quá trình oxi hoá, quá trình khử của các phản ứng đó. Phương pháp giải: Trong phản ứng oxi hóa khử: + Chất khử có số oxi hóa tăng, chất oxi hóa có số oxi hóa giảm. + Chất khử thực hiện quá trình oxi hóa, chất oxi hóa thực hiện quá trình khử. Lời giải chi tiết:
CH tr 88 TL2 Trả lời câu hỏi Thảo luận 2 trang 88 SGK Hóa 12 Chân trời sáng tạo Tiến hành Thí nghiệm 1, nêu hiện tượng xảy ra khi chưa nối dây dẫn điện và sau khi nối dây dẫn. Phương pháp giải: Khi chưa nối dây dẫn, thanh sắt bị hoà tan trong dung dịch H2SO4. Khi nối dây dẫn giữa thanh sắt và thanh đồng đã hình thành một pin điện hoá. Lời giải chi tiết: - Khi chưa nối dây dẫn, thanh sắt bị hoà tan trong dung dịch H2SO4, xuất hiện bọt khí H2 thoát ra ở bề mặt thanh sắt. - Khi nối dây dẫn giữa thanh sắt và thanh đồng, sắt bị ăn mòn nhanh hơn trong dung dịch H2SO4, xuất hiện bọt khí H2 thoát ra ở bề mặt thanh sắt và thanh đồng, đèn sáng. CH tr 88 TL3 Trả lời câu hỏi Thảo luận 3 trang 88 SGK Hóa 12 Chân trời sáng tạo Xác định các quá trình oxi hoá, quá trình khử xảy ra ở Thí nghiệm 1. Phương pháp giải: Chất khử thực hiện quá trình oxi hóa, chất oxi hóa thực hiện quá trình khử. Lời giải chi tiết: + Quá trình oxi hóa: \({\rm{Fe}} \to {\rm{F}}{{\rm{e}}^{2 + }}{\rm{ + 2e}}\) + Quá trình khử: \({\rm{2}}{{\rm{H}}^ + }{\rm{ + 2e}} \to {{\rm{H}}_{\rm{2}}}\) CH tr 88 LT Trả lời câu hỏi Luyện tập trang 88 SGK Hóa 12 Chân trời sáng tạo Một sợi dây đồng được nối với một dây nhôm. Có hiện tượng gì xảy ra ở chỗ nối của hai kim loại khi để lâu ngoài không khí ẩm? Giải thích. Phương pháp giải: - Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá. - Điều kiện xảy ra ăn mòn điện hoá: Hai kim loại khác nhau (hoặc kim loại và phi kim) tiếp xúc trực tiếp hoặc gián tiếp với nhau thông qua dây dẫn và cùng tiếp xúc với một dung dịch chất điện li. Lời giải chi tiết: - Sau một thời gian để trong không khí ẩm sợi đây bị đứt ở chỗ nối bên nhôm. - Giải thích: ở vị trí nối hai kim loại, nhôm bị ăn mòn điện hóa. Khi nhôm và đồng tiếp xúc trực tiếp với nhau và cùng tiếp xúc với không khí ẩm, hiện tượng ăn mòn điện hóa xuất hiện. + Nhôm đóng vai trò là anode (-): \({\rm{Al}} \to {\rm{A}}{{\rm{l}}^{3 + }}{\rm{ + 3e}}\) + Đồng đóng vai trò là cathode (+): \({{\rm{O}}_2} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} + 4{\rm{e}} \to 4{\rm{O}}{{\rm{H}}^ - }\) Kết quả của hiện tượng này là nhôm bị ăn mòn ở vị trí tiếp xúc với đồng, làm sợi dây bị đứt. CH tr 89 TL Trả lời câu Thảo luận trang 89 SGK Hóa 12 Chân trời sáng tạo Thực hiện trước Thí nghiệm 2 ở nhà và nêu hiện tượng xảy ra. Giải thích. Phương pháp giải: Phương pháp điện hoá được thực hiện bằng cách nối kim loại cần được bảo vệ với một kim loại hoạt động hoá học mạnh hơn để tạo thành pin điện hoá. Khi đó, kim loại có tính khử mạnh hơn bị ăn mòn, kim loại có tính khử yếu hơn được bảo vệ. Lời giải chi tiết:
CH tr 89 VD Trả lời câu Vận dụng trang 89 SGK Hóa 12 Chân trời sáng tạo Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn các khối kẽm vào phía ngoài vỏ tàu ở phần chìm trong nước biển. Hãy giải thích. Phương pháp giải: Phương pháp điện hoá được thực hiện bằng cách nối kim loại cần được bảo vệ với một kim loại hoạt động hoá học mạnh hơn để tạo thành pin điện hoá. Khi đó, kim loại có tính khử mạnh hơn bị ăn mòn, kim loại có tính khử yếu hơn được bảo vệ. Lời giải chi tiết: Thành phần chính của thép là Fe, khi gắn Zn vào vỏ tàu sẽ tạo thành cặp điện cực Zn – Fe. Hai điện cực tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dung dịch điện li (nước biển) nên xảy ra hiện tượng ăn mòn điện hóa. Trong đó, kẽm có tính khử mạnh hơn nên bị ăn mòn, do đó vỏ tàu được bảo vệ. CH tr 90 BT1 Trả lời câu Bài tập 1 trang 90 SGK Hóa 12 Chân trời sáng tạo Phân biệt ăn mòn hoá học và ăn mòn điện hoá. Phương pháp giải: Ăn mòn hoá học là quá trình oxi hoá - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá. Lời giải chi tiết:
CH tr 90 BT2 Trả lời câu Bài tập 2 trang 90 SGK Hóa 12 Chân trời sáng tạo Ăn mòn điện hoá các hợp kim của sắt (gang, thép) trong không khí ẩm ảnh hưởng lớn đối với nền kinh tế của các quốc gia. Hãy giải thích quá trình ăn mòn này. Phương pháp giải: - Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá. - Điều kiện xảy ra ăn mòn điện hoá: Hai kim loại khác nhau (hoặc kim loại và phi kim) tiếp xúc trực tiếp hoặc gián tiếp với nhau thông qua dây dẫn và cùng tiếp xúc với một dung dịch chất điện li. Lời giải chi tiết: Gang, thép là hợp kim Fe – C và một số nguyên tố khác. Không khí ẩm có hoà tan khí CO2, O2,... tạo ra lớp dung dịch chất điện li phủ lên bề mặt gang, thép, làm xuất hiện vô số pin điện hoá mà Fe là cực âm, C là cực dương – Ở cực âm xảy ra sự oxi hoá : \({\rm{Fe}} \to {\rm{F}}{{\rm{e}}^{2 + }}{\rm{ + 2e}}\) – Ở cực dương xảy ra sự khử : \({{\rm{O}}_2} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} + 4{\rm{e}} \to 4{\rm{O}}{{\rm{H}}^ - }\) Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khí oxygen và tiếp tục bị oxi hóa tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O. CH tr 90 BT3 Trả lời câu Bài tập 3 trang 90 SGK Hóa 12 Chân trời sáng tạo Một vật bằng sắt tây (sắt tráng thiếc) bị xây xát chạm tới lớp sắt bên trong. Nêu hiện tượng xảy ra khi để vật này lâu trong không khí ẩm. Giải thích. Phương pháp giải: - Ăn mòn điện hoá là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá. - Điều kiện xảy ra ăn mòn điện hoá: Hai kim loại khác nhau (hoặc kim loại và phi kim) tiếp xúc trực tiếp hoặc gián tiếp với nhau thông qua dây dẫn và cùng tiếp xúc với một dung dịch chất điện li. Lời giải chi tiết: - Khi để lâu vật này trong không khí ẩm thì xuất hiện gỉ sắt vì sắt bị ăn mòn điện hóa. - Giải thích: hai kim loại Sn – Fe cùng không khí ẩm có hoà tan khí CO2, O2,... tạo ra lớp dung dịch chất điện li phủ lên bề mặt lớp sắt tây bị xây xát chạm tới sắt. Pin điện hóa xuất hiện với cực dương là Sn và cực âm là Fe. + Ở cực âm xảy ra sự oxi hoá : \({\rm{Fe}} \to {\rm{F}}{{\rm{e}}^{2 + }}{\rm{ + 2e}}\) + Ở cực dương xảy ra sự khử : \({{\rm{O}}_2} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} + 4{\rm{e}} \to 4{\rm{O}}{{\rm{H}}^ - }\) Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khí oxygen và tiếp tục bị oxi hóa tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O.
>> Lộ Trình Sun 2025 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi TN THPT & ĐGNL; ĐGTD - Click xem ngay) tại Tuyensinh247.com. Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|