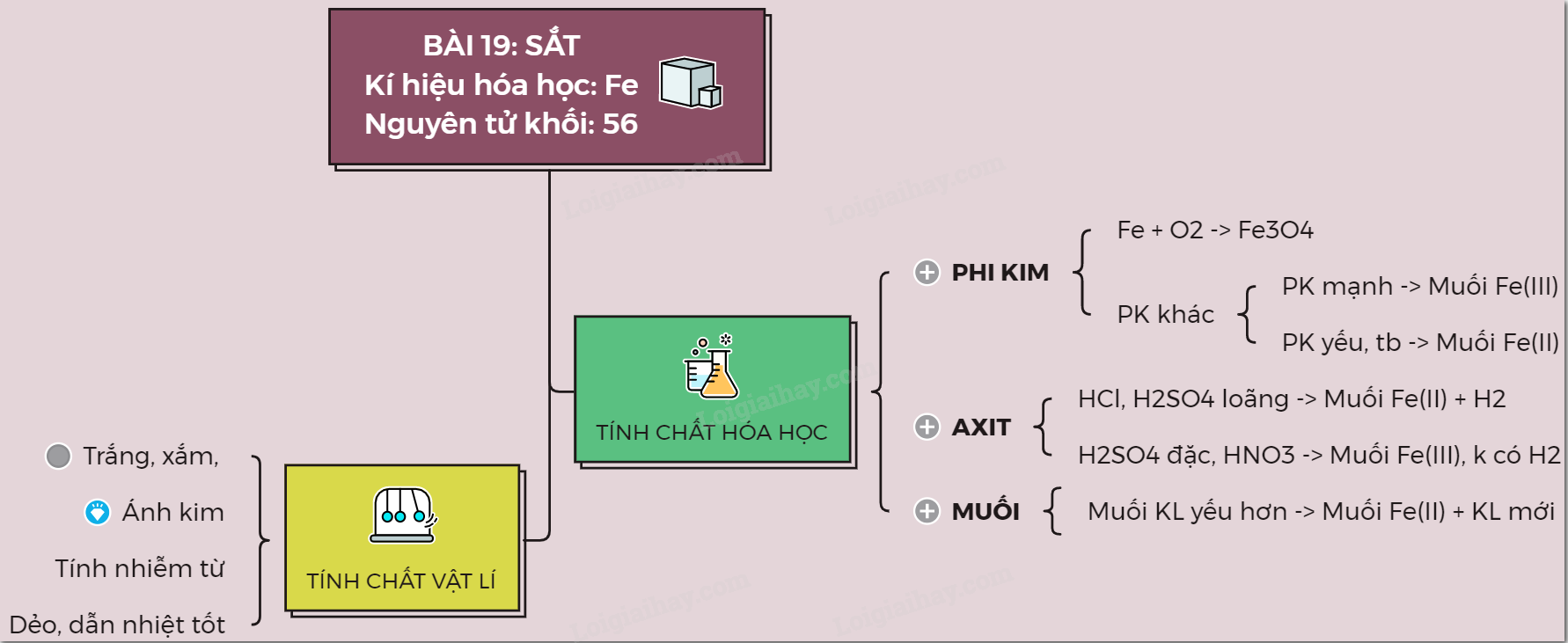
Lý thuyết về sắtI. TÍNH CHẤT VẬT LÍ I. TÍNH CHẤT VẬT LÍ: - Sắt là kim loại, màu trắng xám, có tính dẻo, ánh kim, dẫn điện, dẫn nhiệt tốt nhưng kém nhôm - Sắt có tính nhiễm từ (bị nam châm hút) - Sắt là kim loại nặng, khối lượng riêng 7,86g/cm3, nóng chảy ở nhiệt độ 15390C II. TÍNH CHẤT HÓA HỌC: Sắt là kim loại có hai hóa trị là II và III. 1. Tác dụng với phi kim a) Tác dụng với oxi. 3Fe + 2O2 $\xrightarrow{{{t}^{o}}}$ Fe3O4 (oxit sắt từ, là oxit hỗn hợp: FeO.Fe2O3) b) Tác dụng với phi kim khác. - Tác dụng với Cl2 tạo muối sắt (III): 2Fe + 3Cl2 $\xrightarrow{{{t}^{o}}}$ 2FeCl3 - Tác dụng với S tạo muối sắt (II): Fe + S $\xrightarrow{{{t}^{o}}}$ FeS Ngoài oxi và lưu huỳnh, sắt có thể tác dụng được với nhiều phi kim khác như Cl2, Br2,… tạo thành muối 2. Tác dụng với dung dịch axit - Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng H2. Fe + 2HCl → FeCl2 + H2 Fe bị thụ động hóa trong axit HNO3 đặc nguội và axit H2SO4 đặc nguội do tạo ra lớp oxit bảo vệ, ngăn cản kim loại tác dụng với axit - Sắt tác dụng với HNO3 đặc nóng, H2SO4 đặc nóng tạo thành muối sắt III, không giải phóng H2 Fe + H2SO4 đặc $\xrightarrow{{{t}^{o}}}$ Fe2(SO4)3 + 3SO2 + 6H2O Fe + 6HNO3 đặc $\xrightarrow{{{t}^{o}}}$ Fe(NO3)3 + 3NO2 + H2O 3. Tác dụng với dung dịch muối - Sắt tác dụng với dung dịch muối của những kim loại kém hoạt động hơn, tạo thành dung dịch muối sắt và giải phóng kim loại trong muối Fe + CuSO4 → FeSO4 + Cu Sơ đồ tư duy: Sắt
|