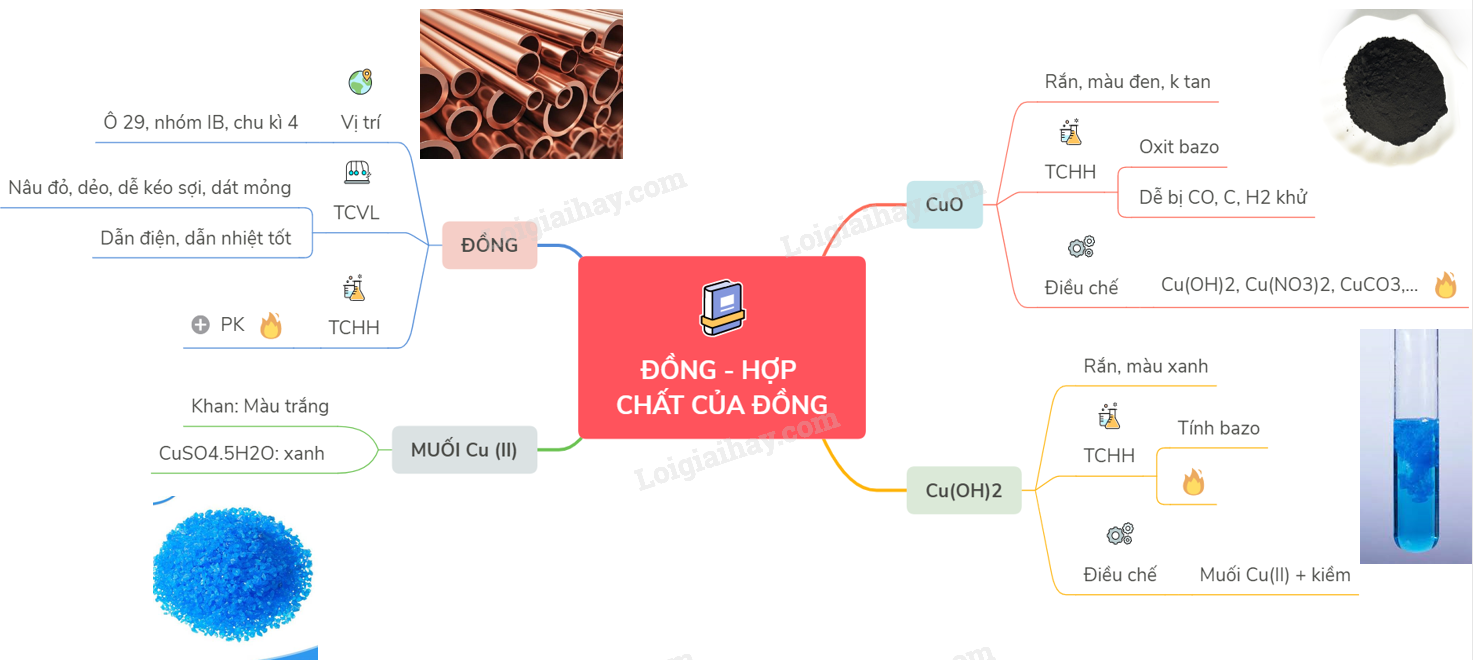
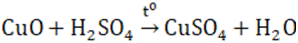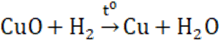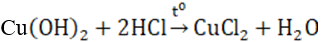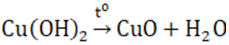Lý thuyết về đồng và hợp chất của đồngĐồng thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29. A. ĐỒNG I. VỊ TRÍ VÀ CẤU TẠO - Đồng thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29. - Cấu hình electron nguyên tử của Cu : [Ar] 3d104s1 ; Cu+ : [Ar] 3d10 ; Cu2+ :[Ar] 3d9 . II. TÍNH CHẤT VẬT LÍ Là kim loại màu nâu đỏ, khối lượng riêng lớn, dẻo, dễ kéo sợi và dát mỏng, dẫn điện, dẫn nhiệt tốt (chỉ kém hơn bạc). III. TÍNH CHẤT HÓA HỌC Tác dụng với phi kim - Khi đốt nóng: 2Cu + O2 \(\xrightarrow{{{t^o}}}\) 2CuO Cu tác dụng với Cl2, Br2, S, ... ở nhiệt độ thường hoặc đun nóng: Cu + Cl2 → CuCl2 (đồng clorua) B. MỘT SỐ HỢP CHẤT CỦA ĐỒNG I. ĐỒNG (II) OXIT - CuO: là chất rắn màu đen, không tan trong nước - Là oxit bazơ; dễ bị CO, C, H2 khử thành Cu kim loại
- Điều chế bằng cách nhiệt phân Cu(OH)2, Cu(NO3)2, CuCO3,… II. ĐỒNG (II) HIDROXIT - Cu(OH)2 : là chất rắn màu xanh - Có tính bazơ, không tan trong nước nhưng tan dễ trong dung dịch axit
- Dễ bị nhiệt phân sinh ra CuO
- Điều chế từ dung dịch muối đồng (II) và dung dịch bazơ. III. MUỐI ĐỒNG (II) - CuSO4dạng khan là chất rắn màu trắng, trạng muối hiđrat CuSO4.5H2O có màu xanh. - Ứng dụng: + Trên 50% sản lượng dùng làm dây dẫn điện và trên 30% dùng làm hợp kim; hợp kim của đồng như đồng thau (Cu – Zn) ; đồng bạch (Cu–Ni) ; đồng thanh (Cu – Sn) ;… có rất nhiều ứng dụng trong công nghiệp và đời sống như: chế tạo chi tiết máy, thiết bị dùng trong công nghiệp đóng tàu biển + CuSO4 dùng trong nông nghiệp để chữa mốc sương cho cà chua, khoai tây; ở dạng khan thì dùng để phát hiện vết nước trong các chất lỏng Sơ đồ tư duy: Đồng và hợp chất của đồng HocTot.Nam.Name.Vn
|