Lý thuyết Sự biến đổi tuần hoàn cầu hình electron nguyên tử của các nguyên tố hóa họcSau mỗi chu kì, I. SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ - Từ bảng tuần hoàn các nguyên tố ta thấy, đầu chu kì nguyên tố có cấu hình electron là ns1, cuối mỗi chu kì nguyên tố có cấu hình electron là ns2np6 => Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lặp lại sau mỗi chu kì => Chúng biến đổi một cách tuần hoàn. => Chính sự biến đổi tuần hoàn electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố. II. CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A - Số thứ tự nhóm = số electron hóa trị = số electron lớp ngoài cùng. - Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. 1. Nhóm IA (Nhóm Kim Loại kiềm) - Gồm các nguyên tố: Li, Na, K, Rb, Cs, Fr - Cấu hình e lớp ngoài cùng chung: ns1 ⇒ Dễ nhường 1 electron để đạt cấu trúc bền vững của khí hiếm. - Tính chất hoá học: + Tác dụng với oxi tạo oxít bazơ + Tác dụng với Phi kim tạo muối + Tác dụng với nuớc tạo hiđroxít + H2 2. Nhóm VIIA (Nhóm Halogen) - Gồm các nguyên tố: F, Cl, Br, I, At - Cấu hình e lớp ngoài cùng chung: ns2np5 ⇒ Dễ nhận 1 electron để đạt cấu trúc bền vững của khí hiếm. - Tính chất hoá học: + Tác dụng với oxi tạo oxít axít + Tác dụng với kim loại tạo muối + Tác dụng với H2 tạo hợp chất khí. 3. Nhóm VIIIA (Nhóm khí hiếm) - Gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn - Cấu hình e lớp ngoài cùng chung: ns2np6 (trừ He) - Hầu hết các khí hiếm không tham gia phản ứng hoá học, tồn tại ở dạng khí, phân tử chỉ 1 nguyên tử. III. Cấu hình electron nguyên tử của các nguyên tố nhóm BCác nguyên tố nhóm B: nguyên tố d và f (còn gọi là các kim loại chuyển tiếp) - Cấu hình electron nguyên tử có dạng : (n–1)dans2 - Số electron hóa trị = số electron lớp n + số electron phân lớp (n–1)d nhưng chưa bão hòa. Đặt S = a + 2 , ta có : + S ≤ 8 thì S = số thứ tự nhóm. + 8 ≤ S ≤ 10 thì nguyên tố ở nhóm VIII B. Sơ đồ tư duy: Sự biến đổi tuần hoàn cầu hình electron nguyên tử của các nguyên tố hóa học 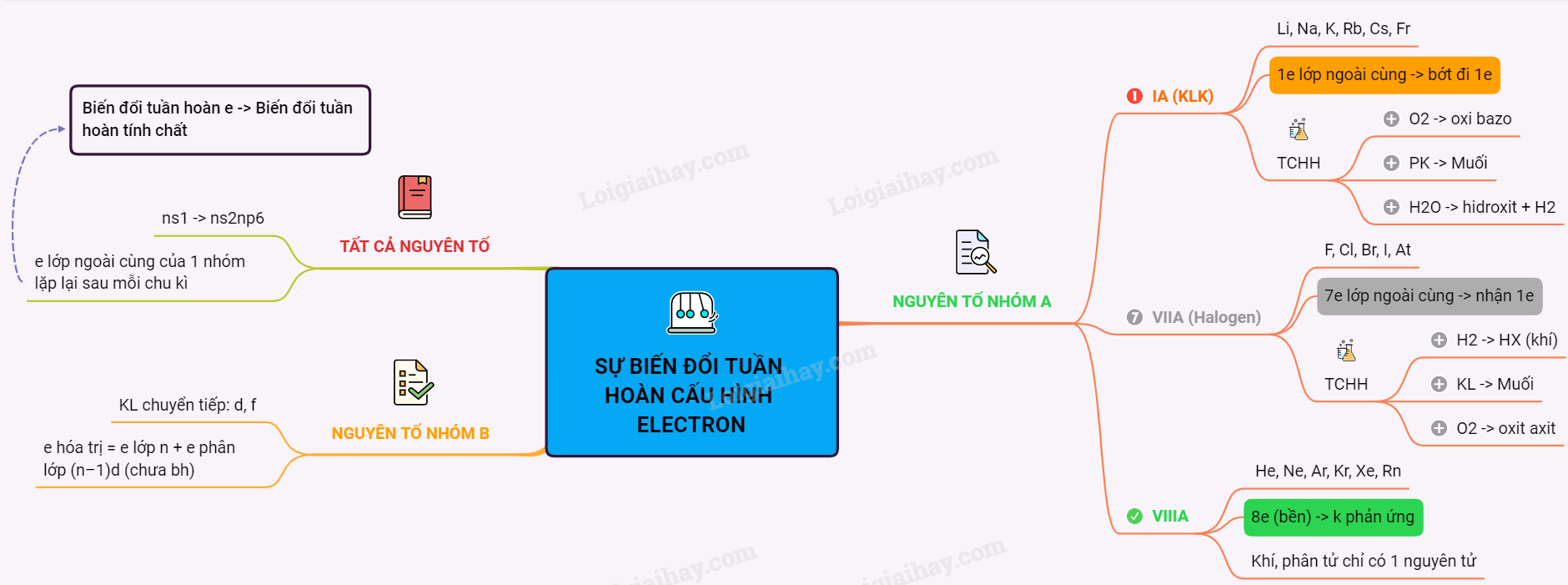 HocTot.Nam.Name.Vn
|













