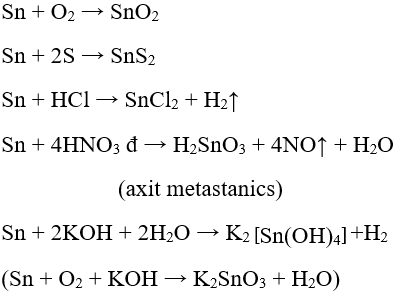Lý thuyết sơ lược về Niken, Kẽm, Chì, ThiếcNiken thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28. I. NIKEN - Thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28. - Cấu hình electron nguyên tử : [Ar]3d84s2. - Thường có số oxi hóa +2 trong các hợp chất. 1. Tính chất của Niken - Tính chất vật lý: là kim loại có màu trắng bạc, rất cứng, khối lượng riêng lớn, nóng chảy ở 1455 độ C - Có tính khử yếu : tác dụng với phi kim ở nhiệt độ cao; tác dụng với dung dịch axit; tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường. Ni + 4HNO3 (đặc, nóng) → Ni(NO3)2 + 2NO2 + 2H2O 2. Ứng dụng của Niken - Niken: hơn 80% lượng Ni sản xuất được dùng trong ngành luyện kim - Ngoài ra Ni còn được dùng: mạ lên sắt để làm đẹp, chống gỉ và còn được dùng làm chất xúc tác. II. KẼM - Thuộc nhóm IIB, chu kì 4, số hiệu nguyên tử là 30. - Cấu hình electron nguyên tử : [Ar]3d104s2. - Thường có số oxi hóa +2 trong các hợp chất. 1. Tính chất của Zn - Tính chất vật lý: là kim loại màu lam nhạt, trong không khí ẩm bị phủ một lớp oxit mỏng nên có màu xám nhạt; có khối lượng riêng lớn; khá giòn nên không kéo dài được, nhưng ở 100- 150oC lại dẻo và dai còn trên 200oC lại giòn và có thể tán thành bột. Lưu ý: kẽm ở trạng thái rắn và hợp chất của kẽm không độc, riêng hơi ZnO thì rất độc - Tính chất hóa học: Có tính khử mạnh hơn sắt + Tác dụng với phi kim ở nhiệt độ cao + Tác dụng với dung dịch muối và axit + Bền với nước và không khí ở nhiệt độ thường. 2. Ứng dụng của Zn - Kẽm được mạ lên tôn để chống gỉ và còn được dùng làm pin khô - Một số hợp chất của Zn dùng trong y học, chẳng hạn như ZnO dùng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,... III. CHÌ - Thuộc nhóm IVA, chu kì 6, số hiệu nguyên tử là 82. - Cấu hình electron nguyên tử : [Xe]4f145d106s26p2. - Thường có số oxi hóa là +2, +4 nhưng số oxi hóa +2 phổ biến và bền hơn. 1. Tính chất của Pb - Tính chất vật lý: + Là kim loại có màu trắng hơi xanh, khối lượng riêng lớn, mềm và dễ dát thành lá mỏng. + Chì và hợp chất của chì đều rất độc. Khi vào cơ thể có thể gây ra bệnh làm xám men răng và rối loạn thần kinh - Có tính khử yếu : + Bị oxi hóa ở nhiệt độ cao. + Tác dụng chậm với dung dịch HCl và H2SO4 loãng tạo Sn (II) và khí H2.
+ Tan trong kiềm đặc: NaOH, KOH. Ví dụ:
2. Ứng dụng của Pb Được dùng để chế tạo bản cực acquy, vỏ dây cáp, đầu đạn và chế tạo thiết bị chống tia phóng xạ. IV. THIẾC - Thiếc thuộc nhóm IVA, chu kì 5, số hiệu nguyên tử là 50. - Cấu hình electron nguyên tử : [Kr]4d105s25p2. - Có số oxi hóa +2 và +4 trong các hợp chất. 1. Tính chất của Sn - Tính chất vật lý: + Màu trắng bạc, khối lượng riêng lớn, mềm dễ dát mỏng + Tồn tại ở hai dạng thù hình là thiếc trắng và thiếc xám, biến đổi lẫn nhau phụ thuộc vào nhiệt độ - Có tính khử yếu hơn Ni : + Tác dụng với phi kim ở nhiệt độ cao + Tác dụng chậm với dung dịch axit (HNO3 loãng : Sn -> Sn2+ ; H2SO4, HNO3 đặc : Sn -> Sn4+ ) + Tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường Pb + 2KOH → K2PbO2 + H2
+ Bị hòa tan trong dung dịch kiềm đặc. 2. Ứng dụng của Sn - Sn được mạ lên sắt để chống gỉ ( sắt tây) dùng trong công nghiệp thực phẩm - Lá thiếc mỏng dùng trong tụ điện; hợp kim thiếc chì dùng để hàn - SnO2 được dùng làm men trong công nghiệp gốm sứ và làm thủy tinh mờ Sơ đồ tư duy: Sơ lược về Niken, Kẽm, Chì, Thiếc 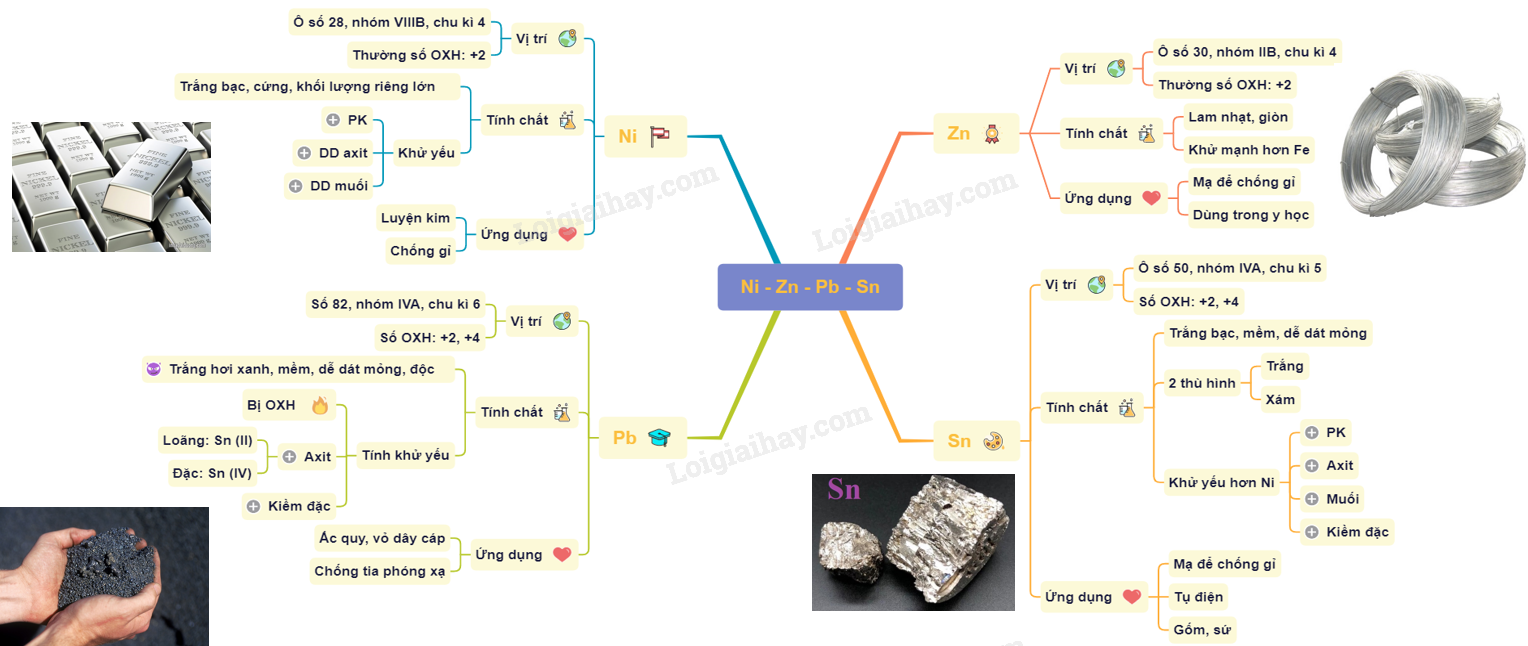 HocTot.Nam.Name.Vn
|