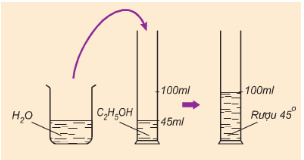
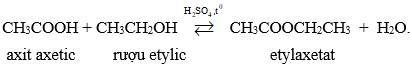Lý thuyết rượu etylicRượu etylic (ancol etylic hoặc etanol) là chất lỏng, không màu... Công thức phân tử rượu etylic: C2H6O Phân tử khối: 46 I. Tính chất vật lí 1. Khái niệm - Rượu etylic là chất lỏng không màu, sôi ở 78,3oC - Nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic hòa tan được nhiều chất như iot, benzen,… 2. Độ rượu và cách tính độ rượu - Độ rượu là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước. Công thức: Độ rượu = $\frac{{{V}_{{{C}_{2}}{{H}_{5}}OH\,nguyen\,chat}}}{{{V}_{dd\,({{C}_{2}}{{H}_{5}}OH+{{H}_{2}}O)}}}.100$ V là thể tích đo bằng ml hoặc lít
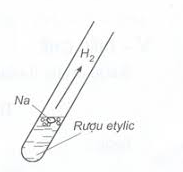
Hình 1: Cách pha rượu 45o II. Cấu tạo phân tử 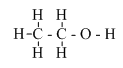 - Công thức cấu tạo thu gọn: CH3 – CH2 – OH - Trong phân tử, rượu etylic có một nguyên tử H không kiên kết với nguyên tử C mà liên kết với nguyên tử oxi tạo ra nhóm –OH. Chính nhóm –OH này làm cho rượu có tính chất hóa học đặc trưng. III. Tính chất hóa học. 1. Phản ứng cháy Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt. C2H5OH + 3O2 \(\overset{t^{o}}{\rightarrow}\) 2CO2 + 3H2O 2. Tác dụng với kim loại mạnh như K, Na,... 2C2H5OH + 2Na \( \to\) 2C2H5ONa + H2.
Hình 2: Minh họa thí nghiệm rượu etylic tác dụng với Na. 3. Tác dụng với axit. Thí dụ: Tác dụng với axit axetic có H2SO4 đặc tạo ra este và nước
IV. Ứng dụng. - Rượu etylic được dùng làm nhiên liệu cho động cơ ôtô, cho đèn cồn trong phòng thí nghiệm. - Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp. - Dùng pha chế các loại rượu uống,... V. Điều chế - Phương pháp 1: Điều chế rượu làm đồ uống Tinh bột hoặc đường glucozơ $\xrightarrow{men\,ruou}$ rượu etylic PTHH: C6H12O6 $\xrightarrow{men\,ruou}$ 2CO2 + 2C2H5OH - Phương pháp 2: Sản xuất rượu phục vụ ngành công nghiệp Cho etilen cộng hợp với nước có axit làm xúc tác CH2=CH2 + H2O $\xrightarrow{axit}$ C2H5OH Chú ý: Những hợp chất hữu cơ phân tử có nhóm OH, có công thức phân tử chung là CnH2n+1OH gọi là ancol no, đơn chức hay ankanol cũng có tính chất tương tự rượu etylic. Sơ đồ tư duy: Rượu etylic
|