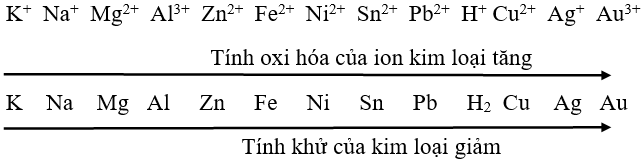Lý thuyết luyện tập tính chất của kim loại1. Cấu tạo của kim loại 1. Cấu tạo của kim loại - Nguyên tử của hầu hết các nguyên tố kim loại có số electron ở lớp ngoài cùng là 1, 2, 3e. - Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng tinh thể. Các electron hoá trị chuyển động tự do trong mạng tinh thể. - Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron. 2. Tính chất của kim loại. - Tính chất vật lí chung: dẫn điện, dẫn nhiệt, dẻo và có ánh kim. - Tính chất hoá học chung là tính khử: M → Mn+ + ne. - Dãy điện hoá của kim loại: cho phép dự đoán chiều phản ứng giữa hai cặp oxi hoá khử theo quy tắc α: phản ứng giữa 2 cặp oxi hoá khử xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn. 3. Cặp oxi hoá – khử của kim loại - Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại. Ví dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe 4. Dãy điện hoá của kim loại
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|