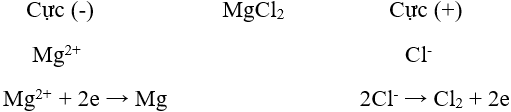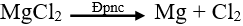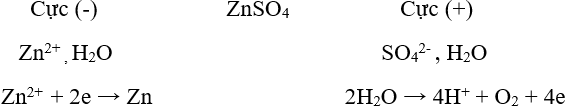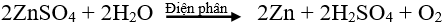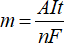Lý thuyết điều chế kim loại- Nguyên tắc: Khử ion kim loại bằng chất khử thích hợp: I. NGUYÊN TẮC ĐIỀU CHẾ KIM LOẠI Khử ion kim loại thành nguyên tử. Mn+ + ne → M I CÁC PHƯƠNG PHÁP ĐIỀU CHẾ KIM LOẠI 1. Phương pháp nhiệt luyện - Đối tượng KL: KL có mức độ hoạt động trung bình - Phương thức điều chế: khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử thông thường như C, CO, H2, Al. VD: Fe2O3 + 3 CO to→ 2Fe + 3CO2 2. Phương pháp thủy luyện - Đối tượng KL: KL có mức độ hoạt động trung bình và yếu - Phương thức điều chế: Khử những in kim loại cần điều chế bằng những kim loại có tính khử mạnh như Fe, Zn,.... VD: Fe + CuSO4 → FeSO4 + Cu 3. Phương pháp điện phân a) Điện phân nóng chảy: - Đối tượng KL: KL có mức độ hoạt động mạnh - Phương thức điều chế: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit). Ví dụ: Điện phân MgCl2 nóng chảy để điều chế Mg.
Phương trình điện phân
b) Điện phân dung dịch: - Đối tượng KL: Dùng điều chế các kim loại yếu. - Phương thức điều chế: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó. Ví dụ: Điện phân dung dịch CuCl2 để điều chế kim loại Cu.
Phương trình điện phân
Video mô phỏng - Quá trình điện phân muối ăn NaCl c) Tính lượng chất thu được ở các điện cực - Dựa vào công thức Farađây:
- Trong đó: m: Khối lượng chất thu được ở điện cực (g). A: Khối lượng mol nguyên tử của chất thu được ở điện cực. n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận. I: Cường độ dòng điện (ampe). t: Thời gian điện phân (giây). F: Hằng số Farađây (F = 96500). Sơ đồ tư duy: Điều chế kim loại  HocTot.Nam.Name.Vn
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|