Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halidexu hướng biến đổi nhiệt độ sôi hydrogen halide, biến đổi tính acid, ứng dụng, nhận biết ion halide Lý thuyết: Hydrogen halide và phản ứng của ion halide I. Tính chất vật lí của hydrogen halide - Ở điều kiện thường, HX tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng 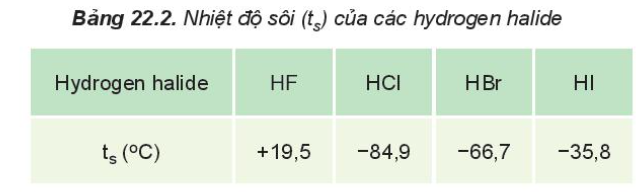
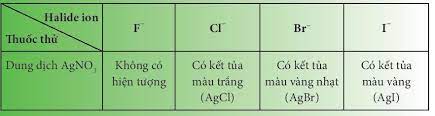
- HF có nhiệt độ sôi cao bất thường là do HF có khả năng tạo liên kết hydrogen - Từ HCl đến HI, nhiệt độ sôi tăng do: + Lực tương tác van der Waals giữa các phân tử tăng + Khối lượng phân tử tăng II. Hydrohalic acid Tính acid của các hydrohalic acid - Hydrogen halide tan trong nước tạo thành hydrohalic acid - HF là acid yếu nhưng có tính ăn mòn thủy tinh SiO2 + 4HF → SiF4↑ + 2H2O - HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hóa học chung của acid + Quỳ tím chuyển sang đỏ + Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học + Tác dụng với basic oxide + Base + 1 số muối III. Tính khử của các ion halide - Các ion halide có số oxi hóa thấp nhất là -1 => Ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa - khử Ví dụ: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O IV. Nhận biết ion Halide trong dug dịch:
V. Ứng dụng a) HF - Sản xuất teflon (chất chống dính ở nồi, chảo) theo sơ đồ:
- Ăn mòn thủy tinh vô cơ SiO2 + 4HF → SiF4 + 2H2O - Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy, sản xuất F2 b) HCl - Loại bỏ gỉ sắt trên sắt thép trước khi chuyển sang công đoạn sản xuất tiếp theo - Sản xuất hợp chất vô cơ và hữu cơ: PVC, PAC… - Tái sinh các nhựa trao đổi ion nhừm thay thế các ion Na+ và Ca2+ = ion H+ Sơ đồ tư duy 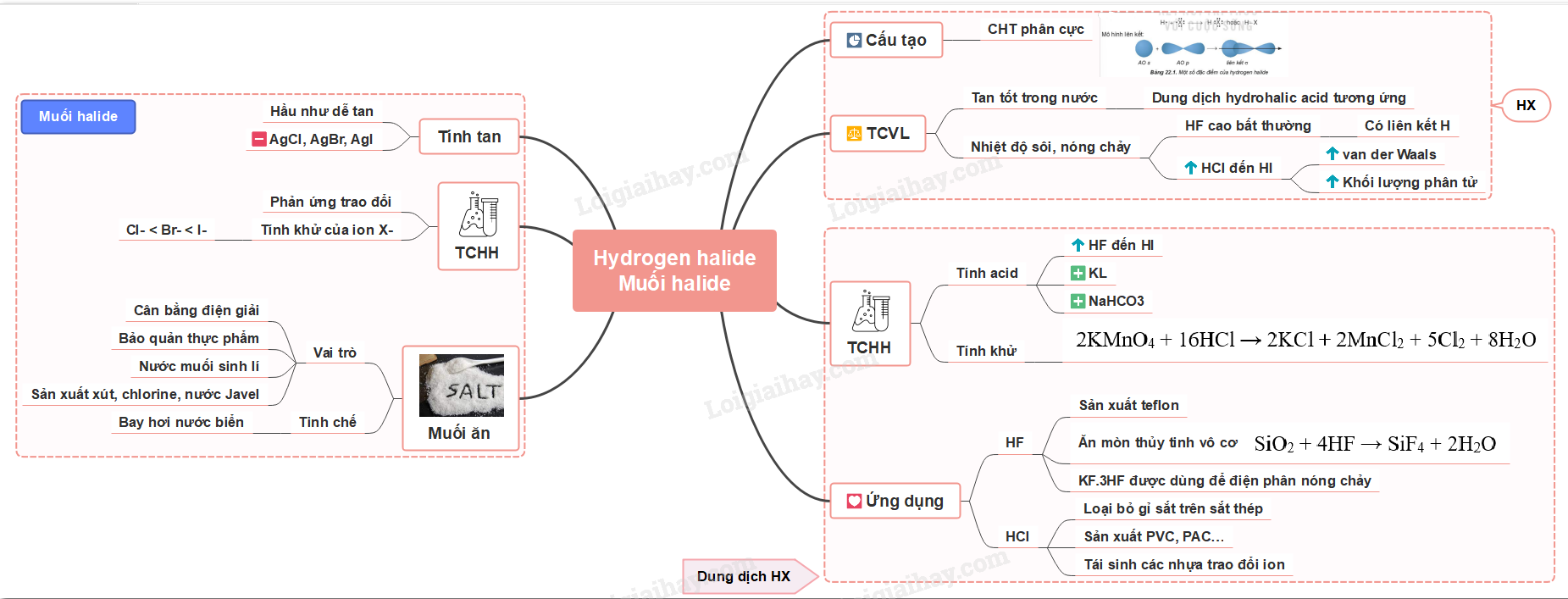 >> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
|