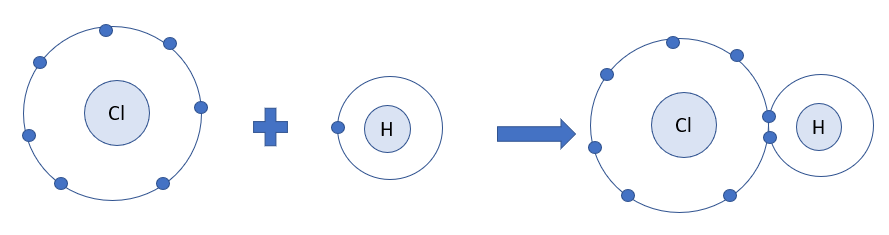
Lý thuyết bài 10: Liên kết cộng hóa trịLiên kết cộng hóa trị Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa... Lý thuyết: Liên kết cộng hóa trị I. Sự hình thành liên kết cộng hóa trị 1. Tìm hiểu sự hình thành liên kết trong các phân tử - Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Ví dụ: + HCl có 1 cặp electron dùng chung, biểu diễn bằng 1 gạch “-“ được gọi là liên kết đơn H-Cl
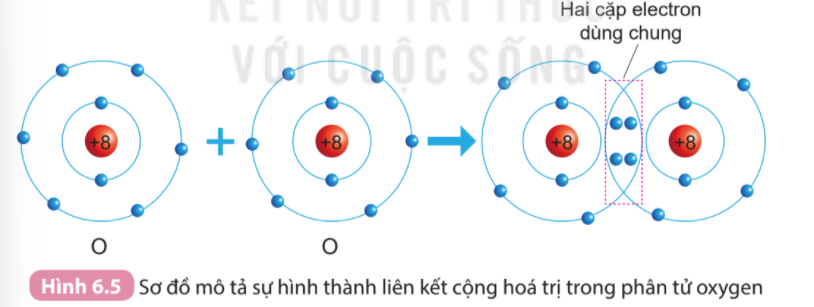
+ Oxygen có 2 cặp electron dùng chung, biểu diễn bằng 2 gạch “=” được gọi là liên kết đôi O = O
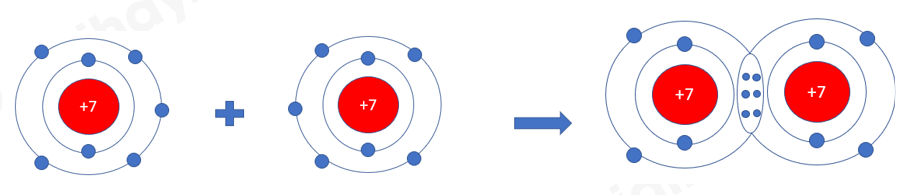
+ Nitrogen: có 3 cặp electron dùng chung, biểu diễn bằng 3 gạch “≡” được gọi là liên kết ba N ≡ N
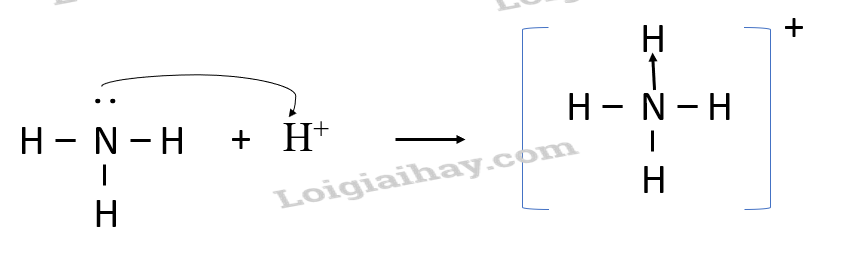
2. Tìm hiểu cách viết công thức Lewis - Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện - Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phân tử - Mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “-“ II. Liên kết cho – nhận - Trong trường hợp cặp electron chung giữa hai nguyên tử tham gia liên kết chỉ do một nguyên tử đóng góp thì liên kết cộng hóa trị giữa hai nguyên tử là liên kết cho – nhận. Ví dụ: Liên kết cho - nhận
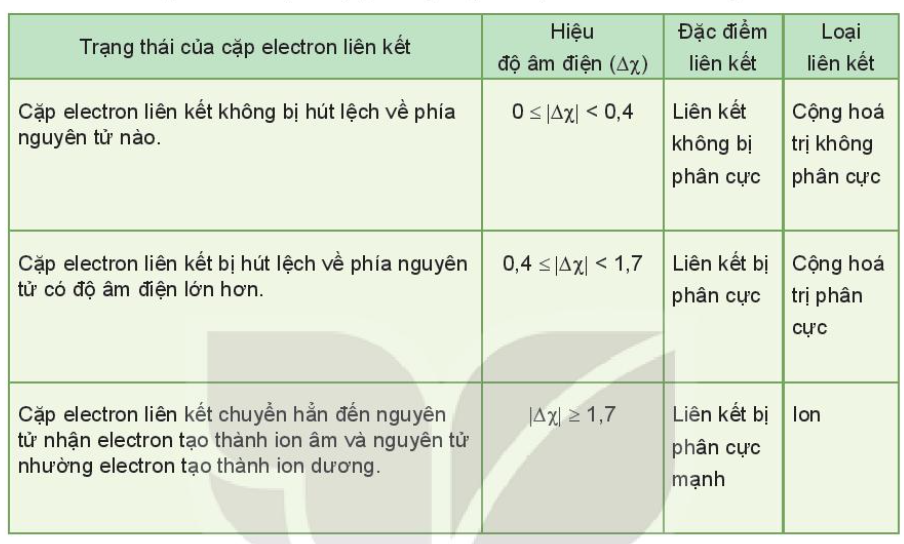
- Phân tử NH3, lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết => Ion H+ có orbital trống, không có electron => Khi phân tử NH3 kết hợp với H+, nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với H+ tạo thành NH4+ => Liên kết cho – nhận được hình thành => Nguyên tử N là nguyên tử cho, ion H+ là nguyên tử nhận III. Phân biệt các loại liên kết dựa theo độ âm điện 1. Phân biệt liên kết cộng hóa trị phân cực và không phân cực - Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào Ví dụ: O2, N2,… - Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn Ví dụ: CO2, HCl, NH3,… 2. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
Ví dụ:
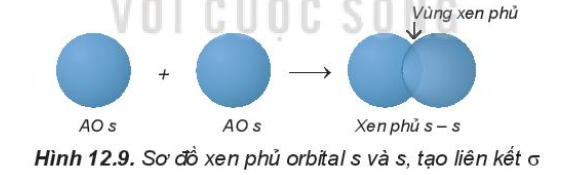
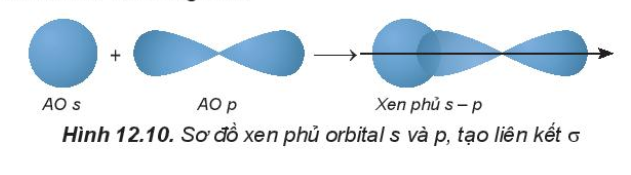
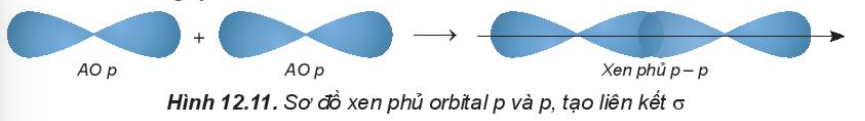
- Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0.96 => Liên kết cộng hóa trị phân cực - Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23 => Liên kết ion IV. Sự hình thành liên kết σ, π và năng lượng liên kết 1. Tìm hiểu sự hình thành liên kết σ và liên kết π - Liên kết σ là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử. + Sự xen phủ s – s
- Sự xen phủ p – p
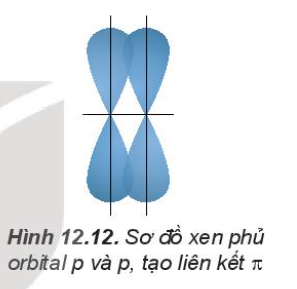
+ Sự xen phủ p – p
- Liên kết π là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
2. Tìm hiểu khái niệm năng lượng liên kết (Eb) - Năng lượng của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí - Giá trị năng lượng của một liên kết hóa học là thước đo độ bền liên kết Ví dụ: H2(g) → 2H(g) Eb = 432 kJ/mol N2(g) → 2N(g) Eb = 945 kJ/mol => Cần cung cấp 432 kJ để phá vỡ 1 mol khí H2, 945 kJ để phá vỡ 1 mol N2
|