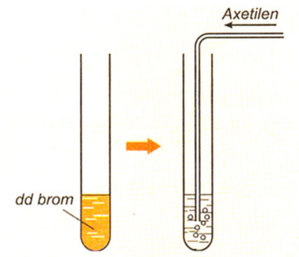
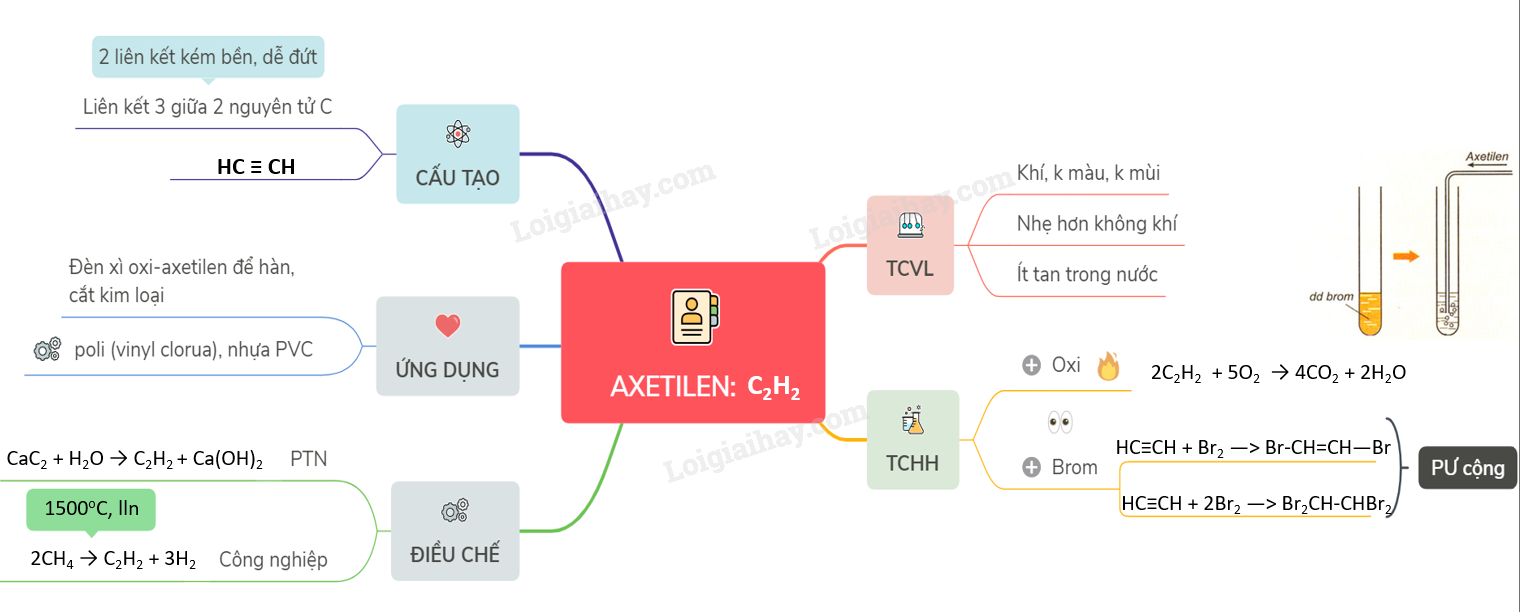
Lý thuyết axetilenAxetilen C2H2 là chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước. - Công thức phân tử: C2H2 - Phân tử khối: 26 I. TÍNH CHẤT VẬT LÍ - Là chất khí, không màu, không mùi, nhẹ hơn không khí (d = \(\frac{26}{29}\)) - Ít tan trong nước II. CẤU TẠO PHÂN TỬ - Axetien có công thức cấu tạo : H - C ≡ C- H. Viết gọn HC ≡ CH. - Đặc điểm: + Có 1 liên kết ba giữa 2 nguyên tử cacbon + Trong liên kết ba có 2 liên kết kém bền, dễ bị đứt lần lượt trong phản ứng hóa học III. TÍNH CHẤT HÓA HỌC 1. Tác dụng với oxi: Tương tự metan và etilen PTHH: 2C2H2 + 5O2 Nhận xét: Khi đốt cháy axetilen thu được số mol CO2 lớn hơn số mol H2O. 2. Phản ứng cộng với dung dịch brom:
PTHH: HC≡CH + Br2 —> Br-CH=CH—Br (đibrometilen) HC≡CH + 2Br2 —> Br2CH-CHBr2 (tetrabrometan) - Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2... HC≡CH + H2 → CH2=CH2 HC≡CH + 2H2 → CH3-CH3 IV. ỨNG DỤNG - Sản xuất nhựa PVC, cao su - Axetilen dùng làm nhiên liệu trong đèn xì oxi-axetilen dể hàn, cắt kim loại. - Sản xuất axit axetic, rượu etylic V. ĐIỀU CHẾ 1. Trong phòng thí nghiệm và trong công nghiệp, cho canxi cacbua phản ứng với nước CaC2 + 2H2O → Ca(OH)2 + C2H2↑ 2. Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao, sau đó làm lạnh nhanh 2CH4 $\xrightarrow[lam\,lanh\,nhanh]{{{1500}^{o}}C}$ C2H2 + 3H2 Sơ đồ tư duy: Axetilen
|













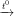 4CO2 + 2H2O
4CO2 + 2H2O