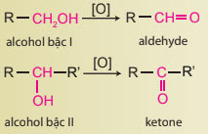
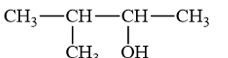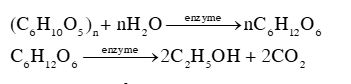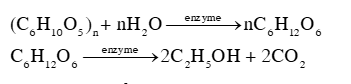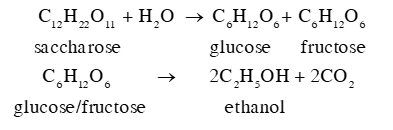Bài 16. Alcohol trang 75, 76 77, 78, 79, 80, 81 SBT Hoá 11 Chân trời sáng tạoAlcohol no, đơn chức, mạch hở có công thức chung là Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
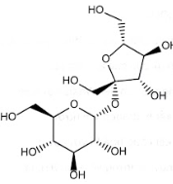
16.1 Alcohol no, đơn chức, mạch hở có công thức chung là A. CnH2n+1OH (n ≥ 1). B. CnH2n+2O (n ≥ 2). C. CnH2nOH (n ≥ 1). D. CnH2n-1OH (n ≥2). Phương pháp giải: Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no. Alcohol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH (n ≥ 1) hoặc CnH2n+2O (n ≥ 1). Lời giải chi tiết: Alcohol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH (n ≥ 1) hoặc CnH2n+2O (n ≥ 1). → Chọn A. 16.2 Hợp chất thuộc loại polyalcohol là A. CH3OH. B. CH3CH2OH. C. CH2=CHCH2OH. D. HOCH2CH2OH. Phương pháp giải: Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no. Polyalcohol là alcohol đa chức (alcohol có nhiều nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no). Lời giải chi tiết: Các alcohol: CH3OH, CH3CH2OH, CH2=CHCH2OH là alcohol đơn chức. HOCH2CH2OH là alcohol đa chức (polyalcohol). → Chọn D. 16.3 Saccharose là một loại đường phổ biến, sản xuất chủ yếu từ cây mía. Saccharose có cấu trúc phân tử: Số nhóm chức alcohol trong phân tử saccharose là:
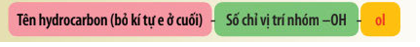
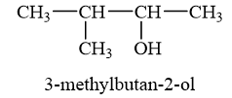
A. 3. B. 5. C. 8. D. 11. Phương pháp giải: Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no. Lời giải chi tiết: Số nhóm chức alcohol trong phân tử saccharose là 8. → Chọn C. 16.4 Ethyl alcohol có công thức cấu tạo là A. CH3OCH3. B. CH3CH2OH. C. HOCH2CH2OH. D. CH3CH2CH2OH. Phương pháp giải: Tên gọi thông thường (tên gốc chức): Tên gốc alkyl + alcohol. Lời giải chi tiết: Ethyl là gốc CH3CH2- Ethyl alcohol có công thức cấu tạo CH3CH2OH. → Chọn B. 16.5 Tên của alcohol có công thức cấu tạo: A. isobutan-2-ol. B. 2-methylbutan-2-ol. C. 3-methylbutan-2-ol. D. 2-methylbutan-3-ol. Phương pháp giải: Danh pháp thay thế của alcohol đơn chức:
Lời giải chi tiết:
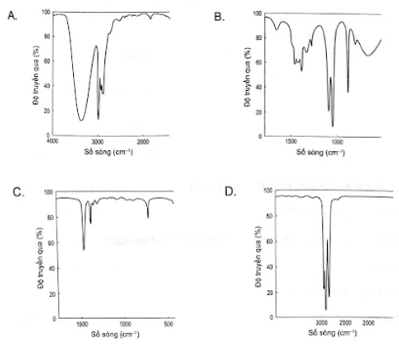
→ Chọn C. 16.6 Trong các alcohol sau, alcohol nào có nhiệt độ sôi cao nhất? A. CH3CH2OH. B. HOCH2CH2OH. C. CH3CH2CH2OH. D. CH3CH2CH2CH2OH. Phương pháp giải: - Nhiệt độ sôi của các alcohol tăng khi phân tử khối tăng. - Alcohol đa chức có nhiệt độ sôi cao hơn so với các alcohol đơn chức có khối lượng tương đương vì chúng tạo được nhiều liên kết hydrogen liên phân tử hơn. Lời giải chi tiết: Nhiệt độ sôi của các alcohol tăng khi phân tử khối tăng, do đó nhiệt độ sôi của CH3CH2OH < CH3CH2CH2OH < CH3CH2CH2CH2OH. Mỗi HOCH2CH2OH có thể tạo được hai liên kết hydrogen liên phân tử, trong khi các alcohol còn lại chỉ tạo được một liên kết hydrogen liên phân tử. Do đó HOCH2CH2OH có nhiệt độ sôi cao hơn các alcohol trên. → Chọn B. 16.7 Methyl alcohol, ethyl alcohol tan vô hạn trong nước là do A. khối lượng phân tử của các alcohol nhỏ. B. hình thành tương tác van der Waals với nước. C. hình thành liên kết hydrogen với nước. D. hình thành liên kết cộng hoá trị với nước. Phương pháp giải: Do tạo liên kết hydrogen tốt với nước, các alcohol chứa từ 1 đến 3 nguyên tử carbon trong phân tử tan vô hạn trong nước. Khi số nguyên tử carbon tăng lên thì độ tan của alcohol trong nước giảm dần. Lời giải chi tiết: Methyl alcohol, ethyl alcohol tan vô hạn trong nước là do hình thành liên kết hydrogen với nước. → Chọn C. 16.8 Alcohol có phản ứng đặc trưng với Cu(OH)2 là A. propane-1,2-diol, CH3CH(OH)CH2OH. B. propan-2-ol, CH3CH(OH)CH3. C. propane-1,3-diol, HOCH2CH2CH2OH. D. ethanol, CH3CH2OH. Phương pháp giải: Các polyalcohol có các nhóm –OH liền kề như ethylene glycol, glycerol, ... có thể tạo phức chất với Cu(OH)2, sản phẩm có màu xanh đặc trưng. Lời giải chi tiết: CH3CH(OH)CH2OH có hai nhóm –OH liền kề. Do đó, alcohol có phản ứng đặc trưng với Cu(OH)2 là propane-1,2-diol, CH3CH(OH)CH2OH. → Chọn A. 16.9 Nhóm chức alcohol không bị phá vỡ bởi tác nhân nào? A. Na. B. H2SO4 đặc, 170 °C. C. Cu. D. CuO, t°. Phương pháp giải: Alcohol có khả năng tham gia phản ứng thế nguyên tử hydrogen của nhóm – OH; phản ứng tạo thành ether; phản ứng tạo thành alkene; phản ứng oxi hoá. Polyalcohol có các nhóm -OH kề nhau có thể tạo phức với Cu(OH)2. Lời giải chi tiết: Nhóm chức alcohol tham gia: + Phản ứng thế nguyên tử hydrogen của nhóm – OH với kim loại kiềm. + Phản ứng tác nước tạo alkene với xúc tác H2SO4 đặc, 170 °C. + Phản ứng oxi hóa alcohol bậc I và bậc II của CuO. Nhóm chức alcohol không bị phá vỡ bởi Cu. → Chọn C. 16.10 Alcohol bị oxi hoá bởi CuO, t° tạo thành ketone là A. CH3CH(OH)CH3. B. CH3CH2CH2OH. C. CH3CH2OH. D. CH3OH. Phương pháp giải: Trong điều kiện thích hợp, một số alcohol bị oxi hóa không hoàn toàn thành aldehyde hoặc ketone. Lời giải chi tiết: Alcohol bậc II bị CuO oxi hóa thành ketone. Alcohol bị oxi hoá bởi CuO, t° tạo thành ketone là CH3CH(OH)CH3. → Chọn A. 16.11 Theo Nghị định 100/2019/NĐ-CP của Chính phủ quy định, nồng độ cồn trong 1 L hơi thở ở mức bao nhiêu là vi phạm luật khi tham gia giao thông? A. ≤ 0,25 mg. B. ≤0,15 mg. C. ≤0,10 mg. D. > 0,25 mg. Phương pháp giải: Theo quy định tại điểm c khoản 4 điều 8 Nghị định số 100/2019/NĐ-CP thì người điều khiển xe thực hiện hành vi điều khiển xe trên đường mà trong máu hoặc hơi thở có nồng độ cồn vượt quá 80 mg/100 mL máu hoặc vượt quá 0,4 mg/1 L khí thở. Lời giải chi tiết: Theo Nghị định 100/2019/NĐ-CP của Chính phủ quy định, nồng độ cồn trong 1 L hơi thở ở mức > 0,00 mg là vi phạm luật khi tham gia giao thông. → Chọn D. 16.12 Trên phổ hồng ngoại (IR) cho các tín hiệu ở các số sóng khác nhau. Cho biết tín hiệu nào đặc trưng của nhóm chức alcohol.
Phương pháp giải:
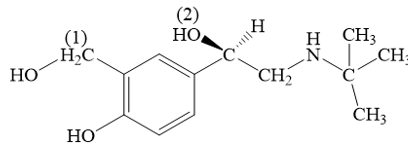
Số sóng (peak) đặc trưng của nhóm chức OH nằm trong khoảng 3600 – 3300 (cm-1). Lời giải chi tiết: Trên phổ A, ta thấy có tín hiệu đặc trưng của nhóm chức alcohol nằm trong khoảng 3600 – 3300 (cm-1). → Chọn A. 16.13 Albuterol được sử dụng như một loại thuốc cho đường hô hấp, trị hen suyễn, có công thức: Cho biết nhóm –OH nào thuộc nhóm chức alcohol và xác định bậc alcohol trong albuterol. Phương pháp giải: Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no. Bậc alcohol là bậc của nguyên tử carbon liên kết với nhóm –OH. Lời giải chi tiết: Các nhóm –OH được được kí hiệu số (1) và (2) liên kết trực tiếp với carbon no, do đó đây là nhóm –OH của alcohol. Nhóm –OH (1) là alochol bậc I. Nhóm –OH (2) là alochol bậc II. 16.14 Một thí nghiệm của ethanol được tiến hành như sau: Rót cồn 99° vào cốc. Làm khan bằng CuSO4 khan trước khi tiến hành thí nghiệm. Cho mẫu sodium vào cốc, bọt khí hydrogen xuất hiện trên bề mặt mẫu sodium. Thêm nước và chất chỉ thị phenolphthalein vào cốc, dung dịch dần chuyển màu hồng. Vận dụng thuyết Brønsted – Lowry, hãy giải thích sự đổi màu dung dịch phenolphthalein. Phương pháp giải: Khi phản ứng với kim loại kiềm alcohol có phản ứng thế nguyên tử hydrogen trong nhóm –OH. Dung dịch có tính kiềm làm dung dịch phenolphthalein hóa hồng. Lời giải chi tiết: \[2{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} + 2{\rm{Na}} \to 2{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa}} + {{\rm{H}}_{\rm{2}}} \uparrow \] Thêm nước và chất chỉ thị phenolphthalein vào cốc, sodium ethanolate bị thủy phân tạo môi trường base, làm phenolphthalein hóa hồng. .\[\begin{array}{l}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{{\rm{O}}^ - } + {\rm{N}}{{\rm{a}}^ + }\\{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{{\rm{O}}^ - } + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} + {\rm{O}}{{\rm{H}}^ - }\end{array}\]. 16.15 Mô tả thí nghiệm tìm hiểu phản ứng tách hydrogen trong nhóm –OH của alcohol đơn chức với polyalcohol như sau: Bước 1: Lấy 2 mL ethyl alcohol và 2 mL ethylene glycol lần lượt cho vào 2 ống nghiệm được đánh số (1), (2). Bước 2: Cho vào mỗi ống nghiệm mẫu nhỏ sodium có kích thước tương đương nhau. Khí H2 thoát ra trong ống nghiệm nào nhanh hơn? Giải thích. Phương pháp giải: Khả năng tách hydrogen của ethylene glycol kém hơn ethyl alcohol. Do đó khi phản ứng với sodium, hydrogen thoát ra từ ống nghiệm chứa ethylene glycol chậm hơn so với ethl alcohol. Lời giải chi tiết:
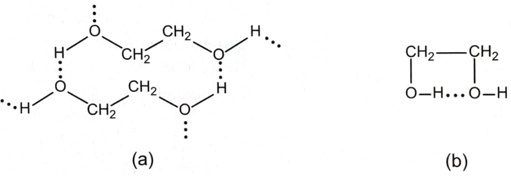
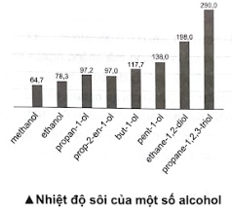
Ngoài liên kết hydrogen giữa các phân tử alcohol (Hình a), ethylene glycol còn hình thành liên kết hydrogen giữa các nhóm -OH trong phân tử (Hình b), là nguyên nhân gây ra độ nhớt của ethylene glycol, nên giảm khả năng tách nguyên tử hydrogen của nhóm –OH ra khỏi phân tử ethylene glycol. Nên khi phản ứng với sodium, hydrogen thoát ra chậm hơn so với ethyl alcohol. Vậy khí H2 thoát ra trong ống nghiệm (1) nhanh hơn. 16.16 Biểu đồ dưới đây biểu diễn nhiệt độ sôi (°C) của một số alcohol. Nhận xét nhiệt độ sôi của các alcohol trên. Giải thích.
Phương pháp giải: - Nhiệt độ sôi của các alcohol tăng khi phân tử khối tăng. - Alcohol đa chức có nhiệt độ sôi cao hơn so với các alcohol đơn chức có khối lượng tương đương vì chúng tạo được nhiều liên kết hydrogen liên phân tử hơn. Lời giải chi tiết: Nhiệt độ sôi của các alcohol tăng theo chiều tăng khối lượng phân tử và theo chiều tăng số lượng nhóm -OH. Đối với các alcohol đơn chức, khi tăng khối lượng phân tử, tương tác van der Waals tăng nên nhiệt độ sôi của alcohol tăng; đối với alcohol đa chức, khi có nhiều nhóm -OH sẽ hình thành nhiều liên kết hydrogen liên phân tử hơn, nên nhiệt độ sôi của alcohol đa chức cao hơn nhiệt độ sôi của alcohol đơn chức có cùng số nguyên tử carbon. 16.17 Cơm rượu (hay còn gọi là rượu nếp cái) là món ăn đặc sản trong dịp lễ Tết của người Việt, được truyền lại qua những nét đặc trưng riêng về khẩu vị của từng miền. Cơm rượu được chế biến từ gạo nếp, thành phần chủ yếu là tinh bột, nấu chín thành xôi, để nguội và ủ với men thích hợp trong khoảng 3 – 5 ngày. Sản phẩm có mùi thơm đặc trưng, vị thanh ngọt, cay nhẹ, hơi nồng, giúp kích thích tiêu hoá, ... Tuy nhiên, sử dụng nhiều có thể gây nên sự không tỉnh táo. Giải thích và viết phương trình chuyển hoá các chất trong quá trình ủ men thành cơm rượu. Phương pháp giải: Phương pháp sinh hoá sử dụng enzyme để lên men tinh bột và các loại đường trong tự nhiên, chuyển hoá thành ethanol.
Lời giải chi tiết: Trong gạo nếp, thành phần chủ yếu là tinh bột ((C6H10O5)n), khi ủ với men (enzyme), xảy ra các phản ứng theo phương trình hoá học sau:
Cơm rượu là sản phẩm của quá trình lên men tinh bột, chứa ethanol, không qua chưng cất. Vị ngọt của sản phẩm thường do có chứa đường glucose (C6H12O6). Khi ăn nhiều món ăn này có thể gây nên sự không tỉnh táo, mệt mỏi, khó thở, ...do có chứa ethanol (C2H5OH). 16.18 Khi đến trạm bơm nhiên liệu và nhìn thấy dòng chữ quen thuộc như xăng E5 (hay xăng E5 RON 92, E5 A92), em hãy cho biết ý nghĩa của kí hiệu E5. Theo Quyết định số 53/2012/QĐ-TTg của Thủ tướng Chính phủ về lộ trình áp dụng tỉ lệ phối trộn nhiên liệu sinh học với nhiên liệu truyền thống, từ ngày 01/12/2017, xăng E10 được khuyến khích sản xuất, kinh doanh để sử dụng cho phương tiện cơ giới đường bộ trên toàn quốc. Khi xăng E10 được đưa vào tiêu thụ, trong các loại nhiên liệu như xăng E5, xăng E10, xăng A95, theo em, dùng nhiên liệu nào sẽ thân thiện với môi trường. Phương pháp giải: Xăng E10 là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 90:10. Xăng E5 (hay xăng E5 RON 92, E5 A92) là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 95:5. Tỉ lệ ethanol trong xăng cao hơn, lượng CO2 phát thải vào khí quyển ít hơn. Lời giải chi tiết: Xăng E5 (hay xăng E5 RON 92, E5 A92) là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 95:5, đây là loại nhiên liệu sinh học nhằm giảm thiểu phát thải CO2 vào khí quyển được sử dụng phổ biến trên thị trường ở Việt Nam. Xăng E10 là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 90:10. Do có tỉ lệ cồn sinh học cao hơn xăng E5 và xăng A95 (không có sự phối trộn với ethanol), nên sử dụng xăng E10 sẽ thân thiện với môi trường hơn. 16.19 Trong công nghiệp chế biến đường từ mía, nho, củ cải đường sẽ tạo ra sản phẩm phụ, gọi là rỉ đường hay rỉ mật, sử dụng rỉ đường để lên men tạo ra ethanol trong điều kiện thích hợp, hiệu suất cả quá trình là 90%. Tính khối lượng ethanol thu được từ 1 tấn rỉ đường mía theo 2 phương trình:
Phương pháp giải: Sử dụng công thức: \[{{\rm{m}}_{{\rm{sp(tt)}}}} = {{\rm{m}}_{{\rm{sp(lt)}}}} \times \frac{{{\rm{H\% }}}}{{{\rm{100\% }}}}\] Lời giải chi tiết: Ta có số mol của saccharose tính theo đơn vị kg: \({{\rm{n}}_{{{\rm{C}}_{{\rm{12}}}}{{\rm{H}}_{{\rm{22}}}}{{\rm{O}}_{{\rm{11}}}}}} = \frac{{1000}}{{342}} \approx 2,924{\rm{ }}({\rm{mol}})\) \(\begin{array}{l}{\rm{ }}{{\rm{C}}_{{\rm{12}}}}{{\rm{H}}_{{\rm{22}}}}{{\rm{O}}_{{\rm{11}}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{ }}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}{\rm{ + }}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}\\{\rm{ 2}}{\rm{,924 }} \to {\rm{ 2}}{\rm{,924}} \to {\rm{ 2}}{\rm{,924 (mol)}}\\{\rm{ }}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}{\rm{ }} \to {\rm{ 2}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH + 2C}}{{\rm{O}}_{\rm{2}}}\\{\rm{ 2}}{\rm{,924}} \times 2{\rm{ }} \to {\rm{ 2}}{\rm{,924}} \times {\rm{2}} \times {\rm{2 (mol)}}\\ \Rightarrow {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (lt)}}}} = {\rm{2}}{\rm{,924}} \times {\rm{2}} \times {\rm{2}} \times 46 = 538,016{\rm{ (kg)}}\\ \Rightarrow {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (tt)}}}} = 538,016 \times \frac{{90\% }}{{100\% }} \approx 484,214{\rm{ (kg)}}\end{array}\) 16.20 Diethyl ether là hợp chất hữu cơ có công thức C2H5OC2H5 (viết tắt là Et2O), thường được sử dụng làm dung môi không proton phổ biến trong phòng thí nghiệm, dung môi đặc biệt quan trọng trong sản xuất nhựa cellulose như cellulose acetate. Et2O có chỉ số cetane (đại lượng quy ước cho khả năng tự bốc cháy của nhiên liệu, có trị số từ 0 – 100) cao, khoảng 85 – 96. làm chất kích nổ cho một số động cơ; Et2O kết hợp với các sản phẩm chưng cất dầu mỏ như xăng, dầu diesel, giúp khởi động lại động cơ ở nhiệt độ dưới 0 °C. Et2O được sản xuất bằng phương pháp loại nước ở thể hơi ethyl alcohol với xúc tác alumina (Al2O3), hiệu suất lên đến 95%. Et2O cũng được điều chế trong phòng thí nghiệm và quy mô công nghiệp bằng hỗn hợp ethyl alcohol và sulfuric acid đặc, phản ứng thực hiện ở nhiệt độ thấp hơn 150 °C để tránh tạo ra ethylene. Theo tính toán lí thuyết, để sản xuất 1 tấn diethyl ether, cần khối lượng ethyl alcohol tối thiểu là bao nhiêu? Phương pháp giải: Sử dụng công thức: \[{{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (TT)}}}} = {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (LT)}}}} \times \frac{{{\rm{100\% }}}}{{{\rm{H\% }}}}\] Lời giải chi tiết: \frac{{1000}}{{74}} = 13,514{\rm{ }}({\rm{mol}})\) \(\begin{array}{l}{\rm{2}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{O}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\\{{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {\rm{2}}{{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{O}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}}} = 2 \times 13,514 = 27,028{\rm{ (mol) }}\\ \Rightarrow {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (LT)}}}} = 27,028 \times 46 = 1234,288{\rm{ (kg)}}\\ \Rightarrow {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH (TT)}}}} = 1234,288 \times \frac{{100\% }}{{95\% }} \approx 1308,724{\rm{ (kg)}}\end{array}\) 16.21 Hoá chất gây tác hại đến sức khoẻ con người và động vật. Các hoá chất khác nhau gây độc tính trên các bộ phận sẽ khác nhau, ví dụ, 2 gam chất (A) gây tổn thương cho gan, nhưng không hẳn 2 gam chất (A) sẽ gây tổn thương cho thận. Để so sánh độc tính giữa các hoá chất, người ta thực hiện thử nghiệm LD50. LD50 (Lethal Dose, 50%) là liều lượng hoá chất phơi nhiễm trong cùng một thời điểm, gây tử vong cho 50% cá thể của nhóm thử nghiệm. LD50 của ethanol đối với người trưởng thành trong khoảng 5 gam – 8 gam trên 1 kg trọng lượng cơ thể. Trung bình, một người trưởng thành nặng 60 kg, khi sử dụng đồ uống có cồn, lượng ethanol có thể gây ra tình trạng nguy kịch cho sức khoẻ là bao nhiêu? Phương pháp giải: LD50 là liều lượng hoá chất gây tử vong cho 50% cá thể trong một nhóm thử nghiệm. LD50 của ethanol đối với người trưởng thành trong khoảng 5 gam – 8 gam trên 1 kg trọng lượng cơ thể. Tức là 5 gam ethanol trên 1 kg trọng lượng cơ thể có thể gây tử vong cho 50% cá thể trong một nhóm thử nghiệm. Lời giải chi tiết: LD50 của ethanol đối với người trưởng thành trong khoảng 5 gam – 8 gam trên 1 kg trọng lượng cơ thể. Trung bình, một người trưởng thành nặng 60 kg, khi sử dụng đồ uống có cồn, lượng ethanol có thể gây ra tình trạng nguy kịch cho sức khoẻ là: \[5 \times 60 = 300{\rm{ (g)}}\] 16.22 Cho các liên kết và giá trị năng lượng liên kết (Eb) của một số liên kết cộng hoá trị như sau:
a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hơi ethanol. b) Khi đốt cháy cùng số mol ethanol và methanol, nhiệt năng của phản ứng nào tạo ra nhiều hơn? Phương pháp giải: Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là: \[{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(c\~n ) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\] Lời giải chi tiết: a) Phương trình hóa học của phản ứng đốt cháy hơi ethanol: \({{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}(g) + 3{{\rm{O}}_{\rm{2}}}(g) \to 2{\rm{C}}{{\rm{O}}_{\rm{2}}}(g) + 3{{\rm{H}}_{\rm{2}}}{\rm{O}}(g)\) Ta có: \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(c\~n ) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\) \(\begin{array}{l}{\rm{ = }}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH) + 3}}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{O}}_{\rm{2}}}{\rm{)}} - {\rm{2}}{{\rm{E}}_{\rm{b}}}{\rm{(C}}{{\rm{O}}_{\rm{2}}}{\rm{)}} - {\rm{3}}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{O)}}\\ = 5{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} - {\rm{H}}){\rm{ + }}{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} - {\rm{C}}){\rm{ + }}{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} - {\rm{O}}) + {{\rm{E}}_{\rm{b}}}{\rm{(O}} - {\rm{H}}) + 3{{\rm{E}}_{\rm{b}}}{\rm{(O}} = {\rm{O}}) - 2 \times 2{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} = {\rm{O}}) - 3 \times 2{{\rm{E}}_{\rm{b}}}{\rm{(O}} - {\rm{H}})\\ = 5 \times 413 + 347 + 358 + 467 + 3 \times 498 - 2 \times 2 \times 745 - 3 \times 2 \times 467 = - 1051{\rm{ (kJ)}}\end{array}\) b) ) Phương trình hóa học của phản ứng đốt cháy hơi methanol: \({\rm{C}}{{\rm{H}}_3}{\rm{OH}}(g) + \frac{3}{2}{{\rm{O}}_{\rm{2}}}(g) \to {\rm{C}}{{\rm{O}}_{\rm{2}}}(g) + 2{{\rm{H}}_{\rm{2}}}{\rm{O}}(g)\) Ta có: \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(c\~n ) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\) \(\begin{array}{l}{\rm{ = }}{{\rm{E}}_{\rm{b}}}{\rm{(C}}{{\rm{H}}_3}{\rm{OH) + }}\frac{{\rm{3}}}{2}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{O}}_{\rm{2}}}{\rm{)}} - {{\rm{E}}_{\rm{b}}}{\rm{(C}}{{\rm{O}}_{\rm{2}}}{\rm{)}} - 2{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{O)}}\\ = 3{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} - {\rm{H}}){\rm{ + }}{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} - {\rm{O}}) + {{\rm{E}}_{\rm{b}}}{\rm{(O}} - {\rm{H}}) + \frac{3}{2}{{\rm{E}}_{\rm{b}}}{\rm{(O}} = {\rm{O}}) - 2{{\rm{E}}_{\rm{b}}}{\rm{(}}{\mathop{\rm C}\nolimits} = {\rm{O}}) - 2 \times 2{{\rm{E}}_{\rm{b}}}{\rm{(O}} - {\rm{H}})\\ = 3 \times 413 + 358 + 467 + \frac{3}{2} \times 498 - 2 \times 745 - 2 \times 2 \times 467 = - 547{\rm{ (kJ)}}\end{array}\) Vậy khi đốt cháy cùng số mol ethanol và methanol, nhiệt năng của phản ứng đốt cháy ethanol tạo ra nhiều hơn. 16.23 HOẠT ĐỘNG TRẢI NGHIỆM Dụng cụ và hoá chất: bình tam giác 250 mL (số lượng: 4), nhiệt kế, ống đong 100 mL, đèn cồn (số lượng: 4), cân, ethanol, propan-1-ol, propan-2-ol, butan-1-ol, nước cất (hoặc nước sạch). Tiến hành: Bước 1: Đong 100 mL (tương đương 100 gam) nước cất, cho vào bình tam giác. Đo nhiệt độ (t) của nước. Bước 2: Rót 20 mL mỗi alcohol cho riêng biệt vào 4 đèn cồn. Cân khối lượng mỗi đèn (m1). Bước 3: Dùng đèn cồn để đun nước trong bình. Quan sát nhiệt kế, khi nhiệt độ của nước lên đến 40°C thì ngừng đun, tắt đèn cồn. Cân lại khối lượng của đèn cồn (m2). Câu hỏi thảo luận: a) Khi đốt cháy 1 mol mỗi alcohol trên, alcohol nào tạo ra năng lượng lớn nhất? b) So sánh năng lượng tạo ra khi đốt cháy hoàn toàn cùng một khối lượng propan-1-ol và propan-2-ol. c) Xét trường hợp của ethanol, so sánh với năng lượng tính toán lí thuyết \[{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH(l) + 3}}{{\rm{O}}_{\rm{2}}}{\rm{(g) }} \to {\rm{ 2C}}{{\rm{O}}_{\rm{2}}}{\rm{(g) + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O(g); }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = - 1 234}}{\rm{,83 kJ}}\] Cho biết nhiệt lượng nước nhận được = khối lượng nước × nhiệt dung riêng của nước × biển thiên nhiệt độ (nhiệt dung riêng của nước là 4,18 J/g × C), nên: Nhiệt lượng nước nhận được: Q = 100×4,18×(40 − t) (J). Có phải tất cả nhiệt lượng do quá trình đốt cháy alcohol đều làm tăng nhiệt độ của nước không? Phương pháp giải: a) Cùng điều kiện tiến hành thí nghiệm, cùng khối lượng nước, cùng sự biến thiên nhiệt độ từ t đến 40 °C (bỏ qua sai số về khối lượng giữa các bấc đèn khi cháy). Alcohol nào có khối lượng (m) nhỏ hơn thì toả ra nhiệt lượng lớn hơn. b) So sánh giá trị mal2 và mal3. Nếu mal2 < mal3 thì năng lượng tạo ra khi đốt cháy hoàn toàn propan-1-ol lớn hơn propan-2-ol và ngược lại. c) Enthalpy của quá trình đốt cháy ethanol nhỏ hơn so sánh với năng lượng tính toán lí thuyết vì khi đốt cháy alcohol, nhiệt lượng toả ra sẽ hao phí, một phần truyền vào môi trường, truyền cho bình tam giác,... Lời giải chi tiết: a) Tính khối lượng mỗi alcohol phản ứng: malcohol = m2 - m1 lần lượt được các giá trị mal1, mal2, mal3, mal4. Cùng điều kiện tiến hành thí nghiệm, cùng khối lượng nước, cùng sự biến thiên nhiệt độ từ t đến 40 °C (bỏ qua sai số về khối lượng giữa các bấc đèn khi cháy). Alcohol nào có khối lượng (m) nhỏ hơn thì toả ra nhiệt lượng lớn hơn. b) So sánh giá trị mal2 và mal3. c) Xét trường hợp của ethanol, nhiệt lượng nước nhận được từ mal1 (gam) ethanol: Q = 100×4,18×(40 − t) (đơn vị: J) Số mol ethanol phản ứng: \[{{\rm{n}}_{{\rm{ethanol}}}} = {\rm{ }}\frac{{{{\rm{m}}_{{\rm{al1}}}}}}{{46}}\] Nhiệt lượng nước nhận được từ 1 mol ethanol là: \[{{\rm{Q}}_{{\rm{ethanol}}}} = \frac{{\rm{Q}}}{{{{\rm{n}}_{{\rm{ethanol}}}}}}\]. Enthalpy của quá trình đốt cháy ethanol là: \[\Delta {\rm{H }} = - {{\rm{Q}}_{{\rm{ethanol}}}}\] (Giá trị này sẽ thấp hơn so với giá trị lí thuyết). Tất cả nhiệt lượng do quá trình đốt cháy alcohol không chỉ để dùng làm tăng nhiệt độ của nước vì khi đốt cháy alcohol, nhiệt lượng toả ra sẽ hao phí, một phần truyền vào môi trường, truyền cho bình tam giác,...
|