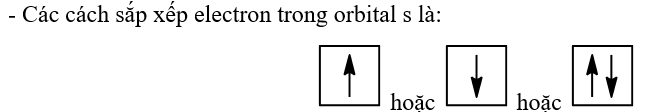
Bài 3. Cấu trúc lớp vỏ electron nguyên tử trang 7, 8, 9 SBT Hóa 10 Kết nổi tri thứcOrbital nguyên tử là A. đám mây chứa electron có dạng hình cầu. Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây? Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Nhận biết 3.1 Orbital nguyên tử là A. đám mây chứa electron có dạng hình cầu. B. đám mây chứa electron có dạng hình số 8 nổi. C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất. D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định. Lời giải chi tiết: Đáp án: C Nhận biết 3.2 Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây? A. Nguyên lí vững bền. B. Quy tắc Hund. C. Nguyên lí Pauli. D. Quy tắc Pauli. Phương pháp giải: Dựa vào nội dung của nguyên lí và quy tắc - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau - Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa - Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p… Lời giải chi tiết: - Đáp án: C Nhận biết 3.3 Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây? A. Nguyên lí vững bền và nguyên lí Pauli. B. Nguyên lí vững bền và quy tắc Hund. C. Nguyên lí Pauli và quy tắc Hund. D. Nguyên lí vững bền và quy tắc Pauli. Phương pháp giải: Dựa vào nội dung của nguyên lí và quy tắc - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau - Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa - Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p… Lời giải chi tiết: Đáp án: B Nhận biết 3.4 Sự phân bố electron vào các lớp và phân lớp căn cứ vào A. nguyên tử khối tăng dần. B. điện tích hạt nhân tăng dần. C. số khối tăng dần. D. mức năng lượng electron. Phương pháp giải: Dựa vào nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p… Lời giải chi tiết: Đáp án: D Nhận biết 3.5 Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng A. lần lượt từ cao đến thấp. B. lần lượt từ thấp đến cao C. bất kì. D. từ mức thứ hai trở đi. Phương pháp giải: Dựa vào nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p… Lời giải chi tiết: - Đáp án: B Nhận biết 3.6 Các lớp electron được đánh số từ trong ra ngoài bằng các số nguyên dương: n = 1, 2, 3,… với tên gọi là các chữ cái in hoa là A. K, L, M, O,... B. L, M, N, O,... C. K, L, M, N,... D. K, M, N, O,... Phương pháp giải: Dựa vào cCách gọi tên và đánh số các lớp
Lời giải chi tiết: Đáp án C Nhận biết 3.7 Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường, theo thứ tự là A. s, d, p, f,... B. s, p, d, f, ... C. s, p, f, d,... D. f, d, p, s,... Lời giải chi tiết: Đáp án: B Nhận biết 3.8 Phát biểu nào sau đây đúng? A. Những electron ở lớp K có mức năng lượng thấp nhất. B. Những electron ở gần hạt nhân có mức năng lượng cao nhất. C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s. D. Các electron trong cùng một lớp có năng lượng bằng nhau. Lời giải chi tiết: - Đáp án: A - Giải thích: + A: Lớp K gần hạt nhân nhất nên electron ở lớp K sẽ có mức năng lượng thấp nhất + B: Sai ở “mức năng lượng cao nhất” sửa thành “mức năng lượng thấp nhất” + C: Sai ở “mức năng lượng thấp hơn” sửa thành “mức năng lượng cao hơn” + D: Sai ở “trong cùng một lớp có năng lượng bằng nhau” sửa thành “trong cùng một lớp có năng lượng gần bằng nhau” hoặc “trong cùng một phân lớp có năng lượng bằng nhau” Nhận biết 3.9 Mỗi orbital nguyên tử chứa tối đa A. 1 electron. B. 2 electron. C. 3 electron. D. 4 electron. Phương pháp giải: Dựa vào nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau Lời giải chi tiết: Đáp án: B Nhận biết 3.10 Số orbital trong các phân lớp s, p, d lần lượt bằng A. 1, 3, 5. B. 1, 2, 4. C. 3, 5, 7. D. 1, 2, 3. Phương pháp giải: Dựa vào các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7 Lời giải chi tiết: Đáp án: A Thông hiểu 3.11 Phân lớp 3d có số electron tối đa là A. 6. B. 18. C. 14. D. 10. Phương pháp giải: Dựa vào - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau - Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7 Lời giải chi tiết: - Phân lớp d có 5 AO, mỗi AO chứa tối đa 2 electron => Phân lớp d chứa tối đa 2.5 = 10 electron => Đáp án: D Thông hiểu 3.12 Lớp L có số phân lớp electron bằng A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào - Số phân lớp trong một lớp electron: + 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó + 3 lớp sau (5, 6, 7) đều có 4 phân lớp - Cách gọi tên và đánh số các lớp
Lời giải chi tiết: Đáp án B Thông hiểu 3.13 Lớp M có số orbital tối đa bằng A. 3. B. 4. C. 9. D. 18. Phương pháp giải: Dựa vào - Số phân lớp trong một lớp electron: + 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó + 3 lớp sau (5, 6, 7) đều có 4 phân lớp - Cách gọi tên và đánh số các lớp
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7 - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau Lời giải chi tiết: - Lớp M có 3 phân lớp là s, p, d. - Các phân lớp s, p, d lần lượt có số AO tương ứng là 1, 3, 5 => Lớp M có tổng cộng 1 + 3 + 5 = 9 AO => Đáp án: C Thông hiểu 3.14 Lớp M có số electron tối đa bằng A. 3. B. 4. C. 9. D. 18. Phương pháp giải: Dựa vào - Số phân lớp trong một lớp electron: + 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó + 3 lớp sau (5, 6, 7) đều có 4 phân lớp - Cách gọi tên và đánh số các lớp
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7 - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau Lời giải chi tiết: - Lớp M có 3 phân lớp là s, p, d. - Các phân lớp s, p, d lần lượt có số AO tương ứng là 1, 3, 5 => Lớp M có tổng cộng (1 + 3 + 5).2 = 18 electron => Đáp án: D Thông hiểu 3.15 Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là A. 6. B. 8. C. 14. D. 16. Phương pháp giải: Dựa vào - Khi có cấu hình electron lớp ngoài cùng của nguyên tử + TH1: các lớp trước đó đã được lấp đầy electron + TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên Lời giải chi tiết: - Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron => Các lớp trước đó đã được lấp đầy electron - Lớp thứ nhất có 1 phân lớp s => Lớp thứ nhất có tối đa: 1.2 = 2 electron - Lớp thứ hai có 2 phân lớp s, p => Lớp thứ hai có tối đa: 1.2 + 3.2 = 8 electron => Nguyên tố X có tổng cộng: 2 + 8 + 6 = 16 electron => Đáp án: D Thông hiểu 3.16 Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp A. K. B. L. C. M. D. N. Phương pháp giải: Dựa vào - Số phân lớp trong một lớp electron: + 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó + 3 lớp sau (5, 6, 7) đều có 4 phân lớp - Cách gọi tên và đánh số các lớp
- Số electron tối đa trong mỗi phân lớp electron:
Lời giải chi tiết: - Lớp thứ nhất có 1 phân lớp s => Lớp thứ nhất có tối đa: 1.2 = 2 electron - Lớp thứ hai có 2 phân lớp s, p => Lớp thứ hai có tối đa: 1.2 + 3.2 = 8 electron - Lớp thứ ba có 3 phân lớp s, p, d => Lớp thứ ba có tối đa: 1.2 + 3.2 + 5.2 = 18 electron => Nguyên tố X có Z = 17 = 2 + 8 + 7 (electron) => Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp 3 => Đáp án: C Thông hiểu 3.17 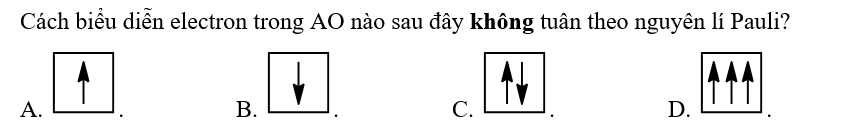 Phương pháp giải: Dựa vào nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau Lời giải chi tiết: Đáp án: D vì chứa 3 electron trong 1 AO Thông hiểu 3.18  Phương pháp giải: - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau - Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa Lời giải chi tiết: - Đáp án: B - Giải thích: + A và D vi phạm nguyên lí Pauli + C vi phạm quy tắc Hund Thông hiểu 3.19 Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s. Phương pháp giải: - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau - Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa Lời giải chi tiết:
Thông hiểu 3.20 Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund? Phương pháp giải: Dựa vào phân lớp p có 3 orbital Lời giải chi tiết: 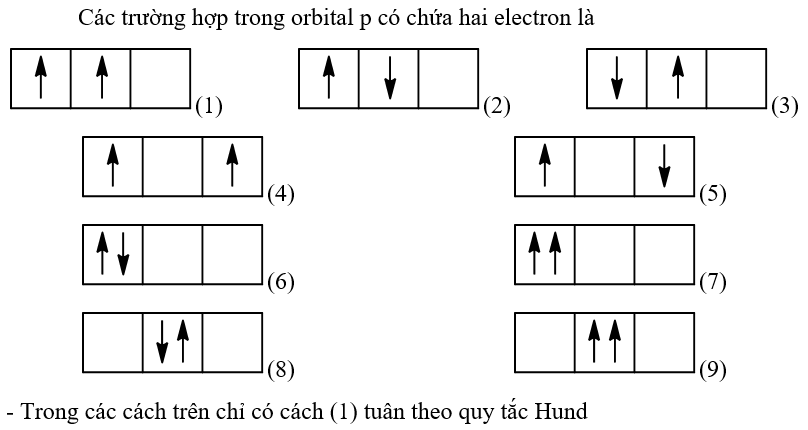 Thông hiểu 3.21 Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron. Phương pháp giải: Dựa vào: - Trong một lớp, các electron sẽ có mức năng lượng gần bằng nhau - Trong một phân lớp, các electron sẽ có mức năng lượng bằng nhau Lời giải chi tiết: Mối quan hệ về năng lượng: - Các electron thuộc cùng một phân lớp có mức năng lượng bằng nhau. Những electron chuyển động gần hạt nhân hơn, chiếm những mức năng lượng thấp hơn, tức là ở trạng thái bền hơn những electron chuyển động ở xa hạt nhân có năng lượng cao hơn. Mức năng lượng tăng dần theo thứ tự: s < p < d < f - Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau. Những electron ở lớp bên trong có năng lượng thấp hơn và liên kết với hạt nhân chặt chẽ hơn so với những electron ở lớp ngoài. Mức năng lượng tăng dần theo thứ tự: K < L < M < N < O < … Thông hiểu 3.22 Cho biết tổng số electron tối đa chứa trong: a) Phân lớp p; b) Phân lớp d; c) Lớp K; d) Lớp M. Phương pháp giải: - Số phân lớp trong một lớp electron: + 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó + 3 lớp sau (5, 6, 7) đều có 4 phân lớp - Cách gọi tên và đánh số các lớp
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7 - Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau Lời giải chi tiết: a) Phân lớp p có 3 orbital => Số electron tối đa trong phân lớp p là 3.2 = 6 electron b) Phân lớp d có 5 orbital => Số electron tối đa trong phân lớp d là 5.2 = 10 electron c) Lớp K có 1 phân lớp s => Số electron tối đa trong lớp K là 1.2 = 2 electron d) Lớp M có 3 phân lớp là s, p, d => Lớp M có tổng cộng (1 + 3 + 5).2 = 18 electron Vận dụng 3.23 Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17. Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì? Phương pháp giải: - Các bước viết cấu hình electron của nguyên tử + Bước 1: Xác định số electron của nguyên tử + Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử + Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron Lời giải chi tiết: - Nguyên tử của nguyên tố X có Z = 12 => Phân mức năng lượng electron: 1s22s22p63s2 => Cấu hình electron của nguyên tử X là 1s22s22p63s2 - Nguyên tử của nguyên tố Y có Z = 17 => Phân mức năng lượng electron: 1s22s22p63s23p5 => Cấu hình electron của nguyên tử Y là 1s22s22p63s23p5 - Nếu nguyên tử của nguyên tố X nhường đi hai electron thì cấu hình electron lớp ngoài cùng của X là 2s22p6 => Cấu hình giống khí hiếm Ne - Nếu nguyên tử của nguyên tố Y nhận thêm một electron thì cấu hình electron lớp ngoài cùng của Y là 3s23p6 => Cấu hình giống khí hiếm Ar Vận dụng 3.24 Viết cấu hình electron theo ô orbital của nguyên tử các nguyên tố có Z = 9, Z = 14 và Z = 21. Chúng là nguyên tố kim loại, phi kim hay khí hiếm? Phương pháp giải: - Các bước viết cấu hình electron của nguyên tử + Bước 1: Xác định số electron của nguyên tử + Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử + Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron - Dự đoán tính kim loại/ phi kim của nguyên tử + Đối với các nguyên tố nhóm A + Đối với các nguyên tố nhóm B (bao gồm các nguyên tố d và f): các nguyên tố nhóm B đều là kim loại và được gọi là các kim loại chuyển tiếp Lời giải chi tiết: - Nguyên tử có Z = 9 => Phân mức năng lượng electron: 1s22s22p5 => Cấu hình electron của nguyên tử là: 1s22s22p5 => Nguyên tử có Z = 9 có 7 electron lớp ngoài cùng nên là nguyên tố phi kim - Nguyên tử có Z = 14 => Phân mức năng lượng electron: 1s22s22p63s23p2 => Cấu hình electron của nguyên tử là: 1s22s22p63s23p2 => Nguyên tử có Z = 14 có 4 electron lớp ngoài cùng nên là nguyên tố phi kim - Nguyên tử có Z = 21 => Phân mức năng lượng electron: 1s22s22p63s23p64s23d1 => Cấu hình electron của nguyên tử là: 1s22s22p63s23p63d14s2 => Nguyên tử có Z = 21 thuộc nhóm B nên là nguyên tố kim loại Vận dụng 3.25 Hợp chất A có công thức M4X3. Tổng số hạt proton, electron và neutron trong phân tử A là 214. Tổng số hạt proton, neutron, electron của (M)4 nhiều hơn so với (X)3 trong A là 106. a) Xác định công thức hoá học của A. b) Viết cấu hình electron của các nguyên tử tạo nên A. Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử: - Tổng số hạt trong nguyên tử = p + n + e - Trong nguyên tử trung hòa về điện có p = e - Số hạt không mang điện = n - Proton mang điện tích dương, electron mang điện tích âm * Các bước viết cấu hình electron của nguyên tử + Bước 1: Xác định số electron của nguyên tử + Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử + Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron - Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p (áp dụng với các nguyên tố có p < 82) Lời giải chi tiết: - Gọi số hạt proton, electron và neutron trong nguyên tử M lần lượt là p1, e1, n1 - Có số hạt proton, electron và neutron trong X lần lượt là p2, e2, n2 - Tổng số hạt cơ bản trong phân tử M4X3 = 4.(p1 + e1 + n1) + 3.(p2 + e2 + n2)= 214 (1) - Tổng số hạt proton, neutron, electron của (M)4 nhiều hơn so với (X)3 trong A là 106 => 4.(p1 + e1 + n1) - 3.(p2 + e2 + n2)= 106 (2) => Từ (1), (2) giải hệ hai phương trình hai ẩn (p1 + e1 + n1) và (p2 + e2 + n2) ta có (p1 + e1 + n1) = 40, (p2 + e2 + n2) = 18 - Xét nguyên tử M: + Có 2p1 + n1 = 40 (do p1 = e1) + Có số p ≤ số n ≤ 1,5.số p => p1 ≤ 40 - 2p1 ≤ 1,5p1 => 403,5 ≤ p ≤ 403 => TH1: p1 = 12 => n1 = 16 (loại) => TH2: p1 = 13 => n1 = 14 (thỏa mãn) => M là Aluminium (Al) - Xét nguyên tử X: + Có 2p2 + n2 = 18 (do p2 = e2) + Có số p ≤ số n ≤ 1,5.số p => p2 ≤ 18 - 2p2 ≤ 1,5p2 => 183,5 ≤ p ≤ 183 => p1 = 6 => n1 = 6 => X là Carbon (C) => Vậy công thức hóa học của A là Al4C3 b) - Nguyên tử Al có Z = 13 => Phân mức năng lượng electron: 1s22s22p63s23p1 => Cấu hình electron của nguyên tử là: 1s22s22p63s23p1 - Nguyên tử C có Z = 6 => Phân mức năng lượng electron: 1s22s22p2 => Cấu hình electron của nguyên tử là: 1s22s22p2
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Click để xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
|