Bài 6. Giới thiệu về liên kết hóa học trang 37, 38, 39, 40, 41, 42, 43, 44 Khoa học tự nhiên 7 Chân trời sáng tạoTải vềỞ điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập, trong khi các nguyên tử của nguyên tố khác lại có xu hướng kết hợp với nhau. Trừ helium, vỏ nguyên tử của các nguyên tố còn lại ở Hình 6.1 có những điểm giống và khác nhau gì? Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium Tổng hợp đề thi học kì 2 lớp 7 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Khoa học tự nhiên...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 37 MĐ
Lời giải chi tiết: Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron => Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nhường, nhận hoặc dùng chung electron CH tr 37 CH
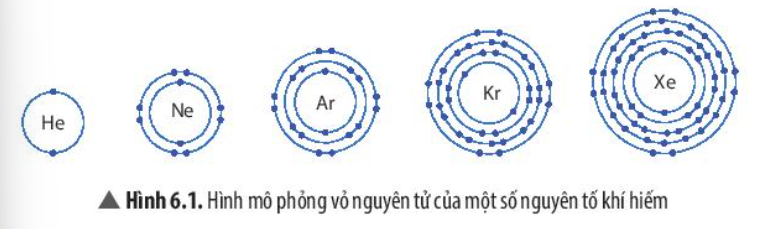
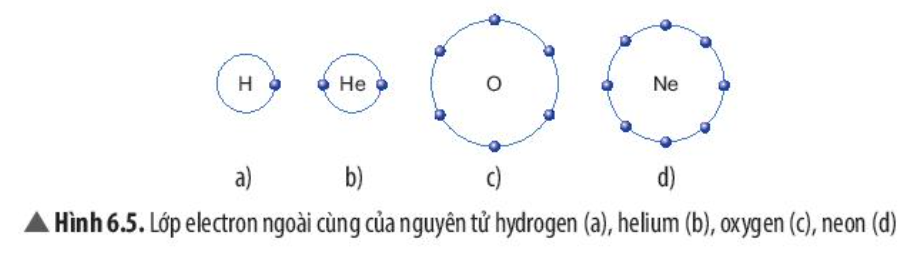
Phương pháp giải: - So sánh số electron lớp ngoài cùng và số lớp electron của các nguyên tử Lời giải chi tiết: - Giống nhau: Đều có 8 electron ở lớp ngoài cùng - Khác nhau: + Nguyên tử Ne có 2 lớp electron + Nguyên tử Ar có 3 lớp electron + Nguyên tử Kr có 4 lớp electron + Nguyên tử Xe có 5 lớp electron CH tr 38 CH
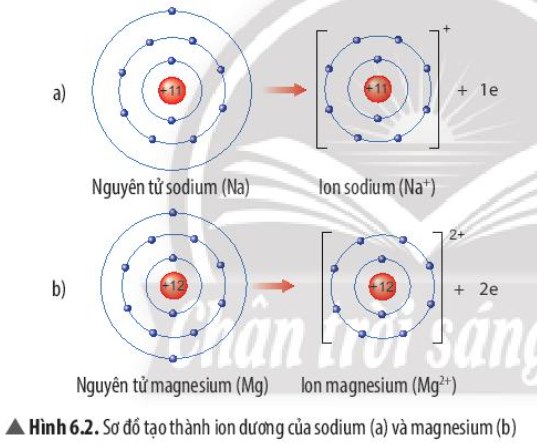
Phương pháp giải: - Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng - Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng Lời giải chi tiết: - Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+ - Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+ => Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng => Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne) CH tr 38 LT
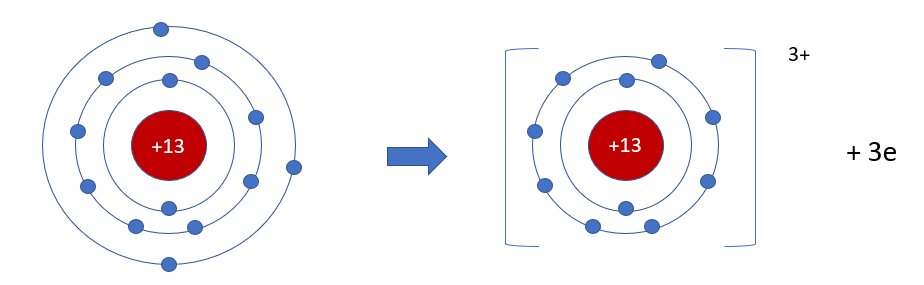
Phương pháp giải: - Aluminium là nguyên tố kim loại => Có xu hướng nhường electron - Aluminium có 3 electron ở lớp ngoài cùng => Nhường đi 3 electron Lời giải chi tiết: - Trong bảng tuần hoàn, aluminium thuộc ô màu xanh nằm ở + Nhóm IIIA => Có 3 electron ở lớp ngoài cùng + Chu kì 3 => Có 3 lớp electron - Nguyên tố aluminium là nguyên tố kim loại có 3 electron ở lớp ngoài cùng => Có xu hướng nhường đi 3 electron tạo thành ion dương aluminum (Al3+) - Sơ đồ tạo thành ion aluminium:
CH tr 38 CH
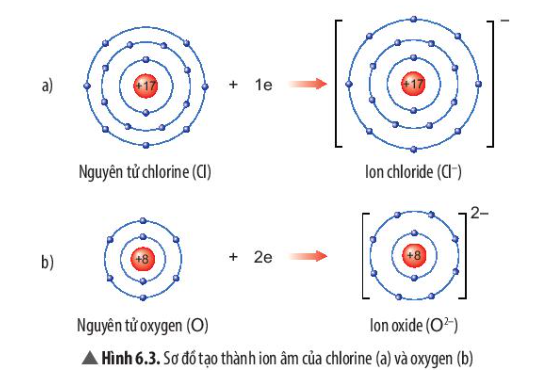
Phương pháp giải: - Nguyên tử Cl nhận thêm 1 electron ở lớp ngoài cùng - Nguyên tử Mg nhận thêm 2 electron ở lớp ngoài cùng Lời giải chi tiết: - Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl- - Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2- - Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng => Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne) - Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng => Giống sự phân bố electron của nguyên tử Argon (Ar) CH tr 39 LT
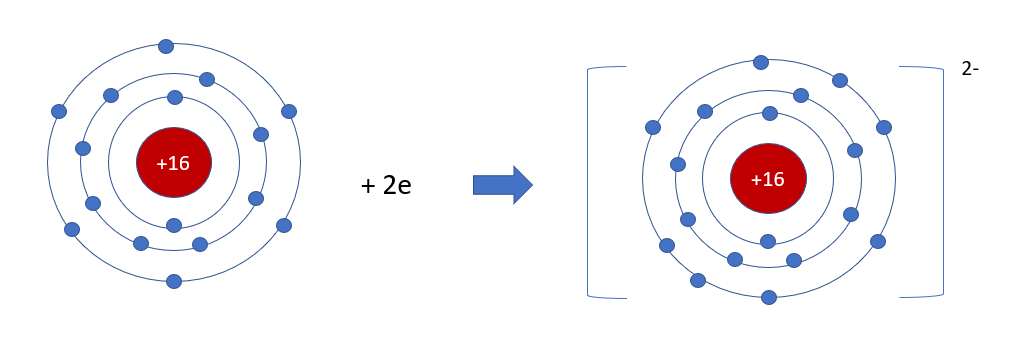
Phương pháp giải: - Sulfur là nguyên tố phi kim => Có xu hướng nhận electron - Aluminium có 6 electron ở lớp ngoài cùng => Nhận thêm 2 electron Lời giải chi tiết: - Trong bảng tuần hoàn, sulfur thuộc ô màu hồng nằm ở + Nhóm VIA => Có 6 electron ở lớp ngoài cùng + Chu kì 3 => Có 3 lớp electron - Nguyên tố sulfur là nguyên tố phi kim có 6 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 2 electron tạo thành ion âm sulfide (S2-) - Sơ đồ tạo thành ion sulfide:
CH tr 39 CH
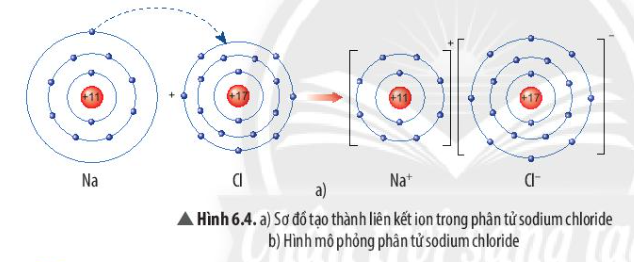
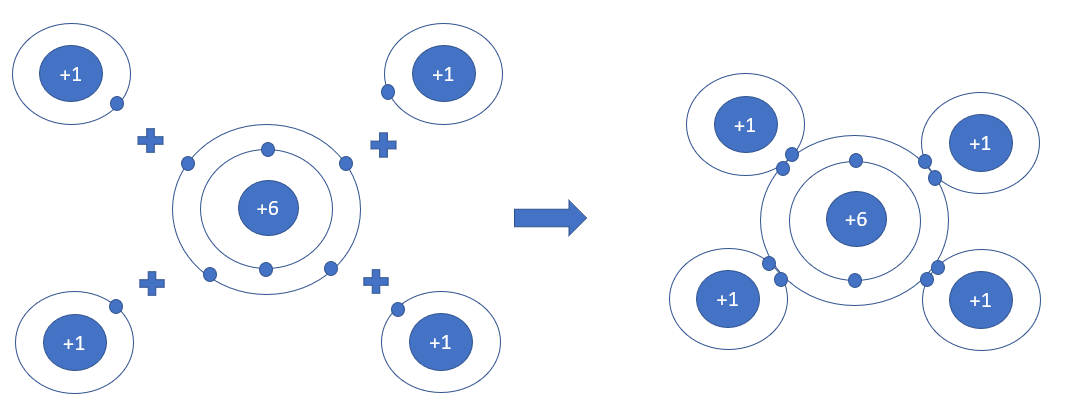
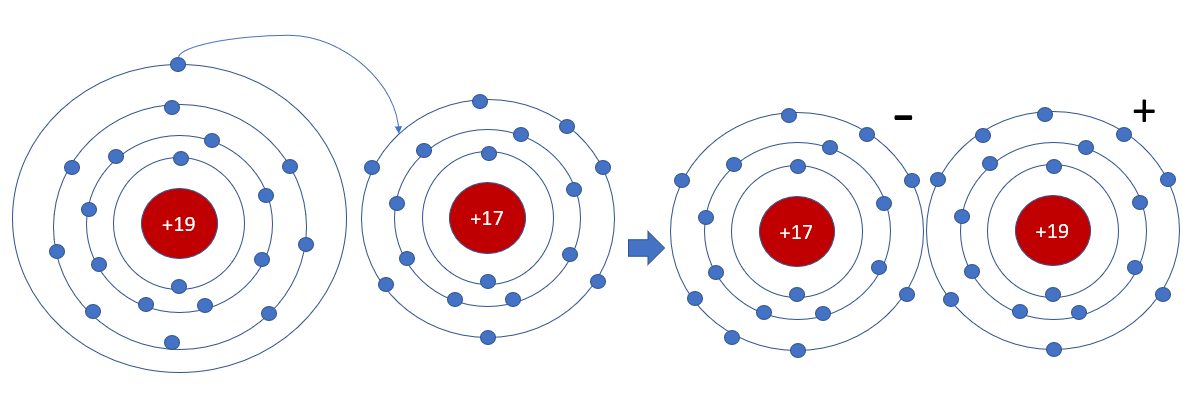
Phương pháp giải: - Nguyên tử Na nhường 1 electron cho nguyên tử Cl - Nguyên tử Cl nhận thêm 1 electron từ nguyên tử Na Lời giải chi tiết: - Nguyên tử Na nhường 1 electron cho nguyên tử Cl, tạo thành ion dương - Nguyên tử Cl nhận 1 electron từ nguyên tử Na, tạo thành ion âm => Ion dương và ion âm mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion - Ứng dụng của sodium chloride + Sát trùng vết thương, cung cấp muối khoáng cho cơ thể bị thiếu nước + Dùng làm gia vị, bảo quản thực phẩm, khử mùi, kiểm soát quá trình lên men + Trị cảm lạnh, tiêu độc, làm trắng, chữa viêm, hôi miệng + Dùng chăm sóc sức khỏe gia súc, gia cầm, làm thành phần phân bón cho cây trồng CH tr 39 LT
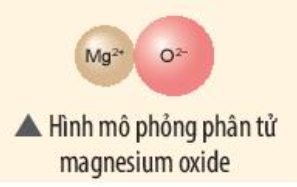
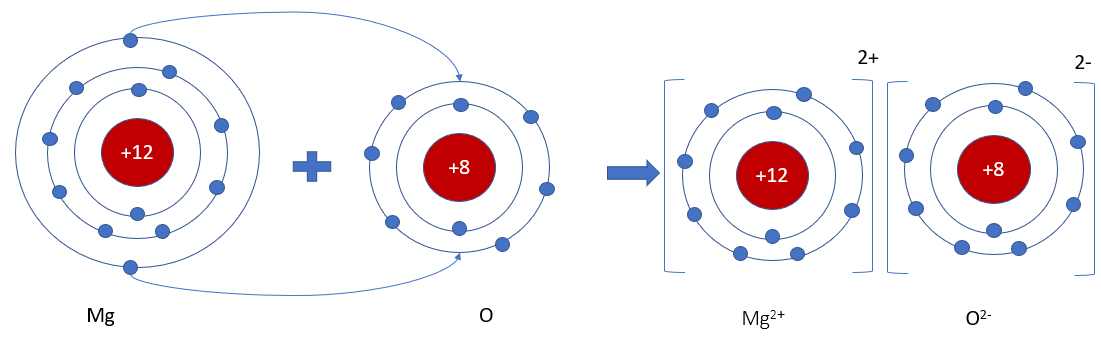
Phương pháp giải: Magnesium oxide được tạo thành từ ion Mg2+ và ion O2- => Nguyên tử Mg đã nhường 2 electron cho nguyên tử O Lời giải chi tiết: - Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+ - Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2- => Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion - Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:
CH tr 39 VD
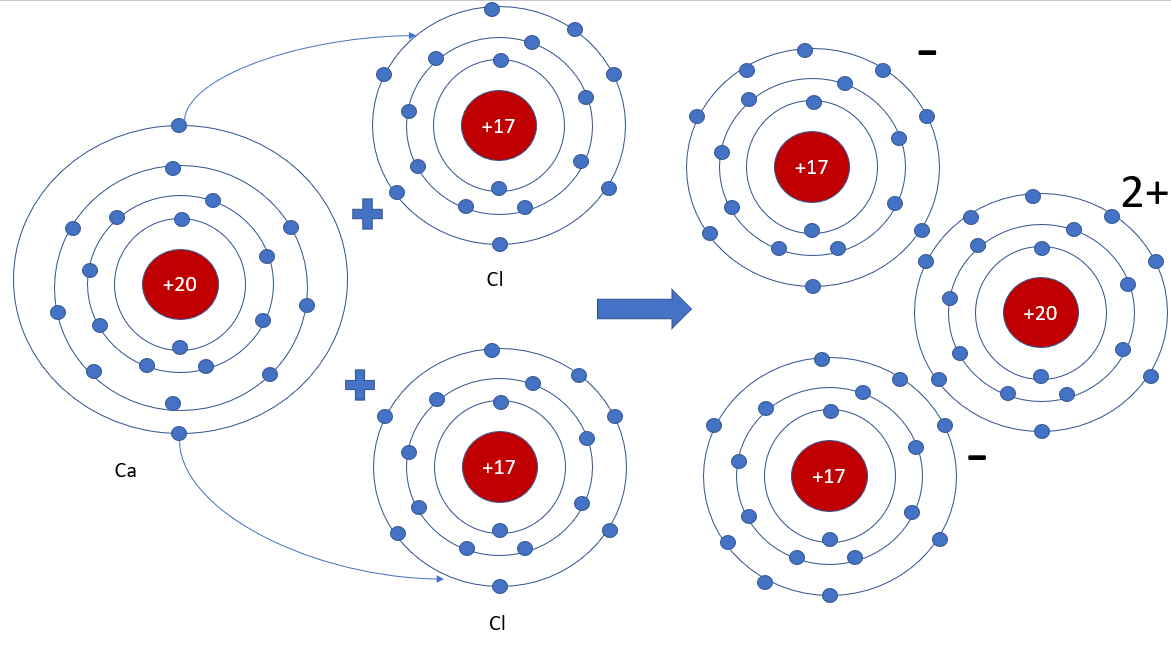
Phương pháp giải: - Calcium chloride gồm 1 nguyên tử Ca và 2 nguyên tử Cl - Mỗi nguyên tử Cl nhận 1 electron của nguyên tử Ca => Tạo thành ion Ca2+ và ion Cl- Lời giải chi tiết: - Ứng dụng của calcium chloride: + Tác nhân sấy khô hoặc chất hút ẩm + Hợp chất làm tan băng + Chất điện giải, sản xuất các loại đồ uống + Chất phụ gia trong quá trình hóa dẻo, dùng làm chất tải lạnh cho kem + Ứng dụng trong hệ thống tiêu nước và xử lý nước thải công nghiệp - Sơ đồ tạo thành liên kết trong phân tử calcium chloride:
CH tr 40 CH
Phương pháp giải: - Hydrogen gần với nguyên tố khí hiếm Helium - Oxygen gần với nguyên tố khí hiếm Neon Lời giải chi tiết: - Hydrogen gần với nguyên tố khí hiếm Helium - H có 1 electron lớp ngoài cùng, He có 2 electron lớp ngoài cùng => Nguyên tử hydrogen có xu hướng nhận thêm 1 electron để đạt cấu hình của Helium - Oxygen gần với nguyên tố khí hiếm Neon - H có 6 electron lớp ngoài cùng, Ne có 8 electron lớp ngoài cùng => Nguyên tử Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của Neon CH tr 40 CH
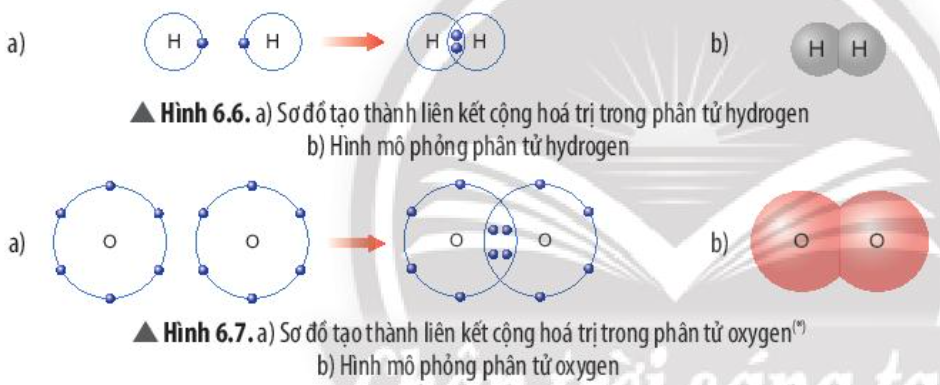
Phương pháp giải: Số electron ngoài cùng của mỗi nguyên tử = tổng số electron dùng chung giữa các nguyên tử + số electron còn lại của mỗi nguyên tử Lời giải chi tiết: - Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng => Giống cấu hình electron của nguyên tử khí hiếm Helium - Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng => Giống cấu hình electron của nguyên tử khí hiếm Neon CH tr 40 CH
Phương pháp giải: - Nguyên tử H có 1 electron ở lớp ngoài cùng, cần thêm 1 electron để đạt cấu hình electron của He => Góp 1 electron tạo 1 cặp electron dùng chung - Nguyên tử O có 6 electron ở lớp ngoài cùng, cần thêm 2 electron để đạt cấu hình electron của Ne => Góp chung 2 electron tạo 2 cặp electron dùng chung Lời giải chi tiết: - Xét phân tử hydrogen (gồm 2 nguyên tử H): Mỗi nguyên tử H bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung => Hình thành liên kết cộng hóa trị - Xét phân tử oxygen (gồm 2 nguyên tử O): Mỗi nguyên tử O bỏ ra 2 electron để tạo thành 2 cặp electron dùng chung => Hình thành liên kết cộng hóa trị CH tr 41 CH
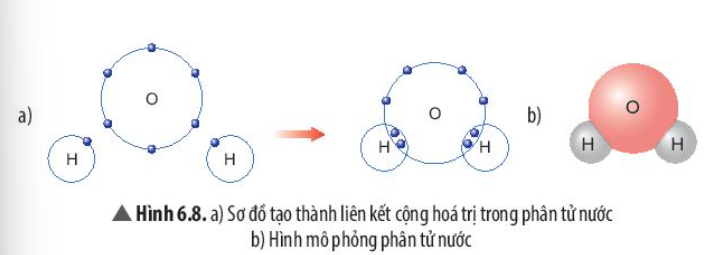
Phương pháp giải: Sau khi hình thành liên kết, số electron ngoài cùng của mỗi nguyên tử = tổng số electron dùng chung giữa các nguyên tử + số electron còn lại của mỗi nguyên tử Lời giải chi tiết: - Số electron dùng chung của nguyên tử H và O là 4 - Trong phân tử nước: + Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne + Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He CH tr 41 CH
Phương pháp giải: Mỗi nguyên tử H bỏ ra 1 electron để góp chung với nguyên tử O Lời giải chi tiết: Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. => Giữa nguyên tử O và nguyên tử H có 1 đôi electron dùng chung - Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước CH tr 41 LT
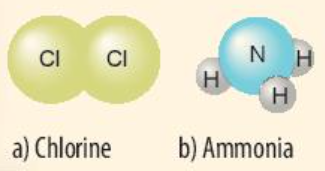
Phương pháp giải: - Nguyên tử Cl có 7 electron lớp ngoài cùng => Cần nhận thêm 1 electron => Bỏ ra 1 electron để góp chung - Nguyên tử H và nguyên tử N đều là phi kim + Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron + Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần nhận thêm 3 electron Lời giải chi tiết: - Xét phân tử khí chlorine
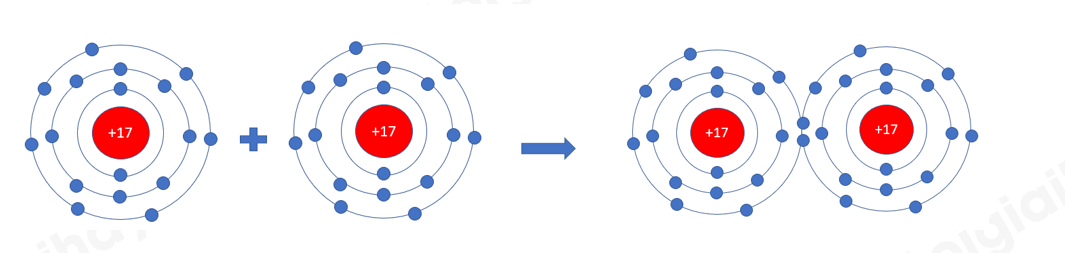
=> Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành 1 cặp electron dùng chung - Xét phân tử khí amonia
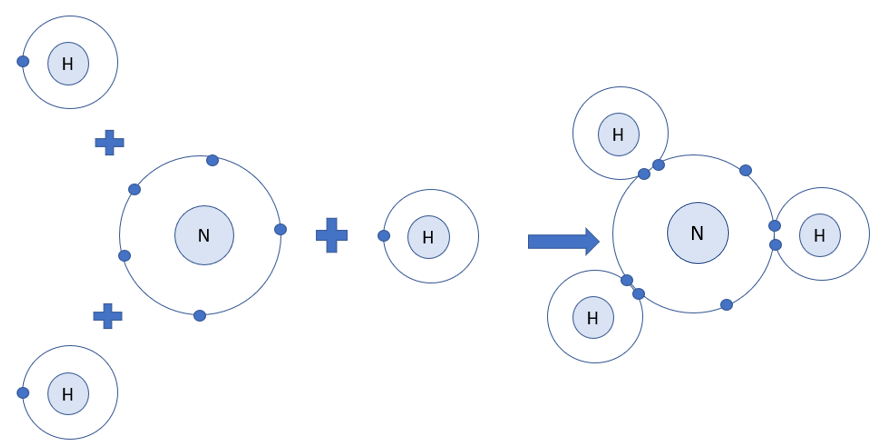
- Nguyên tử H có 1 electron ở lớp ngoài cùng - Nguyên tử N có 5 electron ở lớp ngoài cùng => Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm => Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung CH tr 41 VD
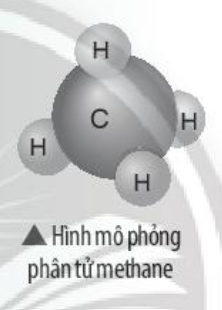
Phương pháp giải: - Nguyên tử H và nguyên tử C đều là phi kim + Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron + Nguyên tử N có 4 electron ở lớp ngoài cùng => Cần nhận thêm 4 electron Lời giải chi tiết: - Nguyên tử H có 1 electron ở lớp ngoài cùng - Nguyên tử C có 4 electron ở lớp ngoài cùng => Nguyên tử H cần thêm 1 electron và N cần thêm 4 electron để đạt cấu hình electron bền vững của khí hiếm => Khi 4 nguyên tử H và 1 nguyên tử C liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử C góp ra 4 electron để tạo ra 4 đôi electron dùng chung - Sơ đồ:
- Ứng dụng của methane: + Methane cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu + Là nguyên liệu để điều chế hydrogen + Điều chế bột than và nhiều chất khác CH tr 41 CH
Phương pháp giải: - Dựa vào nguyên tử => ion tương ứng - Quan sát Hình 6.9 => Thể của các chất ở điều kiện thường Lời giải chi tiết: a) Phân tử Sodium chloride gồm 2 nguyên tố là Na và Cl + Nguyên tố Na có 1 electron ở lớp ngoài cùng => Có xu hướng nhường 1 electron => Ion tương ứng là Na+ + Nguyên tố Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận 1 electron => Ion tương ứng là Cl- b) Phân tử Calcium chloride gồm 2 nguyên tố là Ca và Cl + Nguyên tố Ca có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron => Ion tương ứng là Ca2+ + Nguyên tố Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận 1 electron => Ion tương ứng là Cl- c) Phân tử Magnesium oxide gồm 2 nguyên tố là Mg và O + Nguyên tố Mg có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron => Ion tương ứng là Mg2+ + Nguyên tố O có 6 electron ở lớp ngoài cùng => Có xu hướng nhận 2 electron => Ion tương ứng là O2- - Ở điều kiện thường, các chất đều ở thể rắn CH tr 42 CH
Phương pháp giải: Quan sát Hình 6.10 và nhận xét thể của các chất Lời giải chi tiết: Quan sát Hình 6.10: + Đường tinh luyện: thể rắn + Ethanol: thể lỏng + Carbon dioxide: thể khí CH tr 42 CH
Phương pháp giải: Một số chất cộng hóa trị là: khí oxygen, nước, khí amonia, hydrogen chloride, methane, nitrogen oxide Lời giải chi tiết: Một số chất cộng hóa trị và thể của chúng ở điều kiện thường là: + Khí oxygen: thể khí + Nước: thể lỏng + Amonia: thể khí + Hydrogen chloride: thể lỏng + Methane: thể khí + Nitrogen oxide: thể khí + Gỗ (cenlulose): thể rắn CH tr 42 LT
Phương pháp giải: - Chất ion là chất được tạo bởi các ion dương và ion âm (giữa kim loại và phi kim) - Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị (giữa các phi kim) - Nguyên tử ở nhóm cao nhất thì có số electron lớp ngoài cùng nhiều nhất Lời giải chi tiết: a) - Hơi nước: gồm 2 nguyên tố là H (phi kim) và O (phi kim) => Chất cộng hóa trị - Sodium chloride: gồm 2 nguyên tố là Na (kim loại) và Cl (phi kim) => Chất ion - Potassium chloride: gồm 2 nguyên tố là K (kim loại) và Cl (phi kim) => Chất ion - Carbon dioxide: gồm 2 nguyên tố là C (phi kim) và O (phi kim) => Chất cộng hóa trị - Sulfur dioxide: gồm 2 nguyên tố là S (phi kim) và O (phi kim) => Chất cộng hóa trị b) Các nguyên tố xuất hiện trong các chất trên là: H, O, Na, Cl, K, C, S + Nguyên tử H ở nhóm IA => Có 1 electron ở lớp ngoài cùng + Nguyên tử O ở nhóm VIA => Có 6 electron ở lớp ngoài cùng + Nguyên tử Na ở nhóm IA => Có 1 electron ở lớp ngoài cùng + Nguyên tử Cl ở nhóm VIIA => Có 7 electron ở lớp ngoài cùng + Nguyên tử K ở nhóm IA => Có 1 electron ở lớp ngoài cùng + Nguyên tử C ở nhóm IVA => Có 4 electron ở lớp ngoài cùng + Nguyên tử S ở nhóm VIA => Có 6 electron ở lớp ngoài cùng => Nguyên tử của nguyên tố Chlorine có số electron ở lớp ngoài cùng nhiều nhất CH tr 42 CH
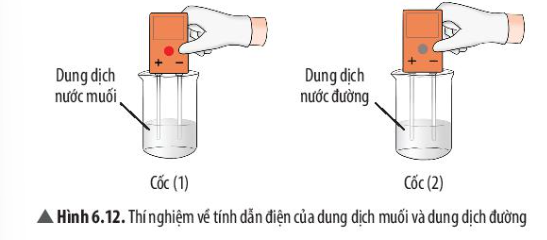
Phương pháp giải: - Quan sát độ tan và độ dẫn điện của đường và muối ăn Lời giải chi tiết:
CH tr 43 CH
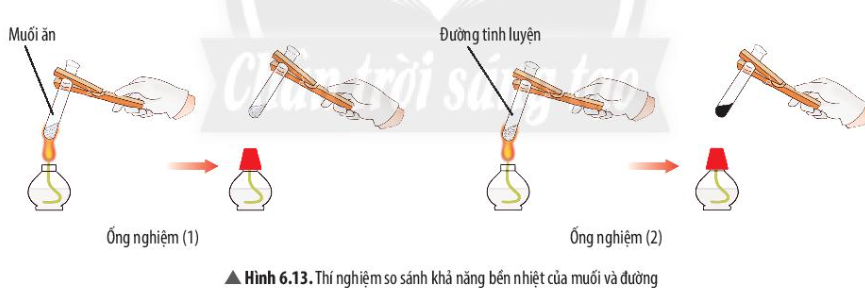
Phương pháp giải: Ống nghiệm nào có sự tạo thành chất mới => Chất đó kém bền nhiệt hơn Lời giải chi tiết: - Muối không có sự thay đổi sau khi đun nóng - Đường (màu trắng) chuyển thành chất khác có màu đen => Ống nghiệm 2 (đường) có sự tạo thành chất mới => Muối bền nhiệt hơn CH tr 44 LT
Phương pháp giải: - Chất cộng hóa trị: tồn tại ở cả 3 thể trong điều kiện thường, có nhiệt độ sôi và nhiệt độ nóng chảy thấp, không dẫn điện - Chất ion: chỉ tồn tại ở thể rắn trong điều kiện thường, có nhiệt độ sôi và nhiệt độ nóng chảy cao, dẫn điện tốt Lời giải chi tiết: - Chất A: tồn tại ở thể rắn, nhiệt độ sôi và nhiệt độ nóng chảy cao, dẫn điện tốt => Chất ion - Chất B: tồn tại ở thể lỏng, nhiệt độ sôi và nhiệt độ nóng chảy thấp, không dẫn điên => Chất cộng hóa trị CH tr 44 VD
Phương pháp giải: Tham khảo qua sách, báo, tivi, internet… Lời giải chi tiết: - Thành phần của oresol: + Sodium chloride: Chất ion + Potassium chloride: Chất ion + Glucose khan: Chất cộng hóa trị + Sodium bicarbonate: Chất ion - Trong trường hợp không có oresol, có thể hòa tan nửa thìa muối nhỏ (Sodium chloride) và 6 thìa nhỏ đường (thành phần có glucose) trong 1 lít nước đun sôi để nguội. Hoặc có thể sử dụng nước dừa, nước cơm (thành phần có glucose) thêm một chút xíu muối (sodium chloride) để thay thế trong trường hợp khẩn cấp CH tr 44 BT1
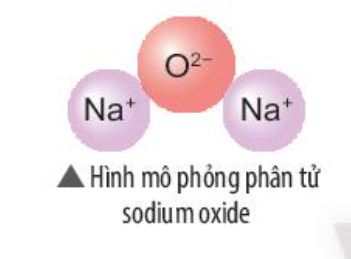
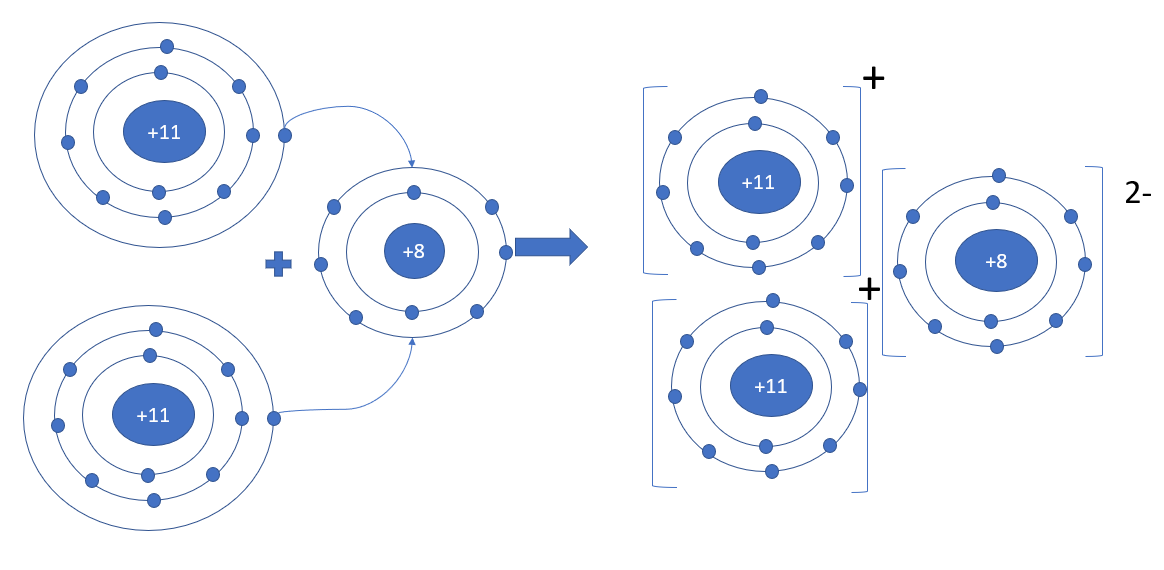
Phương pháp giải: - Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim) - Nguyên tử Na nhường 1 electron => Ion Na+ - Nguyên tử O nhận 2 electron => Ion O2- Lời giải chi tiết: - Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim) => Liên kết ion - Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+ - Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-
CH tr 44 BT2
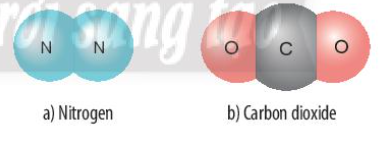
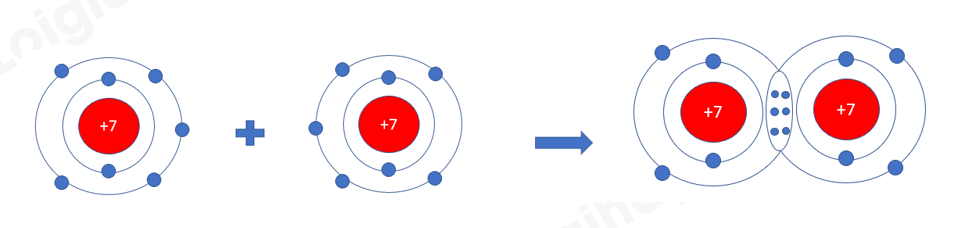
Phương pháp giải: - N nằm ở ô số 7 - C nằm ở ô số 6 - O nằm ở ô số 8 Lời giải chi tiết: - Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm - Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm - Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm a) Xét phân tử Nitrogen: gồm 2 nguyên tử N => Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
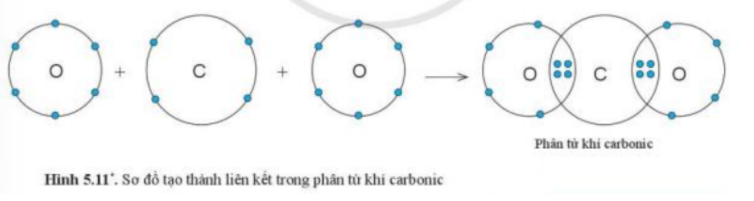
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O => Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron => Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung CH tr 44 BT3
Phương pháp giải: - Chất ion là chất được tạo bởi các ion dương và ion âm (giữa kim loại và phi kim) - Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị (giữa các phi kim) Lời giải chi tiết: - Potassium chloride gồm 2 nguyên tử: K (kim loại) và Cl (phi kim) => Liên kết ion - Nguyên tử K nhường 1 electron cho nguyên tử Cl
Lý thuyết >> Xem chi tiết: Lý thuyết bài 6: Giới thiệu về liên kết hóa học - KHTN 7 Chân trời sáng tạo
|