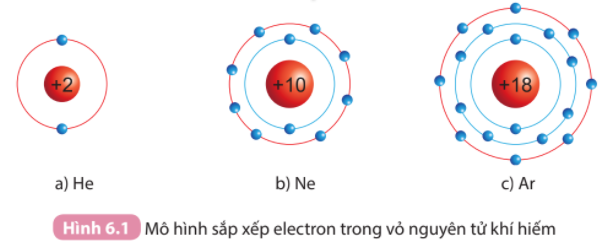
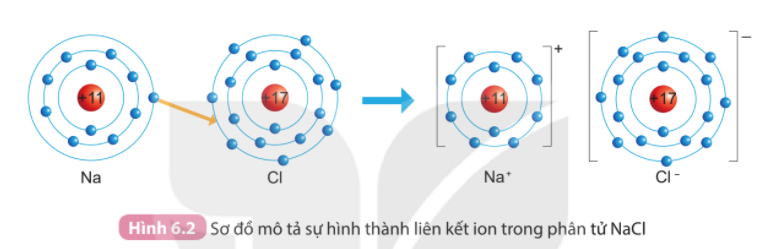
Bài 6. Giới thiệu về liên kết hóa học trang 36, 37, 38, 39 Khoa học tự nhiên 7 Kết nối tri thứcTải vềTrong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững Quan sát Hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar 1. Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-. Tổng hợp đề thi học kì 2 lớp 7 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Khoa học tự nhiên...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 36 MĐ
Lời giải chi tiết: Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron CH tr 36 CH
Phương pháp giải: - Electron là các quả cầu màu xanh nằm trên đường tròn bao quanh hạt nhân - Lớp ngoài cùng là đường tròn màu đỏ Lời giải chi tiết: - He có 2 electron ở lớp vỏ ngoài cùng - Ne có 8 electron ở lớp vỏ ngoài cùng - Ar có 8 electron ở lớp vỏ ngoài cùng => Nguyên tố He có số electron ở lớp vỏ ngoài cùng ít hơn. Nguyên tố Ne và Ar có số electron ở lớp vỏ ngoài cùng bằng nhau (đều bằng 8) CH tr 37 CH
Phương pháp giải: 1. Quan sát Hình 6.2, đếm quả cầu màu xanh ở đường tròn ngoài cùng của nguyên tử Na, Cl, ion Na+, ion Cl- 2. Quan sát Hình 6.3, đếm tổng các quả cầu màu xanh của nguyên tử Mg và ion Mg2+ => Nguyên tử Mg đã nhường hay nhận bao nhiêu electron Lời giải chi tiết: 1. - Nguyên tử Na có 1 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Na+ (sau khi nguyên tử Na cho đi 1 electron lớp ngoài cùng) => có 8 electron ở lớp vỏ ngoài cùng (lớp 2) - Nguyên tử Cl có 7 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Cl- (sau khi nguyên tử Cl nhận thêm 1 electron lớp ngoài cùng) => có 8 electron ở lớp vỏ ngoài cùng (lớp 3) 2. - Nguyên tử Mg có tất cả 12 electron. Ion Mg2+ có tất cả 10 electron => Mất đi 2 electron ở lớp vỏ ngoài cùng => Nguyên tử Mg đã nhường đi 2 electron ở lớp vỏ ngoài cùng CH tr 38 CH
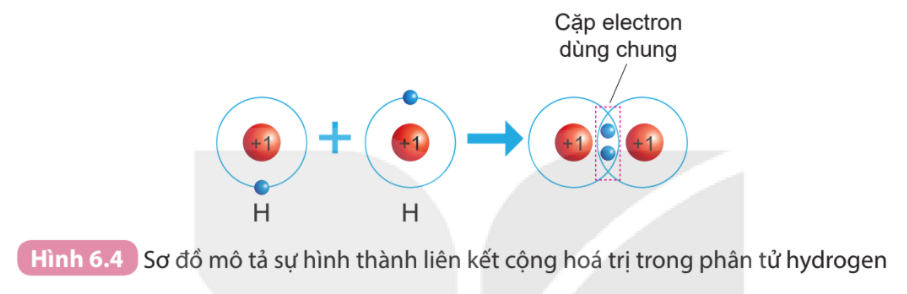
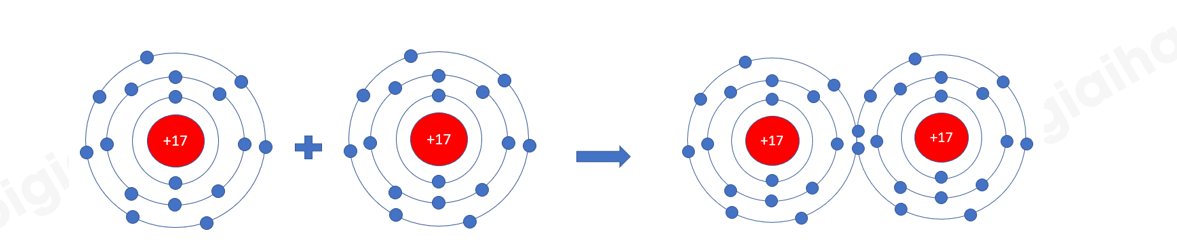
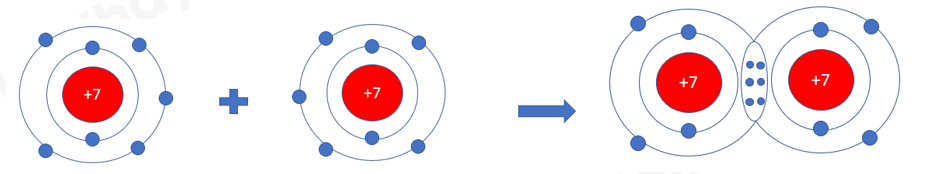
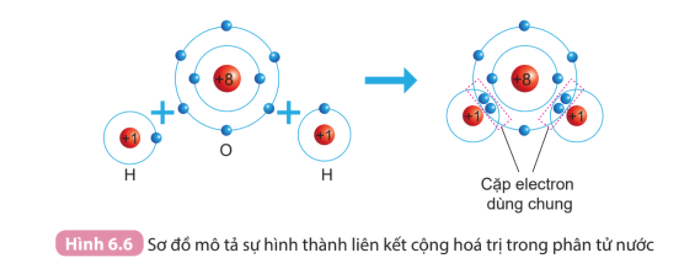
Phương pháp giải: 1. Đếm quả cầu màu xanh ở lớp vỏ ngoài cùng của nguyên H và O trước và sau khi tạo thành liên kết cộng hóa trị 2. - Chlorine có 7 electron ở lớp vỏ ngoài cùng => Góp chung 1 electron tạo thành 1 cặp electron dùng chung - Nitrogen có 5 electron ở lớp vỏ ngoài cùng => Góp chung 3 electron tạo thành 3 cặp electron dùng chung Lời giải chi tiết: 1. - Xét Hình 6.4: + Trước khi tạo thành liên kết cộng hóa trị, H có 1 electron ở lớp vỏ ngoài cùng + Sau khi tạo thành liên kết cộng hóa trị, H có 2 electron ở lớp vỏ ngoài cùng - Xét Hình 6.5: + Trước khi tạo thành liên kết cộng hóa trị, O có 6 electron ở lớp vỏ ngoài cùng (lớp 2) + Sau khi tạo thành liên kết cộng hóa trị, O có 8 electron ở lớp vỏ ngoài cùng (lớp 2) 2. - Xét phân tử khí chlorine => Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành 1 cặp electron dùng chung - Xét phân tử khí nitrogen
=> Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử oxygen, 2 nguyên tử N đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 3 electron tạo thành 3 cặp electron dùng chung CH tr 39 CH
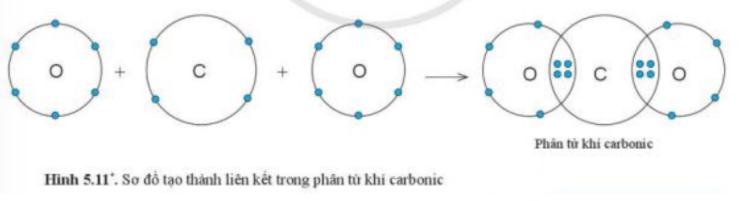
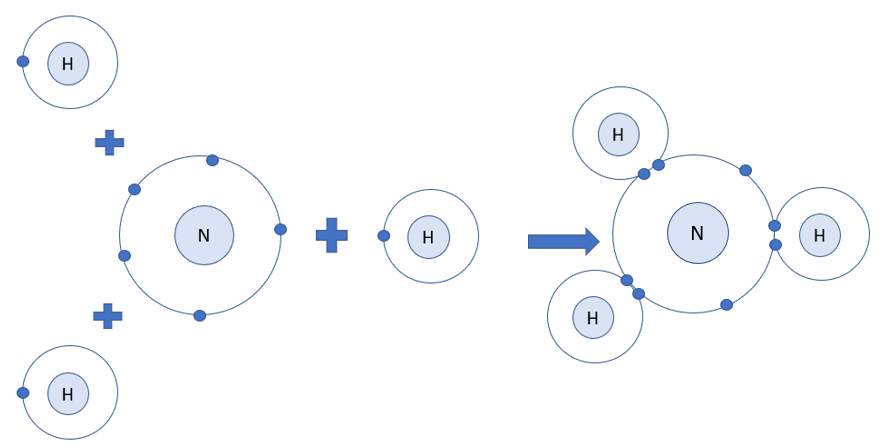
Phương pháp giải: 1. Khi đó nguyên tử O có 10 elecrton (2 electron ở lớp thứ nhất, 8 electron ở lớp thứ 2) 2. - Phân tử carbon dioxide: nguyên tử C sẽ bỏ ra 4 electron để góp chung với 2 nguyên tử O - Phân tử amonia: nguyên tử N sẽ bỏ ra 3 elctron để góp chung với 3 nguyên tử H Lời giải chi tiết: 1. - Khi nguyên tử O liên kết với 2 nguyên tử H bằng cách góp chung electron thì nguyên tử O có 10 electron (2 electron lớp thứ nhất, 8 electron ở lớp thứ 2) => Giống cấu hình electron của khí hiếm Neon (Ne) 2. - Phân tử carbon dioxide:
- Phân tử amonia:
CH tr 39 Em có thể
Phương pháp giải: - Các hợp chất ion như muối ăn,… là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch dẫn được điện - Các hợp chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp Lời giải chi tiết: - Muối ăn là hợp chất ion, được hình thành bởi lực hút giữa 2 ion trái dấu là Na+ và Cl- (liên kết bền vững) => Trong tự nhiên, muối ăn ở dạng rắn, khó nóng chảy, khó bay hơi - Đường ăn, nước đá, nước là các hợp chất cộng hóa trị (liên kết kém bền hơn) => Ở thể rắn thì dễ nóng chảy, ở thể lỏng thì dễ bay hơi Lý thuyết >> Xem chi tiết: Lý thuyết bài 6: Giới thiệu về liên kết hóa học - KHTN 7 Kết nối tri thức
|