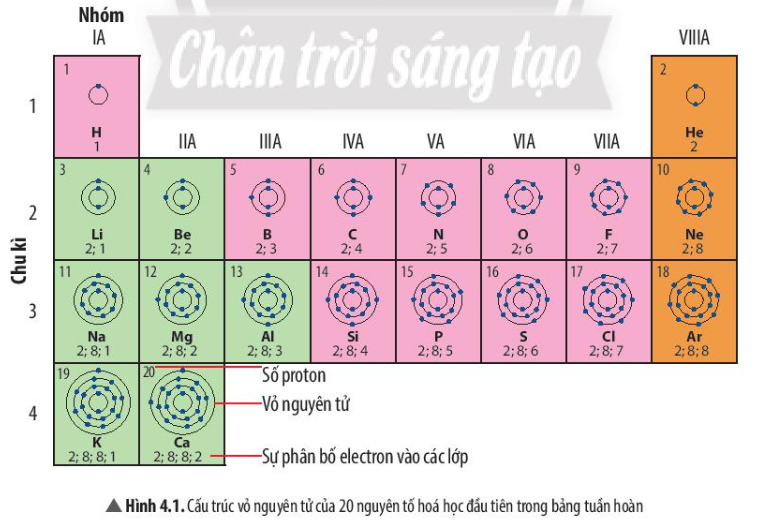
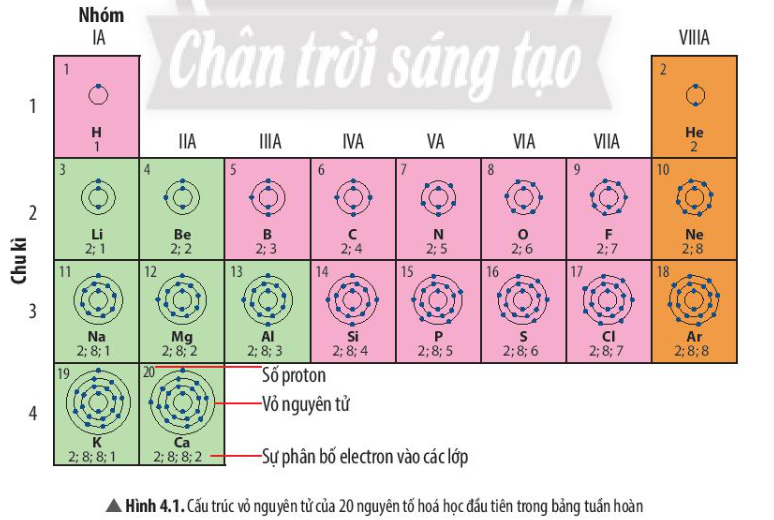
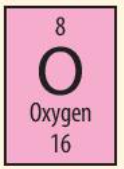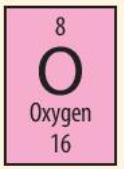Bài 4. Sơ lược bảng tuần hoàn các nguyên tố hóa học trang 22, 23, 24, 25, 26, 27, 28, 29, 30 Khoa học tự nhiên 7 Chân trời sáng tạoTải vềKhi nghiên cứu quy luật biến đổi tính chất của các nguyên tố, các nhà khoa học đã tìm các sắp xếp các nguyên tố vào một bảng theo nguyên tắc nhất định, gọi là bảng tuần hoàn các nguyên tố hóa học Quan sát Hình 4.1, em hãy cho biết a) nguyên tử của những nguyên tố nào có cùng số lớp electron b) nguyên tử của những nguyên tố nào có số electron ở lớp ngoài cùng bằng nhau Tổng hợp đề thi học kì 2 lớp 7 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Khoa học tự nhiên...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 22 MĐ
Lời giải chi tiết: - Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn: + Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử + Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng + Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột - Từ bảng tuần hoàn các nguyên tố hóa học, ta biết được các thông tin: + Số hiệu nguyên tử + Kí hiệu nguyên tố hóa học + Tên nguyên tố + Khối lượng nguyên tử CH tr 23 CH
Phương pháp giải: - Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng - Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành 1 cột Lời giải chi tiết: a) Những nguyên tố nằm ở cùng 1 chu kì có số lớp electron bằng nhau - Ví dụ: Các nguyên tố ở chu kì 1 có 1 lớp electron, các nguyên tố ở chu kì 2 có 2 lớp electron, nguyên tố ở chu kì 3 có 3 lớp electron b) Những nguyên tố nằm ở cùng 1 nhóm có số electron ở lớp ngoài cùng bằng nhau - Ví dụ: Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng, nguyên tố nhóm VIIA có 7 electron ở lớp ngoài cùng - Trừ nguyên tố He nằm ở nhóm VIIIA nhưng có 2 electron ở lớp ngoài cùng CH tr 23 LT
Phương pháp giải: - Dựa vào điện tích hạt nhân, số electron lớp ngoài cùng, số lớp electron Lời giải chi tiết: - Cơ sở để xếp các nguyên tố hóa học trong bảng tuần hoàn là: + Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử + Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng + Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột CH tr 23 CH
Phương pháp giải: - Gồm các nguyên tố hóa học, mỗi nguyên tố nằm ở 1 ô - Nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng Lời giải chi tiết: - Bảng tuần hoàn gồm các nguyên tố hóa học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm - Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn CH tr 25 CH
Phương pháp giải: Số hiệu nguyên tử = số đơn vị điện tích hạt nhân Lời giải chi tiết: - Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton trong hạt nhân = số electron trong nguyên tử = số thứ tự của nguyên tố trong bảng tuần hoàn - Ví dụ: Nguyên tử hydrogen có số hiệu nguyên tử là 1 => Nguyên tố hydrogen ở ô số 1 trong bảng tuần hoàn, điện tích hạt nhân là +1 (do có 1 proton trong hạt nhân) cà có 1 electron trong nguyên tử CH tr 25 LT
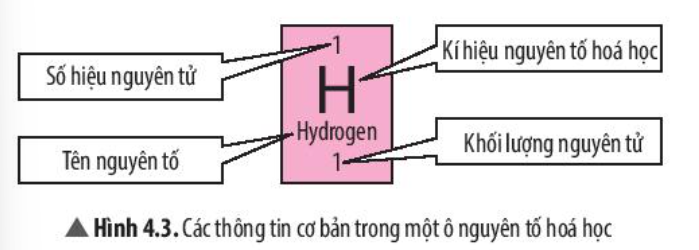
Phương pháp giải: Tham khảo Hình 4.3
Lời giải chi tiết: Cho biết: + Nguyên tố oxygen có kí hiệu hóa học là O + Khối lượng nguyên tử oxygen là 16 + Số hiệu nguyên tử là 8 => Nguyên tố oxygen ở ô số 8 trong bảng tuần hoàn, điện tích hạt nhân là +8 (do có 8 proton trong hạt nhân) và có 8 electron trong nguyên tử CH tr 25 CH
Phương pháp giải: a) Quan sát Hình 4.4 để trả lời câu hỏi b) Trong cùng 1 chu kì, xét từ trái qua phải, số electron lớp ngoài cùng tăng dần từ 1 đến 8 Lời giải chi tiết: a) Mỗi chu kì bắt đầu từ nhóm IA và kết thúc ở nhóm VIIIA b) - Trong 1 chu kì, xét từ trái qua phải, số electron ở lớp ngoài cùng tăng dần từ 1 đến 8 - Khi bắt đầu 1 chu kì mới, nguyên tố đầu tiên có 1 electron ở lớp ngoài cùng tương ứng với nhóm IA và tăng dần đến 8 tương ứng với nhóm VIIIA CH tr 26 CH
Phương pháp giải: Nhóm là tập hợp các nguyên tố có tính chất hóa học tương tự nhau và được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân Lời giải chi tiết: - Các nguyên tố trong cùng 1 nhóm (cùng 1 cột dọc) sẽ có tính chất hóa học tương tự nhau => Các nguyên tố nhóm IA (trừ H) đều là nguyên tố kim loại hoạt động mạnh Các nguyên tố nhóm VIIA đều là nguyên tố phi kim hoạt động mạnh Các nguyên tố nhóm VIIIA đều là các khí hiếm, trơ, không tham gia các phản ứng CH tr 26 LT
Phương pháp giải: - Nhóm là cột dọc - Chu kì là hàng ngang Lời giải chi tiết:
CH tr 27 CH
Phương pháp giải: - Nhóm là cột dọc - Chu kì là hàng ngang Lời giải chi tiết: - Nguyên tố K + Số thứ tự ô: 19 + Nhóm: IA + Chu kì: 4 - Nguyên tố Mg + Số thứ tự ô: 12 + Nhóm: IIA + Chu kì: 3 - Nguyên tố Al + Số thứ tự ô: 13 + Nhóm: IIIA + Chu kì: 3 CH tr 27 CH
Phương pháp giải: - Nguyên tố Mercury (thủy ngân) tồn tại ở thể lỏng trong điều kiện thường - Quan sát bảng tuần hoàn ở Hình 4.2 để xác định vị trí Lời giải chi tiết: - Kim loại ở thể lỏng trong điều kiện thường, được ứng dụng để chế tạo nhiệt kế là: Mercury (thủy ngân) có kí hiệu hóa học là Hg - Mercury nằm ở nhóm IIB, chu kì 6 (hàng số 6) CH tr 28 VD
Phương pháp giải: Những kim loại thường được sử dụng để làm trang sức là: Gold, Silver, Platinum Lời giải chi tiết: - Gold (vàng): Kí hiệu hóa học là Au + Số thứ tự ô: 79 + Nhóm: IB + Chu kì: 6 - Silver (bạc): Kí hiệu hóa học là Ag + Số thứ tự ô: 47 + Nhóm: IB + Chu kì: 5 - Platinum (bạch kim): Kí hiệu hóa học là Pt + Số thứ tự ô: 78 + Nhóm: VIIIB + Chu kì: 6 CH tr 28 CH
Phương pháp giải: Tham khảo bảng tuần hoàn ở Hình 4.2 - Nhóm là cột dọc - Chu kì là hàng ngang Lời giải chi tiết: - Nguyên tố carbon: Nằm ở nhóm IVA, chu kì 2 - Nguyên tố nitrogen: Nằm ở nhóm VA, chu kì 2 - Nguyên tố oxygen: Nằm ở nhóm VIA, chu kì 2 - Nguyên tố chlorine: Nằm ở nhóm VIIA, chu kì 3 CH tr 28 VD
Phương pháp giải: - Nguyên tố phi kim có trong thành phần kem đánh răng là: fluorine - Thành phần chính của muối ăn là: sodium chloride => Nguyên tố phi kim trong muối ăn là chlorine Lời giải chi tiết: - Nguyên tố phi kim có trong thành phần kem đánh răng là: fluorine có kí hiệu hóa học là F + Nhóm VIIA + Chu kì: 2 - Thành phần chính của muối ăn là: sodium chloride => Nguyên tố phi kim trong muối ăn là chlorine có kí hiệu hóa học là Cl + Nhóm VIIA + Chu kì: 3 CH tr 29 CH
Phương pháp giải: Nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn Lời giải chi tiết: - Nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn - Các nguyên tố thuộc nhóm VIIIA (trừ He) đều có 8 electron ở lớp ngoài cùng => Ngoài He có 2 electron ở lớp ngoài cùng thì các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng CH tr 29 VD
Phương pháp giải: - Khí oxygen nặng hơn không khí - Khí hydrogen dễ gây cháy nổ khi tiếp xúc với khí oxygen Lời giải chi tiết: - Người ta đã bơm vào khinh khí cầu khí helium vì helium nhẹ hơn không khí và kém hoạt động, không gây cháy nổ - Không sử dụng khí oxygen vì khí oxygen nặng hơn không khí, khinh khí cầu không thể bay lên được - Không sử dụng khí hydrogen vì khí hydrogen dễ gây cháy nổ khi tiếp xúc với khí oxygen (có nhiệt độ) CH tr 30 BT1
Phương pháp giải: Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn: theo chiều tăng dần điện tích hạt nhân của nguyên tử Lời giải chi tiết: - Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử => Đáp án B CH tr 30 BT2
Phương pháp giải: - Quan sát Hình 4.2 - Các nguyên tố cùng 1 nhóm là cùng 1 cột dọc Lời giải chi tiết: A: O, S, Se thuộc cùng nhóm VIA B: N thuộc nhóm VA, O thuộc nhóm VIA, F thuộc nhóm VIIA C: Na, K thuộc nhóm IA, Mg thuộc nhóm IIA D: Ne thuộc nhóm VIIIA, Na thuộc nhóm IA, Mg thuộc nhóm IIA => Đáp án A CH tr 30 BT3
Phương pháp giải: - Quan sát Hình 4.2 - Các nguyên tố cùng 1 chu kì là cùng 1 hàng ngang Lời giải chi tiết: A: Li thuộc chu kì 2, Si thuộc chu kì 3, Ne thuộc chu kì 2 B: Mg, P, Ar đều thuộc chu kì 3 C: K, Fe thuộc chu kì 4, Ag thuộc chu kì 5 D: B thuộc chu kì 2, Al thuộc chu kì 3, In thuộc chu kì 5 => Đáp án B CH tr 30 BT4
Phương pháp giải: - Quan sát Hình 4.2: + Ô màu xanh: Kim loại + Ô màu hồng: Phi kim + Ô màu cam: Khí hiếm Lời giải chi tiết:
CH tr 30 BT5
Phương pháp giải: - Quan sát bảng tuần hoàn ở Hình 4.2 + Ô nguyên tố = số hiệu nguyên tử + Chu kì là hàng ngang + Nhóm là cột dọc Lời giải chi tiết: a) Nguyên tố Magnesium (Mg) + Ô nguyên tố: 12 + Chu kì: 3 + Nhóm: IIA b) Nguyên tố Neon (Ne) + Ô nguyên tố: 10 + Chu kì: 2 + Nhóm: VIIIA CH tr 30 BT6
Phương pháp giải: Khí oxygen rất cần thiết cho sự hô hấp của con người và sinh vật trên Trái Đất Lời giải chi tiết: - Ở điều kiện thường là chất khí, không màu, không mùi, không vị - Nặng hơn không khí - Ít tan trong nước (1L nước ở 20oC, 1 atm hòa tan được 31 mL khí oxygen) - Oxygen hóa lỏng ở -183oC, hóa rắn ở -218oC. Ở thể lỏng và rắn, oxygen có màu xanh nhạt. Oxygen cần thiết cho sự sống - Oxygen là thành phần quan trọng nhất đối với hoạt động hô hấp của con người, động vật, thực vật - Oxygen có ở mọi nơi: trong không khí, nước, đất Oxygen cần thiết cho sự cháy và quá trình đốt cháy nhiên liệu - Oxygen cần cho quá trình đốt cháy nhiên liệu như củi, than đá, dầu mỏ, khí thiên nhiên,… - Trong công nghiệp sản xuất gang thép, người ta thổi khí oxygen để tạo ra nhiệt độ cao, nâng hiệu suất và chất lượng gang thép. - Chế tạo mìn phá đá. - Oxygen lỏng dùng để đốt nhiên liệu trong tên lửa.
|