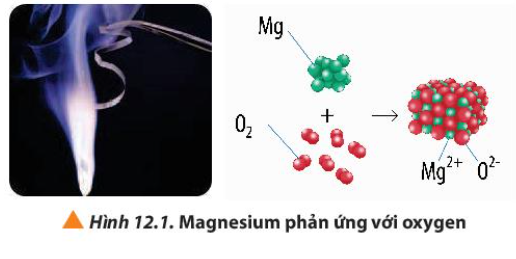
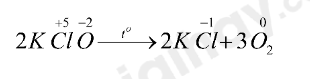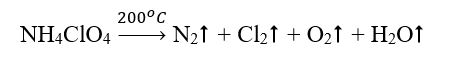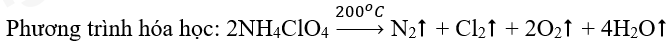Bài 12. Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống trang 72, 73, 74, 75, 76, 77, 78, 79 Hóa 10 Chân trời sáng tạoTải vềĐom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo 1. Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 72 MĐ
Lời giải chi tiết: - Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phản ứng. Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử - Vai trò của phản ứng oxi hóa – khử trong đời sống + Là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất hóa chất cơ bản + Sản xuất phân bón + Sản xuất thuốc bảo vệ thực vật + Sản xuất dược phẩm CH tr 72 CH
Phương pháp giải: - O tham gia quá trình nhận electron - Mg tham gia quá trình nhường electron Lời giải chi tiết: - O tham gia quá trình nhận electron O + 2e → O2- - Mg tham gia quá trình nhường electron Mg → Mg2+ + 2e CH tr 73 CH
Phương pháp giải: Trong phân tử HCl, mỗi nguyên tố bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung Lời giải chi tiết: - Trong phân tử HCl, mỗi nguyên tử bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung - Khi 1 cặp electron lệch hẳn về Cl => Có thể coi Cl nhận 1 electron và H nhường 1 electron => Cl sẽ mang điện tích -1 và H mang điện tích +1 CH tr 73 CH
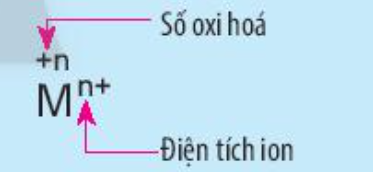
Phương pháp giải: Quan sát hình vẽ và rút ra nhận xét Lời giải chi tiết: - Kí hiệu số oxi hóa: Dấu rồi đến số (+n) Ví dụ: +1, +2, -1, -2 - Kí hiệu điện tích ion: Số rồi đến dấu (n-). Với điện tích có giá trị là 1 thì không cần ghi số 1 Ví dụ: Cl-, O2-, Na+, Ca2+. CH tr 73 CH
Phương pháp giải: Quy tắc 4: Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1, kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm (aluminium) có số oxi hóa +3 Lời giải chi tiết: - Nguyên tử nhóm IA có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +1 - Nguyên tử nhóm IIA có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +2 - Nguyên tử nhóm IIIA có 3 electron ở lớp ngoài cùng, có xu hướng nhường 3 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +3 CH tr 73 LT
Phương pháp giải: - Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0 - Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0 - Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó - Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3 Lời giải chi tiết: - Zn là đơn chất => Số oxi hóa của nguyên tử Zn là 0 - H2 là đơn chất => Số oxi hóa của nguyên tử H trong H2 là 0 - Cl- là ion đơn nguyên tử có điện tích là 1- => Số oxi hóa của ion Cltrong Cl- là -1 - O2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Otrong O2- là -2 - S2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Strong S2- là -2 - HSO4-: gọi số oxi hóa của S trong ion là x. Ta có: (+1).1 + x.1 + (-2).4 = -1 => x = +6 Vậy số oxi hóa của H = +1, O = -2 và S = +6 - Na2S2O3: gọi số oxi hóa của S trong phân tử là x Ta có: (+1).2 + x.2 + (-2).3 = 0 => x = +2 Vậy số oxi hóa của Na = +1, S = +2, O = -2 - KNO3: gọi số oxi hóa của N trong phân tử là x Ta có: (+1).1 + x.1 + (-2).3 = 0 => x = +5 Vậy số oxi hóa của K = +1, N = +5, O = -2 CH tr 74 LT
Phương pháp giải: - Trong phân tử, tổng số oxi hóa của các nguyên tử = 0 - O trong hợp chất có số oxi hóa là -2 Lời giải chi tiết: - Gọi số oxi hóa của Fe trong hợp chất trên là x Ta có: x.3 + (-2).4 = 0 => x = +8/3 Vậy số oxi hóa của Fe trong Fe3O4 = +8/3 Phương pháp giải: - Trong phân tử, tổng số oxi hóa của các nguyên tử = 0 - O trong hợp chất có số oxi hóa là -2 Lời giải chi tiết: - Gọi số oxi hóa của Fe trong hợp chất trên là x Ta có: x.3 + (-2).4 = 0 => x = +8/3 Vậy số oxi hóa của Fe trong Fe3O4 = +8/3 CH tr 75 CH
Phương pháp giải: - Chất khử là chất nhường electron để tạo thành ion mang điện tích dương - Chất oxi hóa là chất nhận electron để tạo thành ion mang điện tích âm Lời giải chi tiết: - Chất oxi hóa là chất nhận electron => Sau phản ứng, chất oxi hóa có số oxi hóa giảm so với trước phản ứng - Chất khử là chất nhường electron => Sau phản ứng, chất khử có số oxi hóa tăng so với trước phản ứng CH tr 75 LT
Phương pháp giải: - Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử - Quá trình oxi hóa là quá trình nhường electron - Quá trình khử là quá trình nhận electron Lời giải chi tiết: - Xét phản ứng (1): \({H_2}\mathop S\limits^{ - 2} + {\mathop {Br}\limits^0 _2} \to H\mathop {Br}\limits^{ - 1} + \mathop S\limits^0 \downarrow \) + Là phản ứng oxi hóa – khử vì nguyên tử S và Br có sự thay đổi số oxi hóa + Quá trình oxi hóa: S-2 → S0 + 2e + Quá trình khử: Br20 + 2e → Br-1 - Xét phản ứng (2): + Là phản ứng oxi hóa – khử vì nguyên tử Cl và O có sự thay đổi số oxi hóa + Quá trình oxi hóa: 2O-2 → O20 + 4e + Quá trình khử: Cl+5 + 6e → Cl-1 - Xét phản ứng (3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O + Không phải phản ứng oxi hóa – khử vì các nguyên tử không có sự thay đổi số oxi hóa CH tr 76 CH
Phương pháp giải: Xác định số oxi hóa của các nguyên tố trước và sau phản ứng Lời giải chi tiết: - Để nhận biết một phản ứng oxi hóa – khử, cần xác định số oxi hóa của các nguyên tố trước và sau phản ứng - Phản ứng nào có các nguyên tố thay đổi số oxi hóa => Phản ứng oxi hóa – khử CH tr 76 LT
Phương pháp giải: - Phản ứng có sự thay đổi số oxi hóa của nguyên tử là phản ứng oxi hóa khử Lời giải chi tiết: - 3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử là: \({H_2}\mathop S\limits^{ - 2} + {\mathop {Br}\limits^0 _2} \to 2H\mathop {Br}\limits^{ - 1} + \mathop S\limits^0 \downarrow \) \(2K\mathop {Mn}\limits^{ + 7} {O_4} + 16H\mathop {Cl}\limits^{ - 1} \to 2KCl + \mathop {2Mn}\limits^{ + 2} C{l_2} + {\mathop {5Cl}\limits^0 _2} \uparrow + {8H_2}O\) \(2\mathop N\limits^{ - 3} {H_3} + {\mathop {3Br}\limits^0 _2} \to {2\mathop N\limits^0 _2} + 6H\mathop {Br}\limits^{ - 1} \) - 3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử là: CaO + 2HCl → CaCl2 + H2O MgSO4 + BaCl2 → BaSO4 + MgCl2 2HNO3 + Cu(OH)2 → Cu(NO3)2 + H2O CH tr 77 LT
Phương pháp giải: - Nguyên tắc: Tổng số electron chất khử nhường = Tổng số electron chất oxi hóa nhận Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: \(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\) Bước 1: \(K\mathop {Mn}\limits^{ + 7} {O_4} + H\mathop {Cl}\limits^{ - 1} \to KCl + \mathop {Mn}\limits^{ + 2} C{l_2} + {\mathop {Cl}\limits^0 _2} \uparrow + {H_2}O\) Bước 2: Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e Quá trình khử: Mn+7 + 5e → Mn+2 - KMnO4 là chất oxi hóa vì Mn trong KMnO4 nhận electron - HCl là chất khử vì Cl trong HCl nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2KMn{O_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} \uparrow + 8{H_2}O\) \(N{H_3} + B{r_2} \to {N_2} + HBr(2)\) Bước 1: \(\mathop N\limits^{ - 3} {H_3} + {\mathop {Br}\limits^0 _2} \to {\mathop N\limits^0 _2} + H\mathop {Br}\limits^{ - 1} \) Bước 2: Quá trình oxi hóa: 2N-3 → N20 + 6e Quá trình khử: Br20 + 2e → 2Br- - Br2 là chất oxi hóa vì Br nhận electron - NH3 là chất khử vì N trong NH3 nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2N{H_3} + 3B{r_2} \to {N_2} + 6HBr\) \(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\) Bước 1: \(\mathop N\limits^{ - 3} {H_3} + \mathop {Cu}\limits^{ + 2} O\xrightarrow{{{t^o}}}\mathop {Cu}\limits^0 + {\mathop N\limits^0 _2} + {H_2}O\) Bước 2: Quá trình oxi hóa: 2N-3 → N20 + 6e Quá trình khử: Cu+2 + 2e → Cu0 - CuO là chất oxi hóa vì Cu trong CuO nhận electron - NH3 là chất khử vì N trong NH3 nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2N{H_3} + 3CuO\xrightarrow{{{t^o}}}3Cu + {N_2} + 3{H_2}O\) \(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\) Bước 1: Coi số oxi hóa của Fe và S trong FeS2 đều = 0 \(FeS_2^0 + {\mathop O\limits^0 _2}\xrightarrow{{{t^o}}}\mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} + \mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \) Bước 2: Quá trình oxi hóa: FeS20 → Fe+3 + 2S+6 + 15e Quá trình khử: O20 + 4e → 2O-2 - O2 là chất oxi hóa vì O nhận electron - FeS2 là chất khử vì FeS2 nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(4Fe{S_2} + 11{O_2}\xrightarrow{{{t^o}}}2F{e_2}{O_3} + 8S{O_2}\) \(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5) Bước 1: \(K\mathop {Cl}\limits^{ + 5} {\mathop O\limits^{ - 2} _3}\xrightarrow{{{t^o},Mn{O_2}}}K\mathop {Cl}\limits^{ - 1} + {\mathop O\limits^0 _2} \uparrow \) Bước 2: Quá trình oxi hóa: 2O-2 → O20 + 4e Quá trình khử: Cl+5 + 6e → Cl-1 - KClO3 vừa là chất khử vừa là chất oxi hóa vì Cl trong KClO3 nhận electron, O trong KClO3 nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}2KCl + 3{O_2} \uparrow \) CH tr 77 CH
Phương pháp giải: - Phản ứng đốt cháy gas: CH4 + O2 → CO2 + H2O - Phản ứng kích nổ hỗn hợp nhiên liệu: H2 + O2 → H2O Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: - Phản ứng đốt cháy gas: \(C{H_4} + {O_2}\xrightarrow{{{t^o}}}C{O_2} + {H_2}O\) Bước 1: \(\mathop C\limits^{ - 4} {H_4} + {\mathop O\limits^0 _2}\xrightarrow{{{t^o}}}\mathop C\limits^{ + 4} {\mathop O\limits^{ - 2} _2} + {H_2}O\) Bước 2: Quá trình oxi hóa: C-4 → C+4 + 8e Quá trình khử: O20 + 4e → 2O-2 - O2 là chất oxi hóa vì O nhận electron - CH4 là chất khử vì C trong CH4 nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(C{H_4} + 2{O_2}\xrightarrow{{{t^o}}}C{O_2} + 2{H_2}O\) - Phản ứng kích nổ hỗn hợp nhiên liệu: \({H_2} + {O_2}\xrightarrow{{{t^o}}}{H_2}O\) Bước 1: \(\mathop {{H_2}}\limits^0 + \mathop {{O_2}}\limits^0 \xrightarrow{{{t^o}}}\mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ - 2} \) Bước 2: Quá trình oxi hóa: H20→ 2H+1 + 2e Quá trình khử: O20 + 4e → 2O-2 - O2 là chất oxi hóa vì O nhận electron - H2 là chất khử vì H nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2{H_2} + {O_2}\xrightarrow{{{t^o}}}2{H_2}O\) CH tr 78 CH
Phương pháp giải: Phản ứng quang hợp: \(C{O_2} + {H_2}O\xrightarrow{{a/s,dl}}{C_6}{H_{12}}{O_6} + {O_2}\) Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: Bước 1: \(\mathop C\limits^{ + 4} {O_2} + {H_2}\mathop O\limits^{ - 2} \xrightarrow{{a/s,dl}}\mathop {{C_6}}\limits^0 {H_{12}}{O_6} + {\mathop O\limits^0 _2}\) Bước 2: Quá trình oxi hóa: 2O-2 → O20 + 4e Quá trình khử: C+4 + 4e → C0 Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(6C{O_2} + 6{H_2}O\xrightarrow{{a/s,dl}}{C_6}{H_{12}}{O_6} + 6{O_2}\) - Vai trò của quá trình quang hợp của thực vật có vai trò: + Cung cấp oxygen, giảm lượng khí thải carbonic + Tổng hợp chất hữu cơ, đưa năng lượng mặt trời vào hệ sinh thái CH tr 78 CH
Phương pháp giải: Phản ứng luyện kim: \(CO + F{e_2}{O_3}\xrightarrow{{{t^o}}}Fe + C{O_2}\) Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: Bước 1: \(\mathop C\limits^{ + 2} O + \mathop {F{e_2}}\limits^{ + 3} {O_3}\xrightarrow{{{t^o}}}\mathop {Fe}\limits^0 + \mathop C\limits^{ + 4} {O_2}\) Bước 2: Quá trình oxi hóa: C+2 → C+4 + 2e Quá trình khử: Fe+3 + 3e → Fe0 Fe2O3 là chất oxi hóa vì Fe trong Fe2O3 nhận electron CO là chất khử vì C trong CO nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(3CO + F{e_2}{O_3}\xrightarrow{{{t^o}}}2Fe + 3C{O_2}\) CH tr 78 CH
Phương pháp giải: Phản ứng sinh ra dòng điện trong pin: \(Zn + Mn{O_2}\xrightarrow{{kiem}}ZnO + M{n_2}{O_3}\) Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: Bước 1: \(\mathop {Zn}\limits^0 + \mathop {Mn}\limits^{ + 4} {O_2}\xrightarrow{{kiem}}\mathop {Zn}\limits^{ + 2} O + \mathop {M{n_2}}\limits^{ + 3} {O_3}\) Bước 2: Quá trình oxi hóa: Zn0 → Zn+2 + 2e Quá trình khử: Mn+4 + e → Mn+3 Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(Zn + 2Mn{O_2}\xrightarrow{{kiem}}ZnO + M{n_2}{O_3}\) CH tr 78 VD
Phương pháp giải: - Phản ứng đốt cháy methane tạo ra năng lượng - Phản ứng hô hấp hiếu khí - Phản ứng hô hấp kị khí Lời giải chi tiết: - Phản ứng đốt cháy methane tạo ra năng lượng: CH4 + 2O2 \(\xrightarrow{{{t^o}}}\)CO2 + 2H2O + năng lượng - Phản ứng hô hấp hiếu khí: C6H12O6 + 6O2 → 6CO2 + 6H2O + 36 ATPs (năng lượng) - Phản ứng hô hấp kị khí: C6H12O6 → 2C2H5OH + 2CO2 + năng lượng Bài tập 1
Phương pháp giải: - Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0 - Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0 - Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó - Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3 Lời giải chi tiết: a) - K2Cr2O7: Gọi số oxi hóa của Cr trong K2Cr2O7 là x => (+1).2 + x.2 + (-2).7 = 0 => x = +6 => Số oxi hóa của Cr trong K2Cr2O7 là +6 - KMnO4: Gọi số oxi hóa của Mn trong KMnO4 là x => (+1).1 + x.1 + (-2).4 = 0 => x = +7 => Số oxi hóa của Mn trong KMnO4 là +7 - KClO4: Gọi số oxi hóa của Cl trong KClO4 là x => (+1).1 + x.1 + (-2).4 = 0 => x = +7 => Số oxi hóa của Cl trong KClO4 là +7 - NH4NO3: Gọi số oxi hóa của N cần tìm là x => x.1 + (+1).1 + (+5).1 + (-2).3 = 0 => x = -3 => Số oxi hóa của N cần tìm trong NH4NO3 là -3 b) - AlO2-: Gọi số oxi hóa của Al trong AlO2- là x => x.1 + (-2).2 = -1 => x = +3 => Aố oxi hóa của Al trong AlO2- là +3 - PO43-: Gọi số oxi hóa của P trong PO43- là x => x.1 + (-2).4 = -3 => x = +5 => Số oxi hóa của P trong PO43- là +5 - ClO3-: Gọi số oxi hóa của Cl trong ClO3- là x => x.1 + (-2).3 = -1 => x = +5 => Số oxi hóa của Cl trong ClO3- là +5 - SO42-: Gọi số oxi hóa của S trong SO42- là x => x.1 + (-2).4 = -2 => x = +6 => Số oxi hóa của S trong SO42- là +6 Bài tập 2
Phương pháp giải: Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\) Bước 1: \(H\mathop {Cl}\limits^{ - 1} + \mathop {Mn}\limits^{ + 4} {O_2}\xrightarrow{{{t^o}}}\mathop {Mn}\limits^{ + 2} C{l_2} + \mathop {C{l_2}}\limits^0 \uparrow + {H_2}O\) Bước 2: Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e Quá trình khử: Mn+4 + 2e → Mn+2 Chất oxi hóa là Mn trong MnO2 vì Mn nhận electron Chất khử là Cl trong HCl vì Cl nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(4HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + 2{H_2}O\) b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\) Bước 1: \(K\mathop {Mn}\limits^{ + 7} {O_4} + K\mathop N\limits^{ + 3} {O_2} + {H_2}S{O_4} \to \mathop {Mn}\limits^{ + 2} S{O_4} + K\mathop N\limits^{ + 5} {O_3} + {K_2}S{O_4} + {H_2}O\) Bước 2: Quá trình oxi hóa: N+3 → N+5 + 2e Quá trình khử: Mn+7 + 5e → Mn+2 Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron Chất khử là N trong KNO2 vì N nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(2KMn{O_4} + 5KN{O_2} + 3{H_2}S{O_4} \to 2MnS{O_4} + 5KN{O_3} + {K_2}S{O_4} + 3{H_2}O\) c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\) Bước 1: \(\mathop {F{e_3}}\limits^{ + 8/3} {O_4} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O \uparrow + {H_2}O\) Bước 2: Quá trình oxi hóa: 3Fe+8/3 → 3Fe+3 + e Quá trình khử: N+5 + 3e → N+2 Chất oxi hóa là N trong HNO3 vì N nhận electron Chất khử là Fe trong Fe3O4 vì Fe nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(3F{e_3}{O_4} + 28HN{O_3} \to 9Fe{(N{O_3})_3} + NO \uparrow + 14{H_2}O\) d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\) Bước 1: \({H_2}\mathop {{C_2}}\limits^{ + 1} {O_2} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_4} \to \mathop C\limits^{ + 4} {O_2} \uparrow + \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + {H_2}O\) Bước 2: Quá trình oxi hóa: 2C+1 → 2C+4 + 6e Quá trình khử: Mn+7 + 5e → Mn+2 Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron Chất khử là C trong C2H2O2 vì C nhường electron Bước 3: Xác định hệ số
Bước 4: Đặt hệ số \(5{H_2}{C_2}{O_2} + 6KMn{O_4} + 9{H_2}S{O_4} \to 10C{O_2} \uparrow + 6MnS{O_4} + 3{K_2}S{O_4} + 14{H_2}O\) Bài tập 3
Phương pháp giải: - Xác định những hiện tượng hóa học có xảy ra phản ứng oxi hóa - khử trong cuộc sống hàng ngày - Viết và cân bằng các phương trình hóa học đó theo phương pháp thăng bằng electron Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: - Hiện tượng gỉ sét: sắt thép để lâu ngày trong không khí thì trên bề mặt của chúng sẽ xuất hiện lớp màu nâu đỏ Sơ đồ phản ứng: \(\mathop {Fe}\limits^0 + {\mathop O\limits^0 _2} \to {\mathop {Fe}\limits^{ + 8/3} _3}{\mathop O\limits^{ - 2} _4}\) Quá trình oxi hóa: $\mathop {3Fe}\limits^0 \to 3\mathop {Fe}\limits^{ + 8/3} + 3.\frac{8}{3}e$ Quá trình khử: $\mathop {{O_2}}\limits^0 + 2.2e \to 2\mathop O\limits^{ - 2} $
Phương trình hóa học: 3Fe + 2O2 → Fe3O4 - Hiện tượng sự cháy của cây nến: nến có thành phần chính là paraffin, khi cháy trong không khí sẽ sinh ra khí carbon dioxide và hơi nước Sơ đồ phản ứng: C2H6 + O2 → CO2 + H2O\(\)
Phương trình hóa học: 2C2H6 + 7O2 → 4CO2 + 6H2O Bài tập 4
Phương pháp giải: - Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử - Phản ứng không phải là phản ứng oxi hóa khử là các nguyên tử trong phân tử không thay đổi số oxi hóa Lời giải chi tiết: - Phản ứng oxi hóa - khử: Zn + Cl2 → ZnCl2 + Zn từ số oxi hóa 0 lên +2, Cl từ số oxi hóa 0 xuống -1 - Phản ứng không phải oxi hóa - khử: ZnO + 2HCl → ZnCl2 + H2O Bài tập 5
Phương pháp giải: Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại Lời giải chi tiết: Sơ đồ phản ứng: \(\mathop N\limits^{ - 3} {H_4}\mathop {Cl}\limits^{ + 7} {\mathop O\limits^{ - 2} _4}\xrightarrow{{{{200}^o}C}}{\mathop N\limits^0 _2} \uparrow + {\mathop {Cl}\limits^0 _2} \uparrow + {\mathop O\limits^0 _2} \uparrow + {H_2}O\) Quá trình oxi hóa: $\mathop {2N}\limits^{ - 3} \to \mathop {{N_2}}\limits^0 + 2.3e$ $\mathop {4O}\limits^{ - 2} \to 2\mathop {{O_2}}\limits^0 + 4.2e$ Quá trình khử: $2\mathop {Cl}\limits^{ + 7} + 2.7e \to {\mathop {Cl}\limits^0 _2}$
|