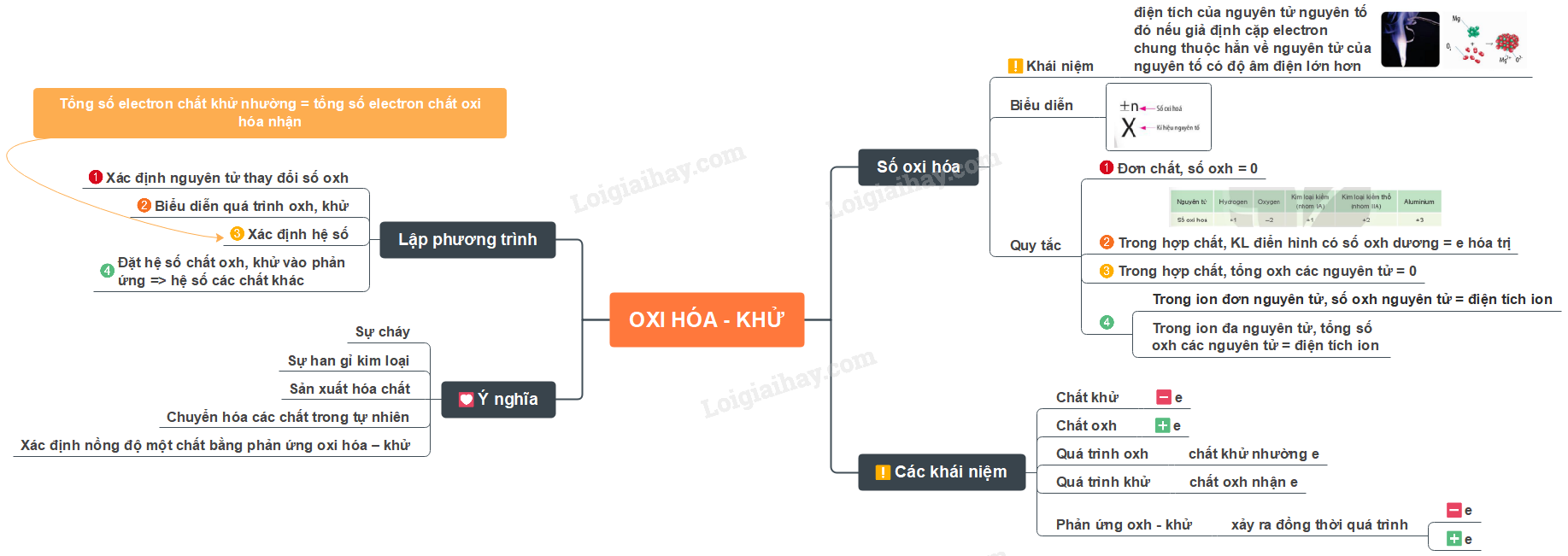
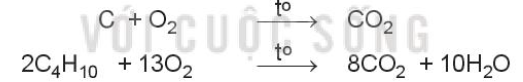Lý thuyết bài 12: Phản ứng oxi hóa - khử và ứng dụng trong cuộc sốngPhản ứng oxi hóa - khử Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa... Lý thuyết: Phản ứng oxi hóa - khử I. Số oxi hóa 1. Khái niệm - Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn
- Cách biểu diễn số oxi hóa:
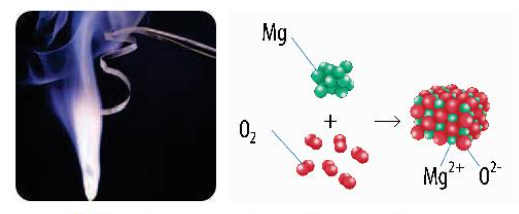
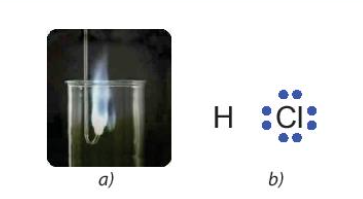
Ví dụ: \(\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} ,\mathop {Mg}\limits^{ + 2} \mathop O\limits^{ - 2} ,\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 1} \mathop O\limits^{ - 2} \) 2. Quy tắc xác định số oxi hóa - Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử = 0 Ví dụ: \(\mathop {Na}\limits^0 ,\mathop {C{l_2}}\limits^0 ,\mathop C\limits^0 ,\mathop {{O_2}}\limits^0 \) - Quy tắc 2: Trong phân tử các hợp chất, thông thường các kim loại điển hình có số oxi hóa dương và giá trị bằng số electron hóa trị
- Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử = 0 Ví dụ: \({\mathop {Al}\limits^{ + 3} _2}\mathop {{O_3}}\limits^{ - 2} \) Tổng số oxi hóa = (+3).2 + (-2).3 = 0 - Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion Ví dụ: \({{\text{(}}\mathop N\limits^{ - 3} {\mathop H\limits^{ + 1} _4}{\text{)}}^ + }\) Tổng số oxi hóa = (-3) + (+1).4 = +1 II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử 1. Chất oxi hóa, chất khử - Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron (Câu thần chú: Chất khử cho tăng, chất o nhận giảm) - Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron
2. Phản ứng oxi hóa – khử - Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình nhường electron và quá trình nhận electron - Dấu hiệu nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử III. Lập phương trình hóa học của phản ứng oxi hóa – khử
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\) Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử \(\mathop N\limits^{ - 3} {H_3} + \mathop {Cu}\limits^{ + 2} O\xrightarrow{{{t^o}}}\mathop {Cu}\limits^0 + {\mathop N\limits^0 _2} + {H_2}O\) - CuO là chất oxi hóa vì Cu trong CuO nhận electron - NH3 là chất khử vì N trong NH3 nhường electron Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử Quá trình oxi hóa: 2N-3 → N20 + 6e Quá trình khử: Cu+2 + 2e → Cu0 Bước 3: Xác định hệ số dựa trên nguyên tắc: tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở 2 vế \(2N{H_3} + 3CuO\xrightarrow{{{t^o}}}3Cu + {N_2} + 3{H_2}O\) IV. Phản ứng oxi hóa – khử trong thực tiễn 1. Sự cháy - Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa Ví dụ: Đốt cháy carbon trong than đá và butane trong khí gas:
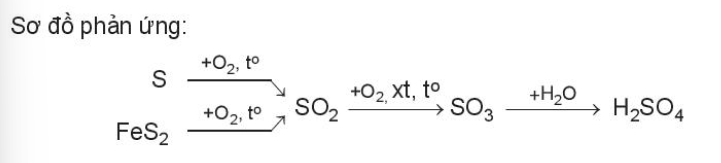
2. Sự han gỉ kim loại Ví dụ: Trong không khí ẩm, các vật dụng bằng thép bị oxi hóa tạo gỉ sắt. 4Fe + 3O2 + xH2O → 2Fe2O3.xH2O 3. Sản xuất hóa chất Ví dụ: Sulfuric acid là hóa chất quan trọng trong công nghiệp, được sản xuất chủ yếu từ sulfur hoặc quặng pyrite 4. Chuyển hóa các chất trong tự nhiên Ví dụ: Lúa chiêm lấp ló đầu bờ Hễ nghe tiếng sấm phất cờ mà lên 5. Xác định nồng độ một chất bằng phản ứng oxi hóa – khử Ví dụ: Trong quá trình bảo quản, một mẫu iron(II) sulfate bị oxi hóa 1 phần thành hợp chất iron(III). Hàm lượng iron(II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
|