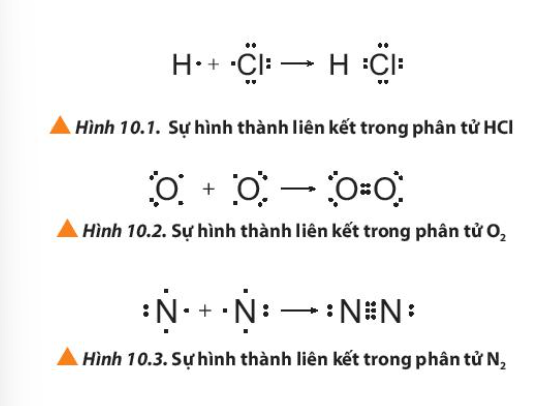
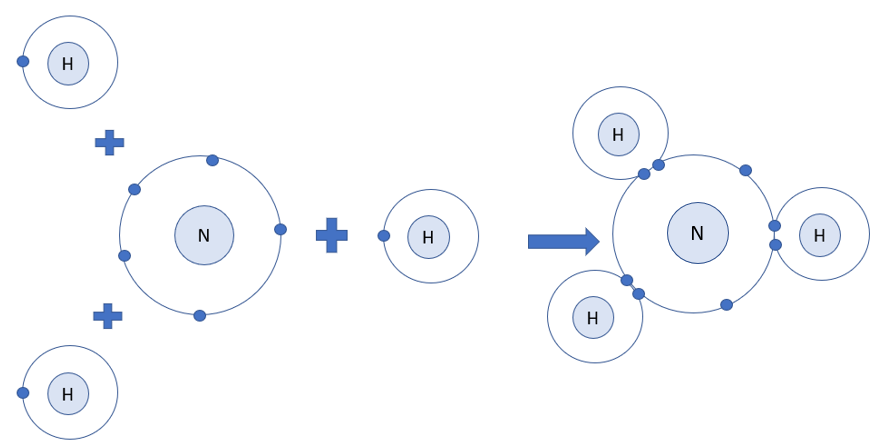
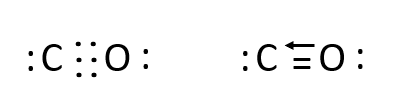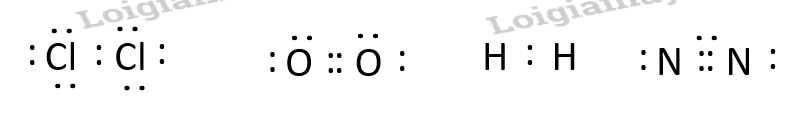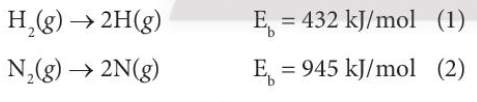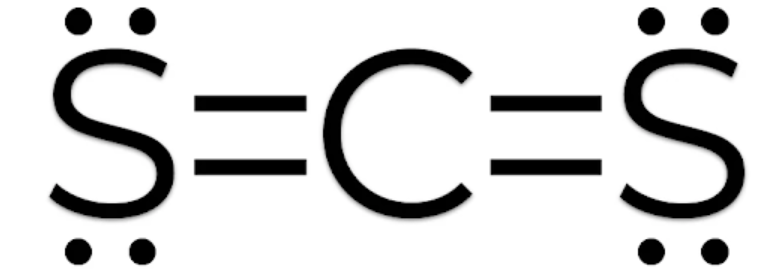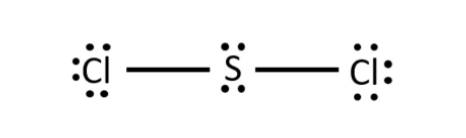Bài 10. Liên kết cộng hóa trị trang 59, 60, 61, 62, 63, 64, 65, 66 Hóa 10 Chân trời sáng tạoTải vềTrong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết. Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 59 MĐ
Lời giải chi tiết: Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị CH tr 59 CH
Phương pháp giải: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung Lời giải chi tiết: Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm Ví dụ: - Nguyên tử O cần nhận thêm 2 electron => Bỏ ra 2 electron để góp chung - Nguyên tử Cl và H cần nhận thêm 1 electron => Mỗi nguyên tử bỏ ra 1 electron để góp chung - Nguyên tử N cần nhận thêm 3 electron => Bỏ ra 3 electron để góp chung CH tr 59 CH
Phương pháp giải: Các nguyên tử sẽ góp 1 hay nhiều electron để hình thành 1 hay nhiều cặp electron chung => Thỏa mãn quy tắc octet Lời giải chi tiết: - Xét phân tử HCl: + Nguyên tử H có 1 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron + Nguyên tử Cl có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron => Nguyên tử H và Cl sẽ góp 1 electron tạo thành 1 cặp electron chung - Xét phân tử O2: + Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron => Mỗi nguyên tử O sẽ góp 2 electron tạo thành 2 cặp electron chung - Xét phân tử N2: + Nguyên tử N có 5 electron ở lớp ngoài cùng, có xu hướng nhận thêm 3 electron => Mỗi nguyên tử N sẽ góp 3 electron tạo thành 3 cặp electron chung CH tr 60 CH
Phương pháp giải: - Liên kết đơn: 1 cặp electron chung - Liên kết đôi: 2 cặp electron chung - Liên kết ba: 3 cặp electron chung Lời giải chi tiết: - Liên kết đơn: là liên kết được tạo bởi 1 cặp electron chung, được biểu diễn bằng một gạch nối “-“ - Liên kết đôi: là liên kết được tạo bởi 2 cặp electron chung, được biểu diễn bằng 2 gạch nối “=” - Liên kết ba: là liên kết được tạo bởi 3 cặp electron chung, được biểu diễn bằng 3 gạch nối “\( \equiv \) ” CH tr 60 LT
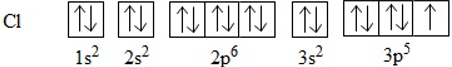
Phương pháp giải: - Nguyên tử Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 1 electron Lời giải chi tiết: - Nguyên tử Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar => Khi hình thành phân tử Cl2, mỗi nguyên tử sẽ góp 1 electron để tạo thành 1 cặp electron chung CH tr 60 CH
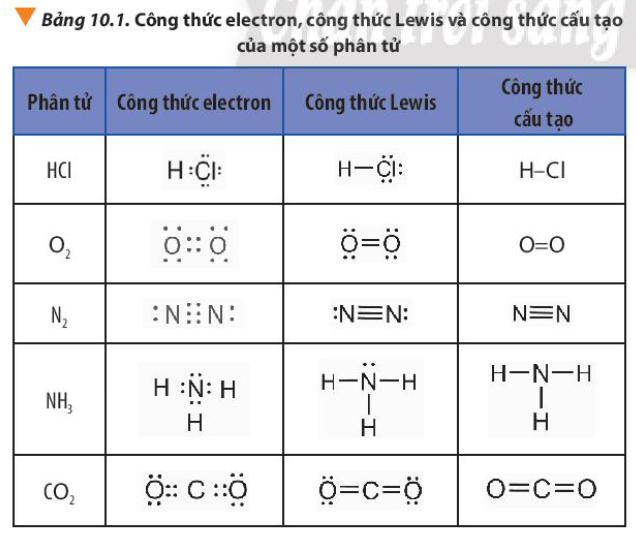
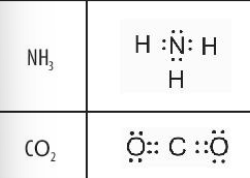
Phương pháp giải: Tham khảo Bảng 10.1:
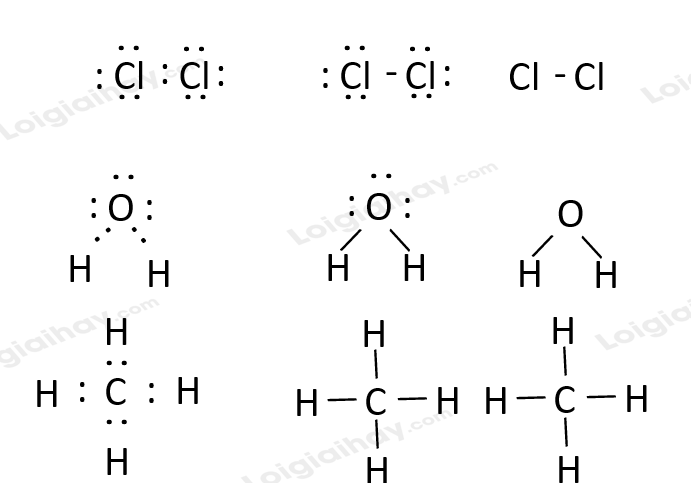
Lời giải chi tiết: - Công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4 lần lượt là: CH tr 60 LT
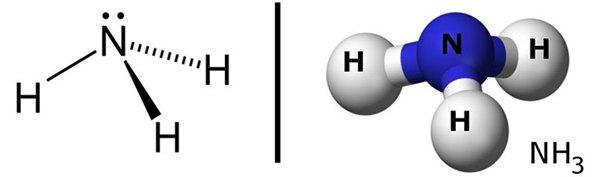
Phương pháp giải: - Nguyên tử H và nguyên tử N đều là phi kim + Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron + Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần nhận thêm 3 electron Lời giải chi tiết: - Xét phân tử khí amonia - Nguyên tử H có 1 electron ở lớp ngoài cùng - Nguyên tử N có 5 electron ở lớp ngoài cùng => Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm => Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung CH tr 61 CH
Phương pháp giải: - O cần nhận thêm 2 electron - C cần nhận thêm 4 electron Lời giải chi tiết: - O có 6 electron ở lớp ngoài cùng => Cần nhận thêm 2 electron - C có 4 elctron ở lớp ngoài cùng => Cần nhận thêm 4 electron => Mỗi nguyên tử sẽ góp chung 2 electron để tạo thành 2 cặp electron chung. - Khi đó nguyên tử C có 6 electron, O có 8 electron ở lớp ngoài cùng => O sẽ sử dụng 1 cặp electron chưa liên kết làm cặp electron chung với nguyên tử C. - Trong CO, nguyên tử O đóng góp cặp electron chung nên nguyên là nguyên tử cho, còn nguyên tử C không đóng góp electron nên đóng vai trò nhận => Công thức electron và công thức cấu tạo: CH tr 61 CH
Phương pháp giải: - Nguyên tử “cho” là nguyên tử đóng góp cặp electron chung - Nguyên tử “nhận” là nguyên tử không đóng góp eletron Lời giải chi tiết: - Đặc điểm của nguyên tử “cho”: còn cặp electron chưa tham gia liên kết => Đóng góp cặp electron chung - Đặc điểm của nguyên tử “nhận”: có orbital trống, không chưa electron, số electron lớp ngoài cùng chưa đạt quy tắc octet => Không đóng góp electron mà nhận cặp eletron của nguyên tử “cho” CH tr 61 LT
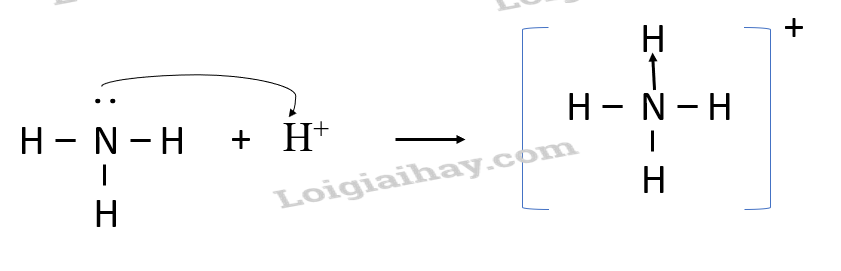
Phương pháp giải: Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa liên kết, ion H+ có orbital trống, không chứa electron Lời giải chi tiết: - Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa liên kết, ion H+ có orbital trống, không chứa electron. - Khi cho NH3 kết hợp với ion H+, nguyên tử N sử dụng 1 cặp electron chưa tham gia liên kết làm cặp electron chung với ion H+ tạo thành ion NH4+. - Trong ion NH4+, nguyên tử N đóng góp 1 cặp electron chung nên là nguyên tử cho, ion H+ không đóng góp electron, đóng vai trò nhận electron CH tr 62 CH
Phương pháp giải: - Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử Lời giải chi tiết: - Các phân tử Cl2, O2, N2 được tạo từ 2 nguyên tử giống nhau => Độ âm điện bằng nhau => Khả năng hút electron như nhau => Cặp electron dùng chung không bị lệch về nguyên tử nào => Liên kết cộng hóa trị không phân cực CH tr 62 CH
Phương pháp giải: Trong hợp chất cộng hóa trị, cặp electron dùng chung sẽ lệch về phía nguyên tử có độ âm điện lớn hơn Lời giải chi tiết: - Trong phân tử HCl, Cl có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử Cl - Trong phân tử NH3, N có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử N - Trong phân tử CO2, O có độ âm điện lớn hơn C => Cặp electron chung lệch về phía nguyên tử O CH tr 62 LT
Phương pháp giải: - Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào - Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn Lời giải chi tiết: - Phân tử có liên kết cộng hóa trị không phân cực: Cl2, O2, H2, N2 - Phân tử có liên kết cộng hóa trị phân cực là: HCl, NH3, CO2
CH tr 62 CH
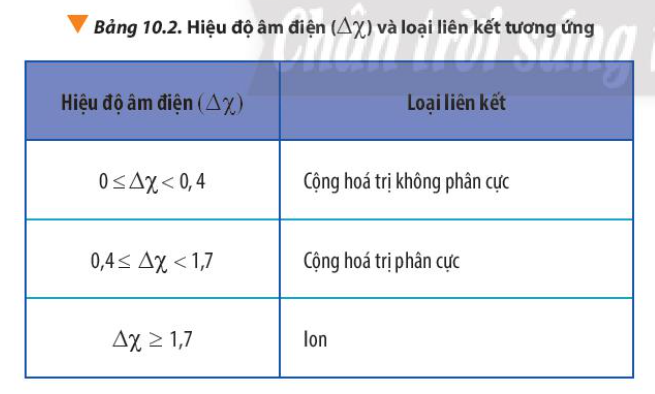
Phương pháp giải: Dựa vào Bảng 10.2 và rút ra nhận xét Lời giải chi tiết: - Phân tử dạng A2 được tạo bởi 2 nguyên tử giống nhau => Hiệu độ âm điện = 0 => Cộng hóa trị không phân cực => Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị không phân cực CH tr 63 CH
Phương pháp giải: - Cặp electron chung trong liên kết lệch hẳn về phía nguyên tử có độ âm điện lớn hơn Lời giải chi tiết: - Trong liên kết cộng hóa trị phân cực, cặp electron chung trong liên kết lệch hẳn về phía nguyên tử có độ âm điện lớn hơn => Nguyên tử có độ âm điện lớn hơn sẽ mang số oxi hóa âm, nguyên tử có độ âm điện nhỏ hơn sẽ mang số oxi hóa dương - Ví dụ: + NH3: N có độ âm điện lớn hơn H => N trong NH3 có số oxi hóa = -3, H trong NH3 có số oxi hóa = +1 + HCl: Cl có độ âm điện lớn H => Cl trong HCl có số oxi hóa = -1, H trong HCl có số oxi = +1 CH tr 63 LT
Phương pháp giải:
Lời giải chi tiết: - Phân tử MgCl2 + Mg có độ âm điện = 1,31 + Cl có độ âm điện = 3,16 => Hiệu độ âm điện = 3,16 – 1,31 = 1,85 => Liên kết ion - Phân tử CO2 + C có độ âm điện = 2,55 + O có độ âm điện = 3,44 => Hiệu độ âm điện = 3,44 – 2,55 = 0,89 => Liên kết cộng hóa trị phân cực - Phân tử C2H4 + C có độ âm điện = 2,55 + H có độ âm điện = 2,2 => Hiệu độ âm điện = 2,55 – 2,2 = 0,35 => Liên kết cộng hóa trị không phân cực CH tr 63 CH
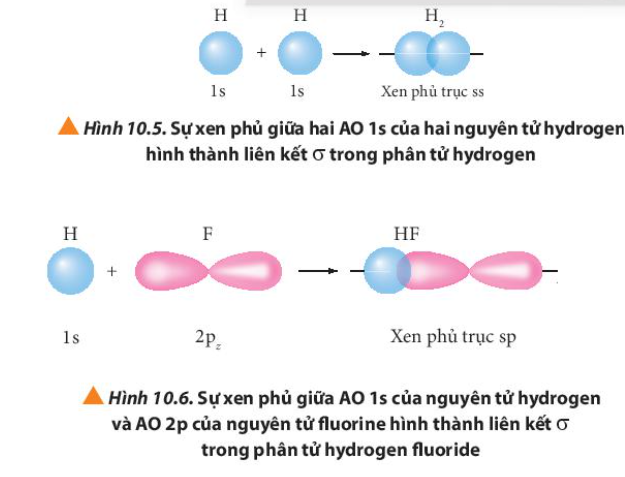
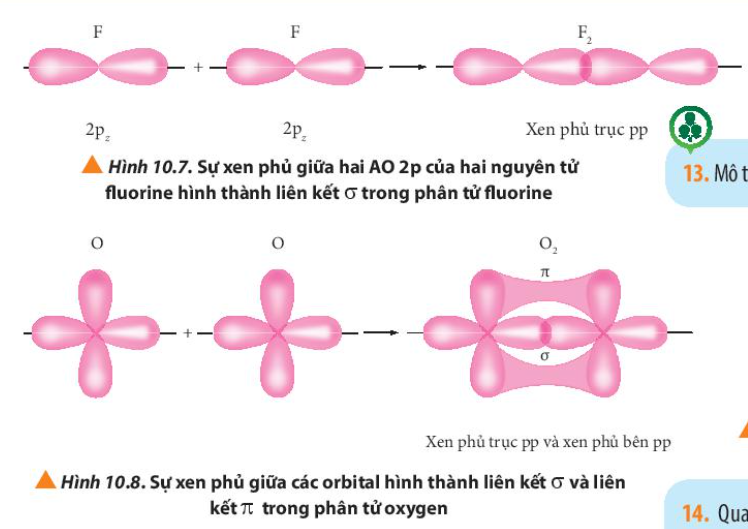
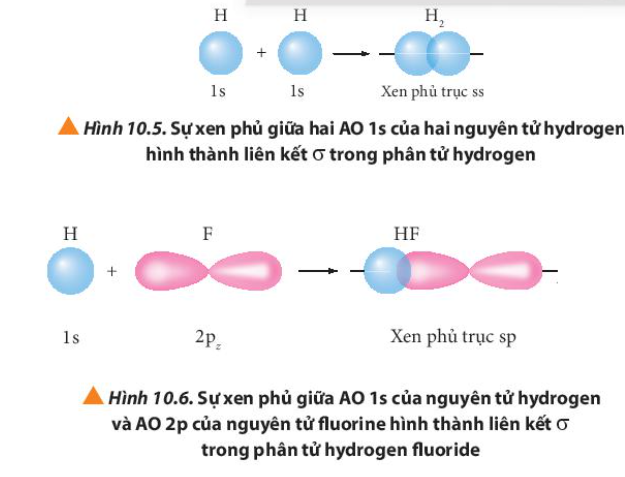
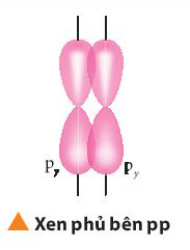
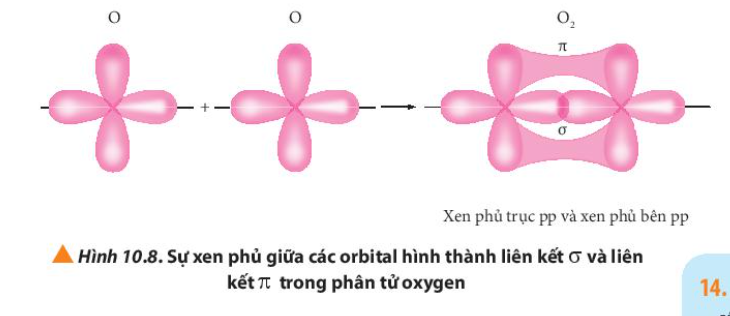
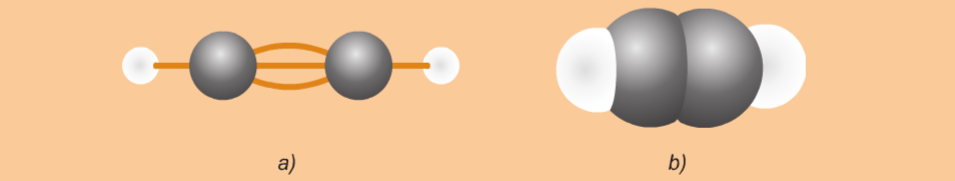
Phương pháp giải: Quan sát Hình từ 10.5 đến 10.8 và rút ra nhận xét Lời giải chi tiết: - Liên kết σ trong mỗi phân tử được tạo thành bởi sự xen phủ trục - Liên kết п trong mỗi phân tử được tạo thành bởi sự xen phủ bên CH tr 63 CH
Phương pháp giải: Liên kết σ là sự xen phủ trục
Lời giải chi tiết: Liên kết σ hay còn là sự xen phủ trục: sự xen phủ này xảy ra trên trục nối giữa hai hạt nhân nguyên tử. Ví dụ: CH tr 64 CH
Phương pháp giải: Liên kết п là sự xen phủ bên
Lời giải chi tiết: Liên kết п hay còn là sự xen phủ bên: Sự xen phủ thực hiện ở hai bên trục nối giữa hai hạt nhân nguyên tử Ví dụ: CH tr 64 CH
Phương pháp giải: So sánh độ xen phủ giữa liên kết п và liên kết σ Lời giải chi tiết:
CH tr 64 CH
Phương pháp giải: - Liên kết bội được hình thành bởi liên kết có 2 – 3 cặp electron góp chung Lời giải chi tiết: - Liên kết bội là liên kết được hình thành giữa hai nguyên tố bằng hai hoặc ba cặp electron góp chung. Liên kết này được biểu thị bằng hai gạch nối hoặc ba gạch nối. - Xét các phân tử: + Cl2: Cl – Cl => Liên kết đơn + HCl: H – Cl => Liên kết đơn + O2: O = O => Liên kết bội + N2: N N => Liên kết bội CH tr 64 CH
Phương pháp giải: Xen phủ trục là vùng xen phủ nằm trên đường nối tâm hai nguyên tử Lời giải chi tiết: Sự xen phủ có sự tham gia của orbital s luôn là xen phủ trục vì dù theo phương, chiều nào thì vùng xen phủ cũng nằm trên đường nối tâm CH tr 64 CH
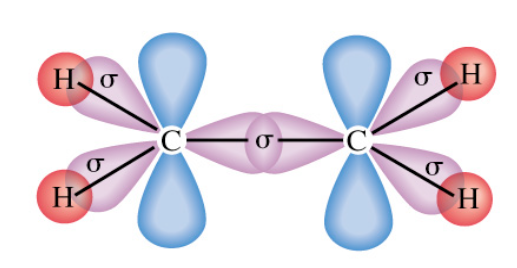
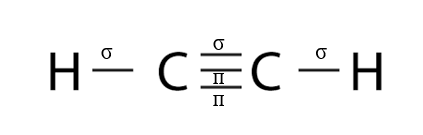
Lời giải chi tiết: - Liên kết đơn: 1 liên kết σ - Liên kết đôi: 1 liên kết σ, 1 liên kết п - Liên kết ba: 1 liên kết σ, 2 liên kết п CH tr 64 LT
Phương pháp giải: - Phân tử C2H4 gồm 1 liên kết đôi giữa 2 nguyên tử C => 1 liên kết σ, 1 liên kết п - Liên kết giữa C và H là liên kết đơn => Liên kết σ Lời giải chi tiết: CH tr 64 CH
Phương pháp giải: Lời giải chi tiết: - Để phá vỡ 1 mol phân tử H2 cần cung cấp năng lượng là 432 kJ/mol - Để phá vỡ 1 mol phân tử N2 cần cung cấp năng lượng là 945 kJ/mol => Liên kết trong phân tử H2 dễ bị phá vỡ hơn CH tr 65 CH
Phương pháp giải: Năng lượng liên kết đặc trưng cho độ bền của liên kết Lời giải chi tiết: - Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại => Năng lượng liên kết luôn mong giá trị dương, nếu mang giá trị âm thì phân tử đó không tồn tại CH tr 65 LT
Phương pháp giải: Năng lượng liên kết của phân tử N2 là 945 kJ/mol Lời giải chi tiết: - Năng lượng liên kết của phân tử N2 là 945 kJ/mol - Để phá vỡ 1 mol phân tử N2 cần cùng cấp năng lượng lớn là 945 kJ => Phân tử N2 rất khó bị phá vỡ, bền ở điều kiện thường => N2 là một chất khí không hoạt động ở điều kiện thường CH tr 65 VD
Phương pháp giải: Khí nitrogen không hoạt động ở điều kiện thường Lời giải chi tiết: - Để phá vỡ 1 mol phân tử N2 cần cùng cấp năng lượng lớn là 945 kJ => Phân tử N2 rất khó bị phá vỡ, bền ở điều kiện thường => Nitrogen không tham gia phản ứng hóa học ở điều kiện thường => Nitrogen sẽ không oxi hóa cao su => Người ta dùng khí nitrogen để bơm vào lốp xe, tránh mòn lốp CH tr 66 CH
Phương pháp giải: Bước 1: Xác định hình học phân tử cần lắp ráp Bước 2: Xác định số lượng các loại liên kết và kiểu liên kết Bước 3: Hoàn chỉnh mô hình phân tử Lời giải chi tiết: Bước 1: Hình học phân tử của NH3: tứ diện đều, mỗi nguyên tử nằm ở 1 đỉnh của tứ diện Bước 2: Phân tử NH3: gồm 3 quả cầu H và 1 quả cầu N, 3 thanh nối tương ứng với 3 liên kết đơn giữa N và H Bước 3: Hoàn chỉnh mô hình phân tử. CH tr 66 CH
Phương pháp giải: - Mô hình có 3 nguyên tố tương ứng với 3 màu của quả cầu: trắng, đen, xanh Lời giải chi tiết: - Phân tử CH4 được tạo bởi 2 nguyên tố: C và H - Phân tử CH3Cl được tạo bởi 3 nguyên tố: C, H và Cl => Mô hình trên biểu diễn phân tử của CH3Cl CH tr 66 VD
Phương pháp giải: - Mô hình C2H2 có 1 liên kết 3 giữa 2 nguyên tử C - Mỗi 1 C liên kết với 1 H bằng liên kết đơn Lời giải chi tiết:
CH tr 66 BT1
Phương pháp giải: I nằm ở vị trí nhóm VIIA, chu kì 5 Lời giải chi tiết: - Trong bảng tuần hoàn, I nằm ở nhóm VIIA, chu kì 5 => Có 7 electron ở lớp vỏ ngoài cùng và có 5 lớp electron - Khi góp dùng chung 1 cặp electron => I có 8 electron ở lớp vỏ ngoài cùng và có 5 lớp electron => Giống cấu hình electron của khí hiếm Xe Đáp án A CH tr 66 BT2
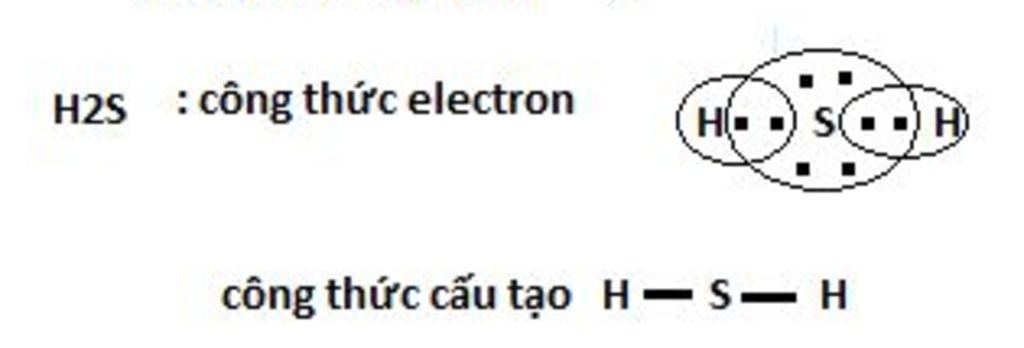
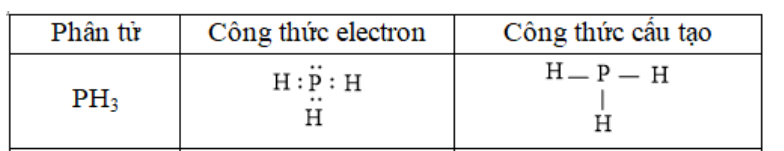
Phương pháp giải: - Xét phân tử H2S được tạo từ 2 phi kim + S có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 2 electron + H có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron - Xét phân tử PH3 được tạo từ 2 phi kim + P có 5 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 3 electron + H có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron Lời giải chi tiết: - Xét phân tử H2S được tạo từ 2 phi kim + S có 6 electron ở lớp ngoài cùng + H có 1 eelctron ở lớp ngoài cùng => Nguyên tử H cần thêm 1 electron và S cần thêm 2 electron để đạt cấu hình electron bền vững của khí hiếm => Khi 2 nguyên tử H và 1 nguyên tử S liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử S góp ra 2 electron để tạo ra 2 đôi electron dùng chung - Xét phân tử PH3 được tạo từ 2 phi kim + P có 5 electron ở lớp ngoài cùng + H có 1 elctron ở lớp ngoài cùng => Nguyên tử H cần thêm 1 electron và P cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm => Khi 3 nguyên tử H và 1 nguyên tử P liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử P góp ra 3 electron để tạo ra 3 đôi electron dùng chung CH tr 66 BT3
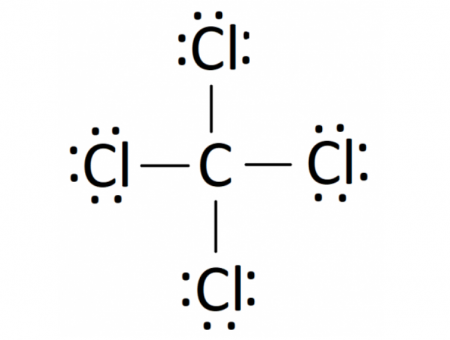
Phương pháp giải: - Nguyên tử C bỏ ra 4 electron để góp chung - Nguyên tử S bỏ ra 2 electron để góp chung - Nguyên tử Cl bỏ ra 1 electron để góp chung Lời giải chi tiết: - Phân tử CS2: Mỗi nguyên tử S sẽ góp 2 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung - Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử S góp 2 electron để tạo thành 2 cặp electron dùng chung - Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung CH tr 66 BT4
Phương pháp giải: - O cần nhận thêm 2 electron - S cần nhận thêm 2 electron Lời giải chi tiết: - O có 6 electron ở lớp ngoài cùng => Cần nhận thêm 2 electron - S có 6 elctron ở lớp ngoài cùng => Cần nhận thêm 2 electron => 1 nguyên tử S sẽ liên kết với 1 nguyên tử O bằng cách góp chung 2 electron - Khi đó nguyên tử S có 8 electron, O có 8 electron ở lớp ngoài cùng => Còn 1 O chưa tham gia liên kết - Trong khi đó nguyên tử S vẫn còn 2 đôi electron chưa tham gia liên kết => Nguyên tử S sẽ cho nguyên tử O chưa tham gia liên kết 1 cặp electron để dùng chung => Công thức electron và công thức cấu tạo: CH tr 66 BT5
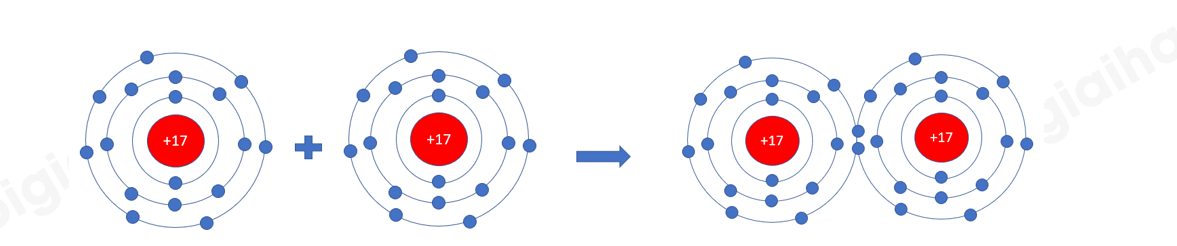
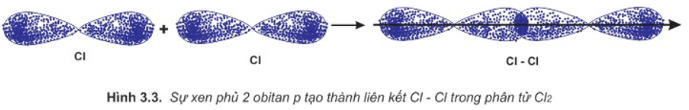
Phương pháp giải: Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử chlorine
Lời giải chi tiết: Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo: Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử chlorine CH tr 66 BT6
Phương pháp giải: - Liên kết σ là sự xen phủ trục - Liên kết п là sự xen phủ bên CH tr 66 BT7
Phương pháp giải: - Phân tử C2H2 gồm có liên kết 3 giữa 2 nguyên tử C, các liên kết đơn giữa nguyên tử C và H Lời giải chi tiết: - Phân tử C2H2 gồm có liên kết 3 giữa 2 nguyên tử C, các liên kết đơn giữa nguyên tử C và H => Có 2 liên kết п và 3 liên kết σ CH tr 66 BT8
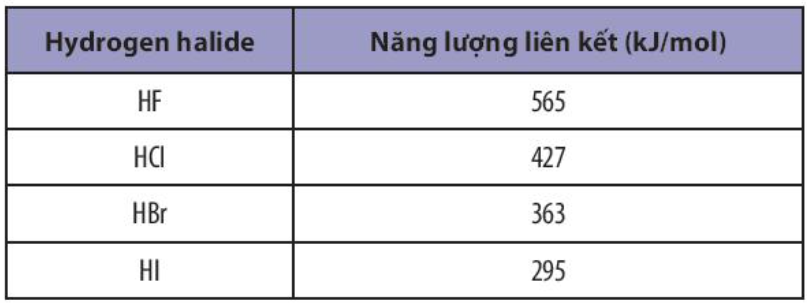
Phương pháp giải: HX nào có năng lượng liên kết càng lớn thì độ bền liên kết càng cao Lời giải chi tiết: - Sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF => Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF
|
||||||||||||||||||||||||||||||||||||||||||||||||