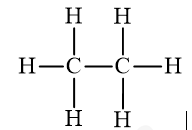
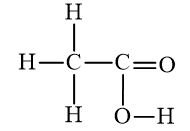
Giải đề thi học kì II năm học 2019 - 2020 trường THCS Tân Tiến - Bình PhướcĐề thi học kì II năm học 2019 - 2020 trường THCS Tân Tiến - Bình Phước có đáp án và lời giải chi tiết Tổng hợp Đề thi vào 10 có đáp án và lời giải Toán - Văn - Anh Đề bài I. TRẮC NGHIỆM (5,0 điểm) Câu 1 : Dãy nào được sắp xếp theo chiều tính kim loại tăng dần? A. Al, Mg, Na, K. B. Al, Na, Mg, K. C. K, Na, Mg, Al. D. Mg, K, Na, Al. Câu 2 : Khi xăng dầu chảy tràn ra mặt đất gây cháy thì những phương pháp dập tắt phù hợp là A. dùng nước phun vào đám cháy, dùng chăn ướt. B. dùng cát, phun nước vào đám cháy. C. dùng đất, cát phủ kín đám cháy, dùng bình chữa cháy. D. dùng chăn ướt, phun nước vào đám cháy. Câu 3 : Đâu là công thức cấu tạo thu gọn đúng của rượu etylic? A. CH3-O-CH3. B. CH3-CH2-OH. C. CH3-OH. D. HO-CH2-CH(OH)-CH2OH. Câu 4 : Thành phần chính của khí thiên nhiên là A. Etlien. B. Metan. C. Cacbon đioxit. D. Axetilen. Câu 5 : Rượu etylic có thể phản ứng với chất nào dưới đây? A. Oxi, cacbon đioxit. B. Axit axetic, natri oxit. C. Oxi, natri, axit axetic. D. Natri hiđroxit, axit axetic. Câu 6 : Cho m gam rượu etylic tác dụng với natri vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được 5,6 lít khí H2 (đktc). Giá trị của m là A. 5,75. B. 46,0. C. 23,0. D. 13,8. Câu 7 : Dùng thuốc thử nào để phân biệt khí metan với khí etilen? A. Dung dịch nước vôi trong. B. Dung dịch bari hiđroxit. C. Dung dịch brom. D. Dung dịch natri clorua. Câu 8 : Khi bạn muốn pha cồn 70o cho việc sát khuẩn dụng cụ thí nghiệm mà trong phòng thí nghiệm chỉ có cồn 90o thì bạn có thể pha được bao nhiêu ml cồn 70o từ 50,0 ml cồn 90o? Biết công thức tính độ rượu là \({D_R} = \frac{{{V_R}.100}}{{{V_{dd}}}}\) A. 70,0 ml. B. 45,0 ml. C. 64,3 ml. D. 54,3 ml. Câu 9 : Dãy nào chỉ gồm các hợp chất hữu cơ? A. C2H6, CO2, CH3Cl, CH4. B. CH4, C2H4, C2H6O, C2H4O2. C. Na2CO3, C3H8, C2H4Br2, CO. D. NaHCO3, C6H6, C2H4O2, CO2. Câu 10 : Để sản xuất giấm ăn, người ta thường dùng phương pháp lên men dung dịch rượu etylic loãng. Phương trình hóa học nào biểu diễn đúng phản ứng lên men trên? A. C2H5OH + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 3H2O. B. C2H5OH + O2 \(\xrightarrow{men}\) CH3COOH + H2O. C. 2C4H10 + 5O2 \(\xrightarrow{{{t}^{0}},xt}\) 4CH3COOH + 2H2O. D. nCH2=CH2 \(\xrightarrow{{{t}^{0}},p,xt}\) (-CH2-CH2-)n. Câu 11 : Đốt cháy hoàn toàn 8,96 lít hỗn hợp X gồm metan và etilen thu được 15,68 lít CO2. Thể tích các khí đo ở cùng điều kiện về nhiệt độ và áp suất. Thành phần % theo thể tích của metan là A. 60%. B. 25%. C. 75%. D. 50%. Câu 12 : Trên nhãn chai cồn ghi là cồn 90o có nghĩa là A. trong 190ml hỗn hợp có 90 ml là rượu etylic. B. trong 100 ml hỗn hợp có 90 ml là nước còn lại 10 ml là rượu etylic. C. trong 190 ml hỗn hợp có 100 ml là rượu etylic. D. trong 100 ml hỗn hợp có 90 ml rượu etylic. Câu 13 : Dãy nào chỉ gồm những hiđrocacbon? A. C2H4Br2, C6H6, C2H6. B. C2H4O2, C2H2, CH3Cl. C. C2H6O2, CH4, C2H4. D. C2H2, C2H4, CH4. Câu 14 : Cho sơ đồ phản ứng: CH3COOH + C2H5OH \(\overset{{{H}_{2}}S{{O}_{4(d)}},{{t}^{0}}}{→}\) X + H2O. Vậy X là chất nào dưới đây? A. CH3COOC2H5. B. CH3CH2C2H5. C. CH3OC2H5. D. CH3COC2H5. Câu 15 : Cho 60 gam axit axetic tác dụng với 92 gam rượu etylic thu được 55 gam etyl axetat. Hiệu suất phản ứng este hóa là A. 62,5%. B. 65,5%. C. 75,3%. D. 60,2%. Câu 16 : Dùng thuốc thử nào để phân biệt rượu etylic và axit axetic? A. Quỳ tím. B. Natri. C. Cacbon đioxit. D. Bạc nitrat. Câu 17 : Phát biểu nào đúng về ứng dụng của etilen? A. Sản xuất nhựa PE, PVC; pha nước hoa, pha sơn. B. Pha sơn, pha vecni, sản xuất rượu etylic. C. Pha dược phẩm, sản xuất rượu etylic. D. Sản xuất nhựa PE, PVC, axit axetic; kích thích quả mau chín. Câu 18 : Cho sơ đồ phản ứng sau: C2H4 + Br2 ⟶ X. Vậy X là chất nào dưới đây? A. C2H4Br2. B. C2H4Br. C. C2H3Br. D. C2H5Br. Câu 19 : Đốt cháy hoàn toàn 6 gam hợp chất hữu cơ X gồm 3 nguyên tố C, H, O thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. Biết khối lượng mol của X là 60 g/mol. CTPT của X là A. C2H4O2. B. C4H10O. C. C2H6O. D. C3H8O. Câu 20 : Phương trình hóa học nào thể hiện đúng tính chất phản ứng thế? A. C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 2H2O. B. C2H4 + Br2 ⟶ C2H4Br2. C. CH4 + 2O2 \(\xrightarrow{{{t}^{0}}}\) CO2 + 2H2O. D. CH4 + Cl2 \(\xrightarrow{a/s}\) CH3Cl + HCl. II. TỰ LUẬN (5,0 điểm) Câu 1 : (1,0 điểm) Viết công thức cấu tạo đầy đủ của: a) Etan: C2H6. b) Axit axetic: C2H4O2. Câu 22 : (1,5 điểm) Viết PTHH hoàn thành chuỗi phản ứng sau. Ghi rõ điều kiện (nếu có) Etilen \(\xrightarrow{(1)}\) Rượu etylic \(\xrightarrow{(2)}\) Axit axetic \(\xrightarrow{(3)}\) Etyl axetat Câu 23 : (2,5 điểm) Đốt cháy hoàn toàn 5,6 lít etilen trong khí oxi dư. (Thể tích các khí đo ở đktc). a) Tính thể tích khí oxi cần cho phản ứng cháy. b) Tính thể tích khí CO2 thu được (đktc). Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học --- HẾT --- Lời giải chi tiết I. TRẮC NGHIỆM Câu 1 Phương pháp: Dựa vào kiến thức về dãy hoạt động hóa học của kim loại. Cách giải: Dãy sắp xếp các kim loại theo chiều tính kim loại tăng dần là Al, Mg, Na, K. Chọn A. Câu 2 Phương pháp: Dựa vào tính chất vật lí của xăng, dầu. Cách giải: Khi xăng dầu chảy tràn ra mặt đất gây cháy thì những phương pháp dập tắt phù hợp là dùng đất, cát phủ kín đám cháy, dùng bình chữa cháy. Không dùng nước phun vào đám cháy vì xăng, dầu không tan trong nước sẽ làm cho xăng, dầu loang ra rộng hơn gây khó khắn trong việc dập tắt đám cháy. Chọn C. Câu 3 Phương pháp: Dựa vào kiến thức về rượu etylic. Cách giải: Công thức cấu tạo thu gọn đúng của rượu etylic là CH3-CH2-OH. Chọn B. Câu 4 Phương pháp: Dựa vào kiến thức về khí thiên nhiên. Cách giải: Thành phần chính của khí thiên nhiên là khí metan. Chọn B. Câu 5 Phương pháp: Dựa vào tính chất hóa học của rượu etylic. Cách giải: Rượu etylic có thể phản ứng với dãy chất gồm oxi, natri và axit axetic. C2H5OH + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 3H2O 2C2H5OH + 2Na ⟶ 2C2H5ONa + H2 C2H5OH + CH3COOH \(\overset{{{H}_{2}}S{{O}_{4(d)}},{{t}^{0}}}{→}\) CH3COOC2H5 + H2O Chọn C. Câu 6 Phương pháp: PTHH: 2C2H5OH + 2Na ⟶ 2C2H5ONa + H2 Dựa vào PTHH ⟹ nC2H5OH ⟹ m. Cách giải: PTHH: 2C2H5OH + 2Na ⟶ 2C2H5ONa + H2 Theo PTHH ⟹ \({n_{{C_2}{H_5}OH}} = 2{n_{{H_2}}} = 2.\frac{{5,6}}{{22,4}} = 0,5(mol)\) Vậy m = 0,5.46 = 23 gam. Chọn C. Câu 7 Phương pháp: Dựa vào tính chất hóa học đặc trưng của metan và etilen. Cách giải: Dùng dung dịch brom có thể phân biệt khí metan và khí etilen. Khí etilen làm mất màu dung dịch brom. PTHH: C2H4 + Br2 ⟶ C2H4Br2. Khí metan không hiện tượng. Chọn C. Câu 8 Phương pháp: Từ 50 ml cồn 90o ⟹ Thể tích rượu etylic nguyên chất. ⟹ Thể tích dung dịch cồn 70o. Cách giải: Thể tích rượu etylic nguyên chất trong 50 ml cồn 90o là \({V_R} = \frac{{90.50}}{{100}} = 45ml\) Vậy thể tích dung dịch cồn 70o có thể pha được từ 50 ml cồn 90o là \({V_{{\rm{dd}}}} = \frac{{45.100}}{{70}} = 64,3ml\) Chọn C. Câu 9 Phương pháp: Hợp chất hữu cơ là hợp chất của cacbon, chỉ có một số ít không là hợp chất hữu cơ (như CO, CO2, H2CO3, các muối cacbonat kim loại…) Cách giải: Dãy gồm các hợp chất hữu cơ là CH4, C2H4, C2H6O, C2H4O2. Chọn B. Câu 10 Phương pháp: Dựa vào kiến thức về axit axetic (giấm ăn). Cách giải: Phương trình hóa học lên men giấm là C2H5OH + O2 \(\xrightarrow{men}\) CH3COOH + H2O. Chọn B. Câu 11 Phương pháp: Gọi số mol của CH4 và C2H4 trong X lần lượt là x và y (mol) Lập hệ hai phương trình dựa vào số mol X và số mol CO2 ⟹ x và y. ⟹ \(\% {V_{C{H_4}}} = \frac{{{V_{C{H_4}}}.100\% }}{{{V_X}}}\) Cách giải: Gọi số mol của CH4 và C2H4 trong X lần lượt là x và y (mol) ⟹ nX = x + y = 0,4 (1) CH4 + 2O2 \(\xrightarrow{{{t}^{0}}}\) CO2 + 2H2O C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 2H2O Theo PTHH ⟹ nCO2 = x + 2y = 0,7 (2) Từ (1) và (2) ⟹ x = 0,1 và y = 0,3. Vậy \(\% {V_{C{H_4}}} = \frac{{{V_{C{H_4}}}.100\% }}{{{V_X}}} = \frac{{2,24.100\% }}{{8,96}} = 25\% \) Chọn B. Câu 12 Phương pháp: Dựa vào kiến thức về độ rượu. Cách giải: Trên nhãn chai cồn ghi là cồn 90o có nghĩa là trong 100 ml hỗn hợp có 90 ml rượu etylic. Chọn D. Câu 13 Phương pháp: Hiđrocacbon là hợp chất hữu cơ mà trong phân tử chỉ chứa 2 nguyên tố là C và H. Cách giải: Dãy chất gồm các hiđrocacbon là C2H2, C2H4, CH4. Chọn D. Câu 14 Phương pháp: Dựa vào tính chất hóa học của ancol etylic và axit axetic. Cách giải: PTHH: CH3COOH + C2H5OH \(\overset{{{H}_{2}}S{{O}_{4(d)}},{{t}^{0}}}{→}\) CH3COOC2H5 + H2O Vậy X là CH3COOC2H5. Chọn A. Câu 15 Phương pháp: Xét tỉ lệ số mol CH3COOH và C2H5OH ⟹ chất phản ứng hết, chất còn dư (khi hiệu suất phản ứng đạt 100%). ⟹ Khối lượng etyl axetat thu được theo lý thuyết (tính số mol theo chất phản ứng hết). ⟹ Hiệu suất phản ứng là \(H = \frac{{{m_{etylaxetat(TT)}}.100\% }}{{{m_{etylaxetat(LT)}}}}\) Cách giải: nCH3COOH = 1 mol ; nC2H5OH = 2 mol. PTHH: CH3COOH + C2H5OH \(\overset{{{H}_{2}}S{{O}_{4(d)}},{{t}^{0}}}{→}\) CH3COOC2H5 + H2O Nhận thấy nCH3COOH/1 = 1 < 2 = nC2H5OH/1 ⟹ CH3COOH phản ứng hết và C2H5OH còn dư (khi hiệu suất phản ứng đạt 100%). Theo PTHH ⟹ netylaxetat(LT) = nCH3COOH = 1 mol ⟹ metylaxetat(LT) = 88 gam. Vậy hiệu suất phản ứng là \(H = \frac{{{m_{etylaxetat(TT)}}.100\% }}{{{m_{etylaxetat(LT)}}}} = \frac{{55.100\% }}{{88}} = 62,5\% \) Chọn A. Câu 16 Phương pháp: Dựa vào tính chất hóa học đặc trưng của rượu etylic và axit axetic. Cách giải: Có thể sử dụng quỳ tím để phân biệt rượu etylic và axit axetic. - Axit axetic làm quỳ tím hóa đỏ. - Rượu etylic không làm đổi màu quỳ tím. Chọn A. Câu 17 Phương pháp: Dựa vào kiến thức về ứng dụng của etilen. Cách giải: Ứng dụng của etilen là sản xuất nhựa PE, PVC, axit axetic; kích thích quả mau chín. Chọn D. Câu 18 Phương pháp: Dựa vào tính chất hóa học của etilen. Cách giải: PTHH: C2H4 + Br2 ⟶ C2H4Br2. Vậy chất X là C2H4Br2. Chọn A. Câu 19 Phương pháp: Gọi công thức phân tử của X là CxHyOz. PTHH: \({{C}_{x}}{{H}_{y}}{{O}_{z}}+(x+\frac{y}{4}-\frac{z}{2}){{O}_{2}}\xrightarrow{{{t}^{0}}}xC{{O}_{2}}+\frac{y}{2}{{H}_{2}}O\) Theo PTHH ⟹ x và y ⟹ z (Do M = 60) ⟹ CTPT của X. Cách giải: nX = 6/60 = 0,1 mol ; nCO2 = 6,72/22,4 = 0,3 mol ; nH2O = 7,2/18 = 0,4 mol. PTHH: Theo PTHH ⟹ \(\left\{ {\begin{array}{*{20}{l}}{{n_{C{O_2}}} = 0,1x = 0,3}\\{{n_{{H_2}O}} = 0,05y = 0,4}\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}{x = 3}\\{y = 8}\end{array}} \right.\) Lại có MX = 12x + y + 16z = 60 ⟹ z = 1. Vậy công thức của X là C3H8O. Chọn D. Câu 20 Phương pháp: Dựa vào kiến thức về phản ứng thế trong hóa học hữu cơ. Cách giải: PTHH thể hiện đúng tính chất của phản ứng thế là CH4 + Cl2 \(\xrightarrow{a/s}\) CH3Cl + HCl. Chọn D. II. TỰ LUẬN Câu 1 Phương pháp: Dựa vào kiến thức về cấu trúc phân tử hợp chất hữu cơ. Cách giải:
Câu 2 Phương pháp: Dựa vào tính chất hóa học của các hợp chất hữu cơ đã học. Cách giải: Chuỗi phản ứng: C2H4 \(\xrightarrow{(1)}\) C2H5OH \(\xrightarrow{(2)}\) CH3COOH \(\xrightarrow{(3)}\) CH3COOC2H5 (1) C2H4 + H2O \(\xrightarrow{Axit}\) C2H5OH (2) C2H5OH + O2 \(\xrightarrow{men}\) CH3COOH + H2O (3) CH3COOH + C2H5OH \(\overset{{{H}_{2}}S{{O}_{4(d)}},{{t}^{0}}}{→}\) CH3COOC2H5 + H2O Câu 3 Phương pháp: PTHH: C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 2H2O Dựa vào PTHH ⟹ nO2 và nCO2 ⟹ VO2 và VCO2. Cách giải: nC2H4 = 5,6/22,4 = 0,25 mol. PTHH: C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 2H2O a) Theo PTHH ⟹ nO2 = 3nC2H4 = 0,75 mol. ⟹ VO2 = 0,75.22,4 = 16,8 lít. b) Theo PTHH ⟹ nCO2 = 2nC2H4 = 0,5 mol. ⟹ VCO2 = 0,5.22,4 = 11,2 lít. HocTot.Nam.Name.Vn |