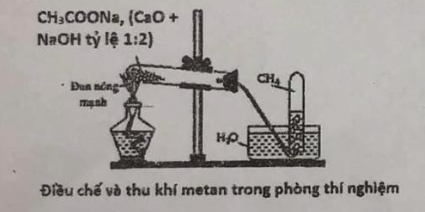
Giải đề thi học kì II hóa học lớp 11 trường THPT Nguyễn Khuyến sở GD tp Hồ Chí MinhGiải chi tiết đề thi kì 2 môn hoá lớp 11 năm 2019 - 2020 trường THPT Nguyễn Khuyến với cách giải nhanh và chú ý quan trọng Đề bài Câu 1 : Bổ túc chuỗi phản ứng, ghi rõ điều kiện phản ứng nếu có (chất hữu cơ viết dưới dạng công thức cấu tạo) Butan\(\xrightarrow{(1)}\)etilen \(\xrightarrow{(2)}\)ancol etylic \(\xrightarrow{(3)}\)andehit axetic \(\xrightarrow{(4)}\)ancol etylic Câu 2: a, Viết phương trình hóa học và nêu hiện tượng xảy ra ở thí nghiệm dưới đây (chất hữu cơ viết dưới dạng CTCT) (1) Sục khí etilen vào ống nghiệm đựng nước brom (2) Dung dịch phenol phản ứng với nước brom b, bằng phương pháp hóa học hãy phân biệt 2 khí (đựng riêng biệt) trong 2 bình mất nhãn sau: axetilen, etilen. c, X là hợp chất hữu cơ mạch hở có 1 liên kết pi trong phân tử. Hidro hóa hoàn toàn X thu được chất hữu cơ Y có tên là 3-metylbutan-1-ol. Viết công thức cấu tạo có thể có của X. Câu 3: Thí nghiệm điều chế metan trong phòng thí nghiệm (như hình vẽ). Hãy cho biết phát biểu sau đây đúng hay sai? (Không cần giải thích)
Câu 4: a, Cho 18,25 gam hỗn hợp X gồm andehit axetic và andehit propioic phản ứng với dung dịch AgNO3/NH3 dư thu được 81 gam kim loại Ag. - Viết phương trình hóa học xảy ra - Tính khối lượng mỗi chất có trong 18,25 gam hỗn hợp X b, Đốt cháy hoàn toàn 6,72 gam một ancol X đơn chức, mạch hở (CxHyO) bằng khí oxi dư rồi hấp thụ hoàn toàn sản phẩm cháy bằng nước vôi trong dư thu được 36 gam kết tủa, đồng thời thấy khối lượng dung dịch nước vôi trong giảm 15,84 gam. Tìm số mol CO2 và số mol H2O sinh ra sau phản ứng cháy. Xác định CTCT phù hợp của X. Câu 5: Hỗn hợp X gồm 3 ancol no, đơn chức mạch hở và glixerol trong đó oxi chiếm 39,785% khối lượng hỗn hợp. Cho m gam hỗn hợp X hòa tan tối đa 7,84 gam Cu(OH)2. Đốt cháy m gam hỗn hợp X cần 37,408 lít O2. Tính phần trăm khối lượng glixerol có trong X. Lời giải chi tiết Câu 1: Phương pháp giải: Xem lại phần điều chế hidrocacbon và dẫn xuất hidrocacbon Hướng dẫn giải: C4H10 \(\xrightarrow[{{t}^{0}},xt]{cracking}\)C2H4 + C2H6 C2H4 + H2O \(\xrightarrow{axit,{{t}^{0}}}\)C2H5OH C2H5OH + O2 \(\xrightarrow{xt,{{t}^{0}}}\)CH3CHO + H2O CH3CHO + H2 \(\xrightarrow{Ni,{{t}^{0}}}\)C2H5OH Câu 2 Phương pháp giải a, Xem lại phần tính chất hóa học của etilen và phenol b, Xem lại phần so sánh tính chất hóa học của axetilen và etilen Hướng dẫn giải a, PTHH: CH2=CH2 +Br2 → CH2Br-CH2Br Hiện tượng: Khí etilen đi vào làm cho nước Brom bị nhạt màu b, Đưa lần lượt 2 khí trên vào dung dịch AgNO3/NH3. Sau một thời gian, khí nào khiến dung dịch có xuất hiện kết tủa thì khí đó là C2H2. PTHH: C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO Khí không cho hiện tượng gì là C2H4. Câu 3: Phương pháp giải: Xem lại phần điều chế khí metan và đặc điểm của khí metan để trả lời cho mỗi nhận định. Hướng dẫn giải: (1) Đúng (2) Sai Khí metan được thu bằng phương pháp đẩy nước, ta có thể dùng được phương pháp này là do khí metan không tan trong nước. (3) Sai do khí metan nhẹ hơn không khí nên cần để miệng ống nghiệm hơn hướng lên cho khí metan bay ra. Câu 4 Phương pháp giải: a, Xem lại tính chất hóa học của andehit - Viết PTHH - Đặt số mol của CH3CHO và C2H5CHO lần lượt là x, y - Lập hệ 2 phương trình theo dữ kiện số liệu đề cho và phương trình hóa học để tìm x, y => Khối lượng mỗi chất b, - Tính được nCO2, nH2O dựa vào thí nghiệm sục hỗn hợp khí và hơi vào nước vôi trong dư Khối lượng dung dịch giảm = mCO2 +mH2O –mkết tủa Áp dụng định luật bảo toàn nguyên tố, bảo toàn khối lượng => CTCT phù hợp của X Hướng dẫn giải: a, PTHH CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag + 2NH4NO3 (1) C2H5CHO + 2AgNO3 + 3NH3 → C2H5COONH4 + 2Ag + 2NH4NO3 (2) Gọi số mol CH3CHO, C2H5CHO lần lượt là x, y mol Khối lượng của 2 andehit nặng 18,25 gam => 44x +58y = 18,25 (I) nAg sinh ra = 81 : 108 = 0,75 (mol) (1) nAg= 2 nCH3CHO = 2x (2) nAg = 2 nC2H5CHO = 2y => 2x + 2y = 0,75 (II) Từ (I) và (II) => x = 0,25 y =0,125 mCH3CHO = 0,25 * 44 = 11 (gam) mC2H5CHO = 0,125 * 58 = 7,25 (gam) b, Khi đốt ancol thì sau phản ứng sẽ sinh ra khí CO2 và H2O Sục hỗn hợp khí trên vào Ca(OH)2 sẽ xảy ra phương trình: CO2 + Ca(OH)2→ CaCO3 + H2O (1) => mCaCO3 = 36 gam nCaCO3 = 36 : 100 = 0,36 (mol) (1) nCO2 = nCaCO3 = 0,36 (mol) Mặt khác ta thấy khối lượng dung dịch nước vôi trong giảm 15,84 gam => mCO2 + mH2O –mCaCO3 = - 15,54 (gam) mH2O = 15,84 + mCaCO3 – mCO2 = - 15,84 +36 – 0,36 * 44 = 4,32 (gam) nH2O = 4,32 : 18 = 0,24 (mol) Xét trong X: nC(X) = nC(CO2) = 0,36 (mol) nH(X) = 2nH(H2O)= 2*0,24 = 0,48(mol) => mO(X) = 6,72 – 0,36 * 12 – 0,48 = 1,92 nO(X) = 1,92 : 16 = 0,12 (mol) Xét X có nO : nC : nH = 0,12 : 0,36 : 0,48 = 1:3:4 Mà X lại là ancol đơn chức => chỉ có 1 nguyên tử O trong phân tử => CTPT X là: C3H4O Vì X là ancol, nhóm –OH phải gắn được vào C no => CTCT X là: CH≡C-CH2OH Câu 5: Phương pháp giải: - Chỉ có glixerol mới tác dụng được với Cu(OH)2 => Từ lượng Cu(OH)2 sẽ tìm ra được số mol glixerol - Quy đổi hỗn hợp X thành CH2 (a mol); H2O (b mol) và C3H5(OH)3 Từ số mol O2 phản ứng => Số mol O trong X => MX => % glixerol có trong X Hướng dẫn giải nCu(OH)2 = 0,08 (mol) Ta có phương trình phản ứng: 2C3H8O3 + Cu(OH)2 → (C3H7O3)2Cu + 2H2O (1) Từ (1) nC3H8O3 = 2nCu(OH)2 = 0,08 * 2 = 0,16 (mol) Vì X gồm ancol no, đơn chức mạch hở và glixerol nên ta có thể quy đổi X thành: CH2 (a mol); H2O (b mol); C3H5(OH)3 (0,16 mol) Khi đốt cháy X thì nO2 = 37,408 : 22,4 = 1,67 (mol) a mol CH2 sẽ tác dụng với (1+0,5) a mol O2 0,16 mol C3H8O3 sẽ tác dụng với 0,56 mol O2 => 1,5 a + 0,56 = 1,67 (I) Mặt khác, oxi chiếm 39,785% khối lượng hỗn hợp X (16b + 16 * 3) : (14 a + 18b + 0,16 * 92) = 39,785 % (II) Từ (I) và (II) => a =0,74 ; b =0,26 MX = 0,74 * 14 + 0,26 * 18 + 0,16 * 92 = 29,76 (gam) % khối lượng glixerol có trong X là: 0,16 * 92 : 29,76 * 100% = 49,46% Nguồn: Sưu tầm HocTot.Nam.Name.Vn |