50 câu hỏi thông hiểu về sự ăn mòn kim loại có lời giải (phần 2)Làm bàiCâu hỏi 1 : Thực hiện các thí nghiệm sau: (1) Thả một viên Fe vào dung dịch HCl. (2) Thả một viên Fe vào dung dịch Cu(NO3)2. (3) Thả một viên Fe vào dung dịch FeCl3. (4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm. (5) Đốt một dây Fe trong bình kín chứa đầy khí O2. (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng. Các thí nghiệm mà Fe không bị ăn mòn điện hóa học là
Đáp án: D Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: (1) Thả một viên Fe vào dung dịch HCl. Fe bị ăn mòn hóa học (2) Thả một viên Fe vào dung dịch Cu(NO3)2. Fe bị ăn mòn điện hóa (3) Thả một viên Fe vào dung dịch FeCl3. Fe bị ăn mòn hóa học (4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm. Fe bị ăn mòn điện hóa. (5) Đốt một dây Fe trong bình kín chứa đầy khí O2. Fe bị ăn mòn hóa học (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng. Fe bị ăn mòn điện hóa. Đáp án D Câu hỏi 2 : Cho các hợp kim sau: Al – Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa học là
Đáp án: D Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: Al – Zn (1) Al bị ăn mòn điện hóa học Fe – Zn (2) Zn bị ăn mòn điện hóa học Zn – Cu (3) Zn bị ăn mòn điện hóa học Mg – Zn (4) Mg bị ăn mòn điện hóa học Đáp án D Câu hỏi 3 :
Đáp án: A Phương pháp giải: Lời giải chi tiết: Cốc 1 ăn mòn hóa học Cốc 2 sắt bị ăn mòn điện hóa Cốc 3 sắt được bảo vệ kẽm bị ăn mòn điện hóa Đáp án A Câu hỏi 4 : Tiến hành các thí nghiệm sau: (a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng; (b) Đốt dây Fe trong bình đựng khí O2; (c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3; (d) Cho lá Zn vào dung dịch HCl; Số thí nghiệm có xảy ra ăn mòn điện hóa là
Đáp án: C Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li (a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng; ăn mòn điện hóa (b) Đốt dây Fe trong bình đựng khí O2; ănmòn hóa học (c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3; ănmòn hóa học (d) Cho lá Zn vào dung dịch HCl; ănmòn hóa học Đáp án C Câu hỏi 5 : Cho các cặp kim loại tiếp xúc trực tiếp Fe-Pb, Fe-Zn, Fe-Sn, Fe-Ni, Fe-Cu, nhúng từng cặp kim loại vào dung dịch axit. Số cặp kim loại mà Fe bị ăn mòn trước là:
Đáp án: B Phương pháp giải: Ghi nhớ dãy điện hóa của KL, sắt đứng trước kim loại nào trong dãy điện hóa thì bị phá hủy trước. Lời giải chi tiết: Fe-Pb :sắt bị ăn mòn trước Fe-Zn: kẽm bị ăn mòn trước Fe-Sn: sắt bị ăn mòn trước Fe-Ni: sắt bị ăn mòn trước Fe-Cu: sắt bị ăn mòn trước Đáp án B Câu hỏi 6 : Số thí nghiệm xảy ra ăn mòn điện hóa trong các thí nghiệm sau là bao nhiêu? 1. Nhúng thanh Zn vào dung dịch AgNO3. 2. Cho vật bằng gang vào dung dịch HCl. 3. Cho Na vào dung dịch CuSO4. 4. Để miếng tôn (Fe trắng Zn) có vết xước sâu ngoài không khí ẩm 5. Cho đinh sắt vào dung dịch H2SO4 2M. 6. Cho Mg vào dung dịch FeCl3 dư
Đáp án: A Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li (1) Nhúng thanh Zn vào dung dịch AgNO3; ăn mòn điện hóa (2) Cho vật bằng gang vào dung dịch HCl; ăn mòn điện hóa (3) Cho Na vào dung dịch CuSO4; ăn mòn hóa học (4) Để miếng tôn (Fe trắng Zn) có vết xước sâu ngoài không khí ẩm; ăn mòn điện hóa (5) Cho đinh sắt vào dung dịch H2SO4 2M; ăn mòn hóa học (6) Cho Mg vào dung dịch FeCl3 dư; ăn mòn hóa học Đáp án A Câu hỏi 7 : Có 6 dung dịch riêng biệt: Fe(NO3)3, AgNO3, CuSO4, ZnCl2, Na2SO4, MgSO4. Nhúng vào mỗi dung dịch một thanh Cu kim loại, số trường hợp xảy ra ăn mòn điện hóa là:
Đáp án: B Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Fe(NO3)3 ăn mòn hóa học vì xảy ra phản ứng: Cu + Fe(NO3)3 → Cu(NO3)2 + Fe(NO3)2 AgNO3 ăn mòn điện hóa vì Cu tác dụng với AgNO3 thu được cặp điện cực Cu-Ag nhúng vào dung dịch điện li nên xảy ra ăn mòn điện hóa: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag CuSO4 không xảy ra ăn mòn vì không có phản ứng hóa học xảy ra. ZnCl2 không xảy ra ăn mòn vì không có phản ứng hóa học xảy ra. Na2SO4 không xảy ra ăn mòn vì không có phản ứng hóa học xảy ra. MgSO4 không xảy ra ăn mòn vì không có phản ứng hóa học xảy ra. Như vậy có 1 trường hợp xuất hiện hiện tượng ăn mòn điện hóa. Đáp án B Câu hỏi 8 : Có 4 dung dịch riêng biệt: a) HCl, b) CuCl2, c) FeCl3, d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hoá là
Đáp án: C Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: HCl + Fe → ăn mòn hóa học CuCl2 + Fe → ăn mòn điện hóa FeCl3 + Fe → ăn mòn hóa học HCl có lẫn CuCl2 + Fe → ăn mòn điện hóa Đáp án C Câu hỏi 9 : Thực hiện các thí nghiệm sau: (1) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2; (2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3; (3) Nhúng thanh Fe nguyên chất vào dung dịch HCl loãng, có lẫn CuCl2; (4) Cho dung dịch FeCl3 vào dung dịch AgNO3; (5) Để thanh thép lâu ngày ngoài không khí ẩm. Số trường hợp xảy ra ăn mòn điện hóa là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Trường hợp xảy ra ăn mòn điện hóa: (1) ; (3) ; (5) Đáp án D Câu hỏi 10 : Thực hiện các thí nghiệm sau: (1) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2. (2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3. (3) Nhúng thanh Fe nguyên chất vào dung dịch HCl loãng, có lẫn CuCl2. (4) Cho dung dịch FeCl3 vào dung dịch AgNO3. (5) Để thanh thép lâu ngày ngoài không khí ẩm. Số trường hợp xảy ra ăn mòn điện hóa học là:
Đáp án: A Phương pháp giải: Phương pháp: Ăn mòn điện hóa học xuất hiện khi có 2 cặp điện thế kim loại Lời giải chi tiết: Hướng dẫn giải: Các trường hợp xảy ra ăn mòn điện hóa học là: (1), (3), (5) Đáp án A Câu hỏi 11 : Thực hiện các thí nghiệm sau: (1) Nhúng thanh Fe vào dung dịch HCl loãng. (2) Nhúng thanh Fe vào dung dịch FeCl3. (3) Nhúng thanh Fe vào dung dịch CuCl2. (4) Nhúng thanh Fe vào dung dịch HCl có lẫn một ít CuCl2. (5) Nhúng thanh Fe vào dung dịch ZnCl2. (6) Nhúng thanh Fe vào dung dịch HCl có lẫn một ít MgCl2. Số thí nghiệm xảy ra ăn mòn điện hóa là.
Đáp án: D Phương pháp giải: Lời giải chi tiết: Có : 3 , 4 Điều kiện xảy ra ăn mòn điện hóa học: đồng thời cả 3 điều kiện sau - Các điện cực phải khác nhau về bản chất. Có thể là cặp hai kim loại khác nhau, kim loại – phi kim hay kim loại – hợp chất. Kim loại có thế điện cực chuẩn nhỏ hơn là cực âm - Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn - Các điện cực cùng tiếp xúc với dung dịch chất điện li 5 ,6 khác kim loại nhưng không có phản ứng xảy ra ; ko có sự cho nhận e Đáp án D Câu hỏi 12 : Tiến hành các thí nghiệm sau : (1) Thả 1 viên Mg vào dung dịch HCl có nhỏ giọt dung dịch CuSO4 (2) Thả viên Fe vào dung dịch Fe2(SO4)3 (3) Thả viên Fe vào dung dịch Cu(NO3)2 (4) Thả viên Zn vào dung dịch H2SO4 Số thí nghiệm xảy ra ăn mòn điện hóa là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Gồm (1) và (3) Đáp án D Câu hỏi 13 : Cho các thí nghiệm sau: (1): Để một miếng gang (Fe – C) ngoài không khí ẩm. (2): Nhúng một thanh Fe vào dung dịch FeCl3. (3): Nhúng một thanh Cu vào dung dịch FeCl3. (4): Nhúng một thanh Fe vào dung dịch CuSO4. Số thí nghiệm xảy ra ăn mòn điện hoá là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Câu hỏi 14 : Thực hiện các thí nghiệm sau (1) Nhúng thanh Fe nguyên chất vào dung dịch hỗn hợp NaNO3 và HCl (2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3 (3) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2 (4) Nối thanh nhôm với thanh đồng, để ngoài không khí ẩm. Số trường hợp xảy ra ăn mòn điện hóa học là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Các thí nghiệm xảy ra ăn mòn điện hóa học là (3), (4). Đáp án C. Câu hỏi 15 : Cho các hợp kim sau: Cu – Fe (1); Zn – Fe (II); Fe – C Cho các hợp kim sau: Cu – Fe (1); Zn – Fe (II); Fe – C (III); Sn – Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Hợp kim mà khi tiếp xúc với dung dịch chất điện li Fe bị ăn mòn trước là (I) (III) (IV) Đáp án B Câu hỏi 16 : Tiến hành các thí nghiệm sau: (1) Cho lá sắt vào dụng dịch HCl có thêm vài giọt CuSO4 (2) Cho lá sắt vào dụng dịch FeCl3 (3) Cho lá thép vào dụng dịch ZnSO4 (4) Cho lá sắt vào dụng dịch CuSO4 (5) Cho lá kẽm vào dụng dịch HCl Số trường hợp xảy ra sự ăn mòn điện hóa là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Các trường hợp xảy ra ăn mòn điện hóa là: (1); (3),(4) Đáp án D Câu hỏi 17 : Để chống ăn mòn cho đường ống dẫn dầu bằng thép chôn dưới đất, người ta dùng phương pháp điện hoá. Trong thực tế, người ta dùng kim loại nào sau đây làm điện cực hi sinh?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Kim loại dùng làm điện có tính khử mạnh hơn sắt loại B, C D vì Na có tính khử quá mạnh không thể dùng làm điện cực hi sinh. Đáp án A Câu hỏi 18 : Tiến hành các thí nghiệm sau đây: a) Ngâm một lá kẽm vào dung dịch CuSO4 b) Để thép cacbon ngoài không khí ẩm c) Cho sắt vào dung dịch axit clohidric d) Cho sắt vào dung dịch chứa CuSO4 vào H2SO4 Trong các thí nghiệm trên có bao nhiêu trường hợp xảy ra ăn mòn điện hóa
Đáp án: B Phương pháp giải: Lời giải chi tiết: Gồm có: (a), (b), (d) Đáp án B Câu hỏi 19 : Cho các thí nghiệm sau : (1) Thanh Fe nhúng vào dung dịch H2SO4 loãng (2) Thanh Fe có quấn dây Cu vào dung dịch H2SO4 loãng (3) Thanh Cu mạ Ag nhúng vào dung dịch HCl (4) Thanh Fe tráng thiếc bị xước sâu vào tới Fe nhúng vào dung dịch H2SO4 loãng (5) Miếng gang để trong không khí ẩm Hãy cho biết có bao nhiêu quá trình xảy ra ăn mòn điện hóa :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Điều kiện để ăn mòn điện hóa : + 2 thanh điện cực khác bản chất (KL-KL, KL-PK,…) + 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp + Cùng nhúng vào 1 dung dịch chất điện ly => Các thí nghiệm thỏa mãn : (2) [Fe-Cu] , (3) [Cu-Ag] , (4) [Fe-Sn] , (5) [Fe-C] Đáp án B Câu hỏi 20 : Cho các kim loại: Fe, Cu, Al và các dung dịch: HCl, FeCl2, FeCl3, AgNO3. Cho từng kim loại vào từng dung dịch muối , có bao nhiêu trường hợp xảy ra phản ứng ?
Đáp án: D Phương pháp giải: Fe tác dụng được với: HCl, FeCl3, AgNO3 Cu tác dụng được với: FeCl3, AgNO3 Al tác dụng được với: HCl, FeCl2, FeCl3, AgNO3 Lời giải chi tiết: Fe tác dụng được với: HCl, FeCl3, AgNO3 Cu tác dụng được với: FeCl3, AgNO3 Al tác dụng được với: HCl, FeCl2, FeCl3, AgNO3 => Số phản ứng xảy ra: 9 Đáp án D Câu hỏi 21 : Có những cặp kim loại sau đây tiếp xúc với nhau và cùng tiếp xúc với dung dịch điện li: Zn - Fe, Cu - Fe, Fe- Ni, Mg - Fe, Fe - Ag. Có mấy cặp Fe bị ăn mòn điện hoá:
Đáp án: C Phương pháp giải: Để Fe bị ăn mòn điện hóa thì Fe phải đóng vai trò là cực âm bị ăn mòn (Kim loại trong hợp kim với Fe phải yếu hơn Fe trong dãy hoạt động hóa học) Lời giải chi tiết: Để Fe bị ăn mòn điện hóa thì Fe phải đóng vai trò là cực âm bị ăn mòn (Kim loại trong hợp kim với Fe phải yếu hơn Fe trong dãy hoạt động hóa học) => Các cặp Fe bị ăn mòn là: Cu - Fe, Fe - Ni, Fe - Ag Đáp án C Câu hỏi 22 : Thực hiện thí nghiệm như hình vẽ bên dưới:
Hãy cho biết phát biểu nào sau đây không đúng? Cu2+
Đáp án: C Phương pháp giải: Lời giải chi tiết: Khí H2 thoát ra ở 2 cực nhưng thoát ra ở cực Zn nhiều hơn Đáp án C Câu hỏi 23 : Tiến hành các thí nghiệm sau: (a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3. (b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm. (c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4. (d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối. Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
Đáp án: D Phương pháp giải: - Phân biệt sự ăn mòn hóa học và sự ăn mòn điện hóa + Sự ăn mòn hóa học: là quá trình oxh hóa khử trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. + Sự ăn mòn điện hóa: là quá trình oxh khử trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li tạo nên dòng electron chuyển dời từ anot sang catot. - Điều kiện để xảy ra ăn mòn điện hóa + các điện cực phải khác nhau: có thể là cặp kim loại khác nhau; hoặc cặp kim loại – phi kim © + Các điện cực phải tiếp xúc với nhau + Các điện cực cùng tiếp xúc với dung dịch điện li Lời giải chi tiết: (a) Cu + 2FeCl3 → CuCl2 + 2FeCl2 => Ăn mòn hóa học (b) Tạo thành cặp điện cực. Ăn mòn điện hóa (c) Zn + CuSO4 → Cu + ZnSO4 Tạo thành cặp điện cực cùng nhúng trong dung dịch chất điện ly => Có ăn mòn điện hóa (d) Cặp điện cực cùng nhúng trong dung dịch chất điện ly => Ăn mòn điện hóa Đáp án D Câu hỏi 24 : Tiến hành 6 thí nghiệm sau: - TN1: Nhúng thanh sắt vào dung dịch FeCl3. - TN2: Nhúng thanh sắt vào dung dịch CuSO4. - TN3: Cho chiếc đinh làm bằng thép vào bình chứa khí oxi, đun nóng. - TN4: Cho chiếc đinh làm bằng thép vào dung dịch H2SO4 loãng. - TN5: Nhúng thanh đồng vào dung dịch Fe2(SO4)3. - TN6: Nhúng thanh nhôm vào dung dịch H2SO4 loãng có hòa tan vài giọt CuSO4. Số trường hợp xảy ra ăn mòn điện hóa là
Đáp án: C Phương pháp giải: Điều kiện xảy ra ăn mòn điện hóa thỏa mãn 3 điều kiện sau: + các điện cực phải khác nhau về bản chất, có thể là hai cặp kim loại khác nhau, hoặc cặp kim loại – phi kim (vd Fe và C); hoặc kim loại và hợp chất hóa học + các điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn + Các điện cực cùng tiếp xúc với dung dịch chất điện li Lời giải chi tiết: Có 3 thí nghiệm xảy ra ăn mòn điện hóa là: TN2, TN4, TN6 TN1, TN3, TN5 là ăn mòn hóa học Đáp án C Câu hỏi 25 : Thực hiện các thí nghiệm sau: (1) Thả một viên Fe vào dung dịch HCl (2) Thả một viên Fe vào dung dịch Cu(NO3)2 (3) Thả một viên Fe vào dung dịch FeCl3 (4) Nối một dây Cu với một dây Fe rồi để trong không khí ẩm (5) Đốt một dây sắt trong bình chứa đầy khí Oxi (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng Trong các thí nghiệm trên, thí nghiệm mà Fe không bị ăn mòn điện hóa là
Đáp án: C Phương pháp giải: Điều kiện xảy ra ăn mòn điện hóa học + 2 điện cực khác nhau về bản chất: KL – KL; PK-KL; KL- hợp chất + 2 điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau + 2 điện cực phải tiếp xúc với dung dịch chất điện li Phải thỏa mãn cả 3 điều kiện trên mới xảy ra ăn mòn điện hóa Lời giải chi tiết: Các thí nghiệm Fe không bị ăn mòn điện hóa là: (1), (3), (5) (2) Fe ăn mòn điện hóa vì thỏa mãn điều kiện + 2 cặp điện cực khác nhau về bản chất: Fe2+/Fe ; Cu2+/Cu + 2 điện cực này tiếp xúc trực tiếp với nhau + 2 cặp cặp điện cực nhúng trong dd chất điện li là CuSO4 (5) Fe ăn mòn điện hóa vì thỏa mãn điều kiện + 2 cặp điện cực khác nhau về bản chất: Fe2+/Fe ; Cu2+/Cu + 2 điện cực này tiếp xúc trực tiếp với nhau + 2 cặp cặp điện cực nhúng trong dd chất điện li là không khí ẩm (có nước, axit) (6) Fe ăn mòn điện hóa vì thỏa mãn điều kiện + 2 cặp điện cực khác nhau về bản chất: Fe2+/Fe ; Cu2+/Cu + 2 điện cực này tiếp xúc trực tiếp với nhau + 2 cặp cặp điện cực nhúng trong dd chất điện li là H2SO4 Đáp án C Câu hỏi 26 : Tiến hành các thí nghiệm sau (a) Ngâm lá đồng trong dung dịch AgNO3 (b) Ngâm lá kẽm trong dung dịch HCl loãng (c) Ngâm lá nhôm trong dung dịch NaOH (d) Ngâm lá sắt được cuốn dây đồng trong dung dịch NaOH (e) Để một vật bằng gang ngoài không khí ẩm (f) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3 Số thí nghiệm xảy ra ăn mòn điện hóa là
Đáp án: D Phương pháp giải: Điều kiện để xảy ra ăn mòn điện hóa học là + Xuất hiện ít nhất 2 điện cực khác nhau về bản chất như: KL –KL; KL – PK; KL- Hợp chất + các chất tham gia phản ứng tiếp xúc trực tiếp hoặc gián tiếp với nhau + Cùng nhúng trong 1 dung dịch chất điện li Lời giải chi tiết: (a) tạo ra 2 kim loại là Cu và Ag nên là ăn mòn điện hóa (b) là ăn mòn hóa học (c) là ăn mòn hóa học (d) là ăn mòn điện hóa (e) là ăn mòn điện hóa (f) là ăn mòn hóa học Đáp án D Câu hỏi 27 : Thực hiện các thí nghiệm sau : (1) Thả 1 viên Fe vào dung dịch HCl (2) Thả 1 viên Fe vào dung dịch CuSO4 (3) Thả 1 viên Fe vào dung dịch FeCl3 (4) Nối 1 dây Cu với 1 dây Fe rồi để trong không khí ẩm (5) Đốt 1 dây Fe trong bình kín chứa đầy khí O2 (6) Thả 1 viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng Trong các thí nghiệm trên, trường hợp Fe không bị ăn mòn điện hóa học là :
Đáp án: D Phương pháp giải: Điều kiện thỏa mãn ăn mòn điện hóa là : +) 2 điện cực khác bản chất (KL-KL, KL-PK, KL – hợp chất) +) 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp với nhau +) 2 điện cực cùng nhúng vào dung dịch điện ly Lời giải chi tiết: Trường hợp Fe không bị ăn mòn điện hóa là: (1), (3), (5). Đáp án D Câu hỏi 28 : Tiến hành các thí nghiệm sau : (a) Nhúng thanh Zn nguyên chất vào dung dịch HCl dư (b) Nhúng thanh Cu nguyên chất vào dung dịch AgNO3 (c) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3 (d) Để miếng sắt tây (sắt tráng thiếc) trong không khí ẩm (e) Nhúng thanh gang (hợp kim của Fe và C) vào dung dịch NaCl bão hòa Trong các thí nghiệm trên, số thí nghiệm chỉ tạo ra ăn mòn hóa học :
Đáp án: D Phương pháp giải: Điều kiện để có sự ăn mòn điện hóa : +) 2 điện cực khác bản chất (KL-KL, KL-PK, …) +) 2 điện cực cùng nhúng vào dung dịch điện ly +) 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp với nhau Lời giải chi tiết: Ăn mòn hóa học : (a), (c) Ăn mòn điện hóa : (b) Cu-Ag ; (d) Fe-Sn ; (e) Fe-C Đáp án D Câu hỏi 29 : Tiến hành các thí nghiệm sau: (a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng. (b) Đốt dây Fe trong bình đựng khí O2 (c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3 (d) Cho lá Zn vào dung dịch HCl Số thí nghiệm có xảy ra ăn mòn điện hóa là
Đáp án: D Phương pháp giải: Điều kiện xảy ra ăn mòn điện hóa học là: + Xuất hiện 2 cặp điện cực khác nhau về bản chất như: KL - KL; KL -PK; KL - HK + Các chất tiếp xúc trực tiếp hoặc gián tiếp với nhau + Cùng nhúng trong 1 dung dịch chất điện li Lời giải chi tiết: chỉ có thí nghiệm (a) xảy ra ăn mòn điện hóa vì thỏa mãn điều kiện + Xuất hiện 2 cặp điện cực khác nhau về bản chất là Cu2+/Cu và Fe2+/Fe + 2 chất tham gia phản ứng tiếp xúc trực tiếp với nhau + cùng nhúng trong 1 dung dịch chất điện li là H2SO4 loãng. Đáp án D Câu hỏi 30 : Vỏ tàu biển làm bằng thép thường có ghép những mảnh kim loại khác để làm giảm ăn mòn vỏ tàu trong nước biển. Kim loại nào trong số các kim loại dưới đây phù hợp tốt nhất cho mục đích này là:
Đáp án: A Phương pháp giải: Lý thuyết về pin điện hóa – Ăn mòn điện hóa Lời giải chi tiết: Khi gắn tấm kẽm lên vỏ tầu thủy tức là ta tạo ra 1 pin điện Zn-Fe trong đó Zn là cực âm là Zn và cực dương là Fe(trong thép). Trong pin điện hóa, anot xảy ra quá trình oxi hóa Zn: Zn → Zn2+ + 2e => Zn sẽ bị oxi hóa trước Fe Đáp án A Câu hỏi 31 : Tiến hành các thí nghiệm sau: (a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3. (b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm. (c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4. (d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc đựng dung dịch NaCl. Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn điện hóa học là
Đáp án: B Phương pháp giải: ăn mòn hóa học: là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. ăn mòn điện hóa học: là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương Điều kiện xảy ra ăn mòn điện hóa học là: + Xuất hiện ít nhất 2 cặp điện cực khác nhau về bản chất như: KL-KL ; KL- PK; KL- HC + Các chất phải tiếp xúc trực tiếp hoặc gián tiếp với nhau thông qua dây dẫn + Cùng nhúng trong 1 dung dịch chất điện li Lời giải chi tiết: (a) chỉ xảy ra ăn mòn hóa học (b) xảy ra cả ăn mòn hóa học và ăn mòn điện hóa học (c) xảy ra ăn mòn hóa học và điện hóa học (d) Chỉ xảy ra ăn mòn điện hóa học Vậy chỉ có 1 thí nghiệm (d) xảy ra ăn mòn điện hóa học Đáp án B Câu hỏi 32 : Tiến hành 4 thí nghiệm sau :
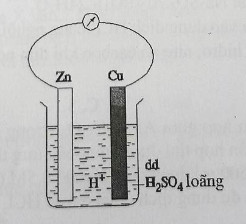
Đáp án: C Phương pháp giải: Điều kiện xảy ra ăn mòn điện hóa học: + Xuất hiện 2 điện cực có bản chất khác nhau: KL - KL; KL - PK; KL - hợp chất + Các chất tiếp xúc trực tiếp hoặc gián tiếp với nhau + Cùng nhúng trong một dung dịch chất điện li Lời giải chi tiết: a) chỉ ăn mòn hóa học b) xuất hiện cặp kim loại Fe - Cu khác nhau → ăn mòn điện hóa c) chỉ là ăn mòn hóa học d) xuất hiện cặp kim loại Fe - Cu khác nhau → ăn mòn điện hóa Vậy có 2 thí nghiệm xuất hiện ăn mòn điện hóa Đáp án C Câu hỏi 33 : Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương. M → Mn+ + ne Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học: - Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. - Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương. Thí nghiệm 1: Nhúng thanh sắt vào dung dịch H2SO4 1M thấy bọt khí H2 thoát ra chậm. Thí nghiệm 2: Nhúng thanh sắt và thanh đồng được nối với nhau bằng dây dẫn vào dung dịch H2SO4 1M thấy bọt khí thoát ra nhanh và mạnh hơn. Thí nghiệm 3: Tiến hành thí nghiệm như hình vẽ sau (3 cốc đều chứa dung dịch axit HCl có cùng thể tích và nồng độ mol): Câu 1: Trong Thí nghiệm 1, thanh sắt bị ăn mòn theo kiểu nào sau đây?
Đáp án: B Phương pháp giải: Dựa vào định nghĩa về các loại ăn mòn kim loại. Lời giải chi tiết: Phản ứng xảy ra trong thí nghiệm 1: Fe + H2SO4 → FeSO4 + H2 Quá trình cho - nhận e: Fe → Fe2+ + 2e 2H++ 2e → H2 Ta thấy electron do Fe nhường được chuyển trực tiếp đến dung dịch H2SO4 để tạo khí H2 nên thanh sắt bị ăn mòn theo kiểu ăn mòn hóa học. Chọn B. Câu 2: Trong Thí nghiệm 2, thanh sắt và thanh đồng được nối với nhau bằng dây dẫn cùng nhúng trong dung dịch chất điện li tạo thành một cặp pin điện hóa. Quá trình xảy ra tại catot của pin điện này là
Đáp án: C Phương pháp giải: Trong pin điện, chất có tính khử mạnh hơn đóng vai trò anot, chất có tính khử yếu hơn đóng vai trò là catot: - Tại anot xảy ra quá trình oxi hóa. - Tại catot xảy ra quá trình khử. Lời giải chi tiết: Pin điện Fe - Cu cùng được nhúng trong dung dịch chất điện li H2SO4 thì Fe đóng vai trò anot (-) còn Cu đóng vai trò catot (+). Các bán phản ứng xảy ra tại các cực là: - Anot (-): Fe → Fe2+ + 2e - Catot (+): 2H+ + 2e → H2 Khí thoát ra bám vào điện cực Cu nên không ngăn cản sự tiếp xúc của Fe với H+nên ở thí nghiệm 2 khí thoát ra nhanh và mạnh hơn so với thí nghiệm 1. Chọn C. Câu 3: Trong Thí nghiệm 3, đinh sắt trong cốc nào bị ăn mòn nhanh nhất?
Đáp án: A Phương pháp giải: Trong pin điện hóa, kim loại đóng vai trò anot (kim loại có tính khử mạnh hơn) bị ăn mòn. Lời giải chi tiết: Cốc 1: Đinh sắt bị ăn mòn hóa học. Khí H2 sinh ra bám vào bề mặt của đinh sắt, ngăn cản sự tiếp xúc của đinh sắt với dung dịch HCl nên khí thoát ra chậm. ⟹ Đinh sắt bị ăn mòn chậm. Cốc 2: Đinh sắt và dây đồng tiếp xúc trực tiếp với nhau, cùng được nhúng trong dung dịch chất điện li HCl nên có xảy ra hiện tượng ăn mòn điện hóa. Đinh sắt đóng vai trò anot (do Fe có tính khử mạnh hơn Cu) nên bị ăn mòn. Khí sinh ra trên bề mặt thanh Fe giảm nên sự tiếp xúc giữa Fe và dung dịch HCl tăng lên. ⟹ Đinh sắt bị ăn mòn nhanh. Cốc 3: Đinh sắt và dây kẽm tiếp xúc trực tiếp với nhau, cùng được nhúng trong dung dịch chất điện li HCl nên có xảy ra hiện tượng ăn mòn điện hóa. Dây kẽm đóng vai trò anot (do Zn có tính khử mạnh hơn Fe) nên bị ăn mòn. ⟹ Đinh sắt được bảo vệ. Vậy đinh sắt trong cốc 2 bị ăn mòn nhanh nhất. Chọn A. Câu hỏi 34 : Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93 Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương. M → Mn+ + ne Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học: - Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. - Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương. Thí nghiệm 1: Tiến hành thí nghiệm theo các bước sau: Bước 1: Rót dung dịch H2SO4 loãng vào cốc thủy tinh. Bước 2: Nhúng thanh kẽm và thanh đồng (không tiếp xúc nhau) vào cốc đựng dung dịch H2SO4 loãng. Bước 3: Nối thanh kẽm với thanh đồng bằng dây dẫn (có mắc nối tiếp với một điện kế). Thí nghiệm 2: Để 3 thanh hợp kim: Cu-Fe (1); Fe-C (2); Fe-Zn (3) trong không khí ẩm. Câu 1: Từ Thí nghiệm 1, một bạn học sinh đã đưa ra các phát biểu sau: (1) Sau bước 2, chưa có bọt khí thoát ra tại bề mặt của hai thanh kim loại. (2) Sau bước 3, kim điện kế quay chứng tỏ xuất hiện dòng điện. (3) Trong dây dẫn, dòng electron di chuyển từ anot sang catot. (4) Sau bước 3, bọt khí thoát ra ở cả hai điện cực kẽm và đồng. (5) Sau bước 3, thanh đồng bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện. Số phát biểu đúng là
Đáp án: C Phương pháp giải: Dựa vào lý thuyết về ăn mòn điện hóa. Lời giải chi tiết: (1) Sau bước 2, chưa có bọt khí thoát ra tại bề mặt của hai thanh kim loại. ⟹ Sai vì ngay lúc đầu Zn phản ứng với H2SO4 theo phản ứng: Zn + H2SO4 → ZnSO4 + H2 (2) Sau bước 3, kim điện kế quay chứng tỏ xuất hiện dòng điện. ⟹ Đúng do có sự dịch chuyển electron trong dây dẫn (3) Trong dây dẫn, dòng electron di chuyển từ anot sang catot. ⟹ Đúng (4) Sau bước 3, bọt khí thoát ra ở cả hai điện cực kẽm và đồng. ⟹ Đúng (5) Sau bước 3, thanh đồng bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện. ⟹ Sai, sau bước 3 thanh kẽm bị ăn mòn điện hóa Vậy có 3 phát biểu đúng. Chọn C. Câu 2: Trong Thí nghiệm 1, thanh kẽm và thanh đồng được nối với nhau bằng dây dẫn cùng nhúng trong dung dịch chất điện li tạo thành một cặp pin điện hóa. Quá trình xảy ra tại anot của pin điện này là
Đáp án: A Phương pháp giải: Trong pin điện, chất có tính khử mạnh hơn đóng vai trò anot, chất có tính khử yếu hơn đóng vai trò là catot: - Tại anot xảy ra quá trình oxi hóa. - Tại catot xảy ra quá trình khử. Lời giải chi tiết: Pin điện Zn - Cu cùng được nhúng trong dung dịch chất điện li H2SO4 thì Zn đóng vai trò anot (-) còn Cu đóng vai trò catot (+). Các bán phản ứng xảy ra tại các cực là: - Anot (-): Zn → Zn2+ + 2e - Catot (+): 2H+ + 2e → H2 Chọn A. Câu 3: Trong Thí nghiệm 2, hợp kim có sắt bị ăn mòn là
Đáp án: A Phương pháp giải: Trong ăn mòn điện hóa thì kim loại có tính khử mạnh hơn đóng vai trò cực âm (anot) và bị phá hủy trước. Lời giải chi tiết: Các hợp kim được đặt trong không khí ẩm nên đều bị ăn mòn điện hóa: + Cu-Fe (1) thì tính khử Fe > Cu nên Fe bị ăn mòn trước + Fe-C (2) thì tính khử Fe > C nên Fe bị ăn mòn trước + Fe-Zn (3) thì tính khử Fe < Zn nên Zn bị ăn mòn trước Chọn A. Câu hỏi 35 : Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương. M → Mn+ + ne Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học: + Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. + Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương. Điều kiện xảy ra sự ăn mòn điện hóa học là: + Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,… + Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. + Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
Một sinh viên thực hiện thí nghiệm sau: Thí nghiệm 1: - Rót các thể tích NaCl đậm đặc bằng nhau vào 2 cốc thủy tinh. - Cắm một lá sắt và một lá đồng vào mỗi cốc. - Nhỏ vào mỗi cốc 5 - 7 giọt dung dịch kali ferixianua K3[Fe(CN)6] (là thuốc thử nhận biết ion Fe2+ vì thuốc thử phản ứng với muối sắt(II) tạo kết tủa màu xanh là sắt(II) ferixianua Fe3[Fe(CN)6]2). - Nối lá Fe và lá Cu trong cốc (2) bằng một dây dẫn.
Thí nghiệm 2: Tiến hành thí nghiệm như hình vẽ sau (3 cốc đều chứa dung dịch NaCl đậm đặc có cùng thể tích và nồng độ mol):
Câu 1: Trong Thí nghiệm 1, hiện tượng quan sát được là
Đáp án: C Phương pháp giải: - Điều kiện xảy ra sự ăn mòn điện hóa học là: + Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,… + Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. + Các điện cực cùng tiếp xúc với một dung dịch chất điện li. - Trong pin điện, chất có tính khử mạnh hơn đóng vai trò anot, chất có tính khử yếu hơn đóng vai trò là catot: + Tại anot xảy ra quá trình oxi hóa. + Tại catot xảy ra quá trình khử. Lời giải chi tiết: *Cốc (1): Không có sự ăn mòn điện hóa do 2 thanh kim loại không tiếp xúc trực tiếp/gián tiếp qua dây dẫn. ⟹ Cốc (1) không có hiện tượng. *Cốc (2): Có sự ăn mòn điện hóa do thỏa mãn cả 3 điều kiện xảy ra hiện tượng ăn mòn điện hóa: + Có 2 điện cực Fe và Cu. + 2 điện cực tiếp xúc gián tiếp với nhau qua dây dẫn. + 2 điện cực cùng tiếp xúc với dung dịch chất điện li là NaCl. Tính khử của Fe mạnh hơn Cu nên Fe đóng vai trò anot (-) và bị ăn mòn: Fe → Fe2+ + 2e. ⟹ Cốc (2) xuất hiện kết tủa xanh. Chọn C. Câu 2: Trong Thí nghiệm 1, để hiện tượng xảy tương tự ta có thể thay thanh đồng bằng thanh kim loại nào sau đây?
Đáp án: B Phương pháp giải: Trong pin điện hóa, kim loại đóng vai trò anot (kim loại có tính khử mạnh hơn) bị ăn mòn. Lời giải chi tiết: Ta có thể thay kim loại Cu bằng kim loại Ni. Vì Fe có tính khử mạnh hơn Ni nên đóng vai trò anot (-) và bị ăn mòn điện hóa. Chọn B. Câu 3: Trong Thí nghiệm 2, đinh sắt trong cốc nào được bảo vệ?
Đáp án: D Phương pháp giải: Trong pin điện hóa, kim loại đóng vai trò anot (kim loại có tính khử mạnh hơn) bị ăn mòn. Lời giải chi tiết: So sánh về tính khử: Al > Zn > Fe > Cu. Trong pin điện hóa, kim loại đóng vai trò anot (kim loại có tính khử mạnh hơn) bị ăn mòn. ⟹ Đinh sắt được bảo vệ khi được quấn xung quanh bởi một kim loại có tính khử mạnh hơn. ⟹ Cốc 1 và cốc 3 đinh sắt được bảo vệ. Chọn D. Câu hỏi 36 : Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời trực tiếp (hoặc gián tiếp qua dây dẫn) từ cực âm (anot) đến cực dương (catot). + Anot (-) là nơi xảy ra bán phản ứng oxi hóa. + Catot (+) là nơi xảy ra bán phản ứng khử. Điều kiện xảy ra sự ăn mòn điện hóa học là: + Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,… + Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. + Các điện cực cùng tiếp xúc với một dung dịch chất điện li. Trong không khí ẩm, trên bề mặt của gang, thép luôn có một lớp nước rất mỏng đã hòa tan O2 và khí CO2 trong khí quyển, tạo thành một dung dịch chất điện li. Gang, thép có thành phần chính là sắt và cacbon tiếp xúc trực tiếp và cùng tiếp xúc với dung dịch điện li đó tạo nên vô số pin rất nhỏ mà sắt là anot và cacbon là catot.
Câu 1: Bán phản ứng xảy ra tại anot của mỗi pin điện là
Đáp án: D Phương pháp giải: Anot (-) là nơi xảy ra bán phản ứng oxi hóa. Lời giải chi tiết: Bán phản ứng xảy ra tại anot (-) là: Fe → Fe2+ + 2e. Chọn D. Câu 2: Bán phản ứng xảy ra tại catot của mỗi pin điện là
Đáp án: A Phương pháp giải: Catot (+) là nơi xảy ra bán phản ứng khử. Lời giải chi tiết: Bán phản ứng xảy ra tại catot (+) là: 2H2O + O2 + 4e → 4OH-. Chọn A. Câu 3: Một sinh viên đưa ra các nhận xét sau: (1) Nếu để gang, thép trong không khí khô thì không xảy ra hiện tượng ăn mòn điện hóa. (2) Thanh sắt nguyên chất để trong không khí ẩm bị ăn mòn điện hóa tương tự như gang, thép. (3) Nếu để gang, thép trong bình khí O2 cũng xảy ra hiện tượng ăn mòn điện hóa tương tự như trong không khí ẩm. (4) Các electron chuyển dời từ cực âm đến cực dương của pin điện thông qua lớp dung dịch chất điện li. Số phát biểu đúng là
Đáp án: C Phương pháp giải: - Dựa vào điều kiện xảy ra ăn mòn điện hóa học: Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,… Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. Các điện cực cùng tiếp xúc với một dung dịch chất điện li. - Trong ăn mòn điện hóa, electron chuyển dời trực tiếp (hoặc gián tiếp qua dây dẫn) từ cực âm (anot) đến cực dương (catot). Lời giải chi tiết: (1) Nếu để gang, thép trong không khí khô thì không xảy ra hiện tượng ăn mòn điện hóa. ⟹ Đúng, vì không khí khô không phải dung dịch chất điện li nên không xảy ra ăn mòn điện hóa. (2) Thanh sắt nguyên chất để trong không khí ẩm bị ăn mòn điện hóa tương tự như gang, thép. ⟹ Sai, vì không có 2 điện cực khác nhau về bản chất nên không xảy ra ăn mòn điện hóa. (3) Nếu để gang, thép trong bình khí O2 cũng xảy ra hiện tượng ăn mòn điện hóa tương tự như trong không khí ẩm. ⟹ Sai, vì O2 không phải dung dịch chất điện li nên không xảy ra ăn mòn điện hóa. (4) Các electron chuyển dời từ cực âm đến cực dương của pin điện thông qua dung dịch chất điện li. ⟹ Sai, vì Fe và C tiếp xúc trực tiếp với nhau electron chuyển dời trực tiếp từ Fe sang C. Vậy có 1 phát biểu đúng. Chọn C. Câu hỏi 37 : Tiến hành các thí nghiệm sau: (1) Ngâm lá đồng trong dung dịch AgNO3 (2) Ngâm lá kẽm trong dung dịch HCl loãng (3) Ngâm lá nhôm trong dung dịch NaOH (4) Ngâm lá sắt được cuốn dây đồng trong dung dịch HCl (5) Để một vật bằng gang ngoài không khí ẩm (6) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3 Số thí nghiệm xảy ra ăn mòn điện hóa là
Đáp án: D Phương pháp giải: 3 điều kiện xuất hiện ăn mòn điện hóa: 1. Có 2 điện cực khác nhau về bản chất 2. Các điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau 3. Các điện cực cùng được nhúng trong dung dịch chất điện li Lời giải chi tiết: (1) tạo pin điện Cu-Ag nhúng trong dd điện li (AgNO3) => ăn mòn điện hóa (2) chỉ có ăn mòn hóa học (3) chỉ có ăn mòn hóa học (4) cặp pin điện Fe-Cu nhúng trong dd điện li (HCl) => ăn mòn điện hóa (5) tạo pin điện Fe-C cùng nhúng trong dd điện li (không khí ẩm) => ăn mòn điện hóa (6) chỉ có ăn mòn hóa học Vậy có 3 thí nghiệm xảy ra ăn mòn điện hóa Đáp án D Câu hỏi 38 : Có những pin điện hoá được ghép bởi các cặp oxi hoá - khử chuẩn sau: a) Ni2+/ Ni và Zn2+/ Zn b) Cu2+/ Cu và Hg2+/ Hg c) Mg2+/ Mg và Pb2+/ Pb. Điện cực dương của các pin điện hoá là:
Đáp án: B Phương pháp giải: Quá trình xảy ra trong pin điện hóa Ở cực dương: xảy ra phản ứng khử Cặp kim loại A – Kim loại B (trong đó kim loại có thế điện cực chuẩn nhỏ hơn sẽ là cực âm.) Lời giải chi tiết: a) Ni2+/ Ni và Zn2+/ Zn => Zn + Ni2+ →Zn2+ + Ni Zn cực âm, Ni cực dương b) Cu2+/ Cu và Hg2+/ Hg => Cu + Hg2+ →Cu2+ + Hg Cu cực âm, Hg cực dương c) Mg2+/ Mg và Pb2+/ Pb => Mg + Pb2+ → Mg2+ + Pb Mg cực âm, Pb cực dương => Điện cực dương của các pin điện hoá là Ni, Hg, Pb Đáp án B Câu hỏi 39 : Tiến hành các thí nghiệm sau: (a) Cho lá Al vào dung dịch gồm CuSO4 và H2SO4 loãng (b) Đốt dây Zn trong bình đựng khí O2 (c) Cho lá Fe vào dung dịch gồm HCl và vài giọt CuCl2 (d) Cho lá Fe vào dung dịch HCl. Số thí nghiệm có xảy ra ăn mòn điện hóa là
Đáp án: C Phương pháp giải: Điều kiện ăn mòn điện hóa * Có 2 điện cực khác nhau về bản chất - Cặp kim loại A – Kim loại B (trong đó kim loại có thế điện cực chuẩn nhỏ hơn sẽ là cực âm.) - Cặp kim loại – Cacbon *2 điện cực tiếp xúc (trực tiếp hoặc gián tiếp qua dây dẫn) *2 điện cực nhúng vào cùng 1 dd chất điện li Lời giải chi tiết: a) 2Al + 2CuSO4 →Al2(SO4)3 + 3Cu Có xảy ra quá trình ăn mòn điện hóa (cặp điện cực Al - Cu) (b) 2Zn + O2 →2ZnO => không phải ăn mòn điện hóa (c) Fe + CuCl2 → Cu + FeCl2 Có xảy ra quá trình ăn mòn điện hóa (cặp điện cực Fe - Cu) (d) Fe + 2HCl →FeCl2 + H2 => không phải ăn mòn điện hóa Đáp án C Câu hỏi 40 : Cho các phát biểu: (a) Điện phân dung dịch NaCl với điện cực trơ, thu được khí H2 ở catot. (b) Dùng khí CO (dư) khử CuO nung nóng, thu được kim loại Cu. (c) Để hợp kim Fe-Ni ngoài không khí ẩm thì kim loại Ni bị ăn mòn điện hóa học. (d) Dùng dung dịch Fe2(SO4)3 dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu. (e) Cho Fe dư vào dung dịch AgNO3, sau phản ứng thu được dung dịch chứa hai muối. Số phát biểu đúng là
Đáp án: A Phương pháp giải: Lời giải chi tiết: (a) đúng vì ở catot Na+ không bị điện phân, H2O điện phân hộ: H2O + 1e → 0,5H2 + OH- (b) đúng, PTHH: CO + CuO \(\xrightarrow{{{t^o}}}\) Cu + CO2 (c) sai vì trong pin điện thì cực âm (kim loại có tính khử mạnh hơn) bị ăn mòn trước, vậy Fe bị ăn mòn điện hóa. (d) đúng, ta cho hỗn hợp kim loại tác dụng với Fe2(SO4)3 dư: Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Ag không phản ứng với Fe2(SO4)3 nên sau phản ứng thu được Ag (e) sai vì: Fe dư + 2AgNO3 → Fe(NO3)2 + 2Ag => chỉ thu được 1 muối Fe(NO3)2 Vậy có tất cả 3 phát biểu đúng Đáp án A Câu hỏi 41 : Tiến hành các thí nghiệm sau: (a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng; (b) Đốt dây Fe trong bình đựng khí O2; (c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3; (d) Cho lá Zn vào dung dịch HCl; Số thí nghiệm có xảy ra ăn mòn điện hóa là
Đáp án: C Phương pháp giải: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li Lời giải chi tiết: Điều kiện ăn mòn điện hóa : +) 2 điện cực khác nhau về bản chất (KL-KL ; KL-PK, …) +) 2 điện cực nối trực tiếp hoặc gián tiếp với nhau bằng dây dẫn +) 2 điện cực cùng nhúng vào trong dung dịch chất điện li (a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng; ăn mòn điện hóa (b) Đốt dây Fe trong bình đựng khí O2; ănmòn hóa học (c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3; ănmòn hóa học (d) Cho lá Zn vào dung dịch HCl; ănmòn hóa học Đáp án C Câu hỏi 42 : Để bảo vệ thép khỏi bị ăn mòn, người ta tiến hành các cách sau: (a) Tráng một lớp Zn mỏng phủ kín bề mặt tấm thép; (b) Tráng một lớp Sn mỏng phủ kín bề mặt tấm thép; (c) Gắn một số miếng Zn lên bề mặt tấm thép; (d) Đổ bê tông kín hết bề mặt tấm thép; (e) Phủ kín một lớp sơn lên bề mặt tấm thép. Số cách làm áp dụng theo phương pháp “cách ly” là
Đáp án: D Phương pháp giải: + Phương pháp cách ly là phương pháp dùng những chất bền vững đối với môi trường để phủ ngoài mặt những đồ vật bằng kim loại như dầu mỡ, sơn, mạ, tráng men,… Lời giải chi tiết: (a), (b), (d), (e) thỏa mãn, vì đây là phương pháp “cách ly”, phủ lên bề mặt chất cần bảo vệ (c) loại vì đây là phương pháp điện hóa, nối tấm thép với Zn để tạo thành pin điện hóa và Zn sẽ bị ăn mòn trước, thép được bảo vệ. → có 4 cách Đáp án D Câu hỏi 43 : Tiến hành các thí nghiệm sau: (a) Đế miếng gang trong không khí ẩm. (b) Nhúng hai thanh kim loại Al và Cu (được nối với nhau bằng một dây dẫn) vào cốc đựng dung dịch H2SO4 loãng. (c) Nhúng dây Zn vào dung dịch chứa HCl có cho thêm ít giọt dung dịch CuSO4. (d) Cho Mg vào lượng dư dung dịch Fe2(SO4)3. (e) Cho lượng dư Mg vào dung dịch FeCl3. Trong các thí nghiệm trên, số thí nghiệm có xảy ra cả hai hiện tượng ăn mòn kim loại là
Đáp án: D Phương pháp giải: Hai hiện tượng ăn mòn kim loại gồm: ăn mòn hóa học và ăn mòn điện hóa Lời giải chi tiết: Hai hiện tượng ăn mòn kim loại gồm: ăn mòn hóa học và ăn mòn điện hóa (a) thỏa mãn, vì: + Ăn mòn hóa học: miếng gang bị các chất trong không khí oxi hóa trực tiếp + Ăn mòn điện hóa: cặp điện cực Fe-C tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dd điện li (không khí ẩm) (b) thỏa mãn, vì: + Ăn mòn hóa học: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 + Ăn mòn điện hóa: cặp điện cực Al-Cu tiếp xúc gián tiếp với nhau qua dây dẫn và cùng tiếp xúc với dd điện li (c) thỏa mãn, vì: + Ăn mòn hóa học: Zn + 2HCl → ZnCl2 + H2; Zn + CuSO4 → ZnSO4 + Cu + Ăn mòn điện hóa: cặp điện cực Zn-Cu tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dd điện li (d) không thỏa mãn, chỉ có hiện tượng ăn mòn hóa học: Mg + Fe2(SO4)3 dư → MgSO4 + 2FeSO4 (e) thỏa mãn, vì: + Ăn mòn hóa học: Mgdư + 2FeCl3 → MgCl2 + 2FeCl2; Mg + FeCl2 → MgCl2 + Fe + Ăn mòn điện hóa: cặp điện cực Mg-Fe tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dd điện li → 4 thí nghiệm thỏa mãn Đáp án D Câu hỏi 44 : Tiến hành các thí nghiệm sau: (a) Nhúng thanh Cu vào dung dịch FeCl3. (b) Nhúng thanh Al vào dung dịch NaOH. (c) Nhúng dây Mg vào dung dịch chứa CuCl2 và HCl. (d) Nhúng thanh Zn vào dung dịch AgNO3. (e) Nhúng thanh Fe vào dung dịch HNO3 loãng. Trong các thí nghiệm trên, số thí nghiệm có xảy ra ăn mòn điện hóa học là
Đáp án: C Phương pháp giải: (*) Điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li Lời giải chi tiết: (a) Cu + 2Fe3+ → 2Fe2+ + Cu2+ Cu không đẩy được Fe2+ ra khỏi muối nên không tạo thành cặp điện cực → không xảy ra ăn mòn điện hóa (b) không có cặp điện cực nào → không xảy ra ăn mòn điện hóa (c) Mg + CuCl2 → MgCl2 + Cu Cu bám trực tiếp lên dây Mg tạo thành cặp điện cực Mg-Cu, cùng được nhúng trong dung dịch chất điện li → có xảy ra ăn mòn điện hóa (d) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag Ag bám trực tiếp lên thanh Zn tạo thành cặp điện cực Zn-Ag, cùng được nhúng trong dung dịch chất điện li → có xảy ra ăn mòn điện hóa (e) không có cặp điện cực nào → không xảy ra ăn mòn điện hóa Vậy có 2 thí nghiệm xảy ra ăn mòn điện hóa là (c) và (d). Đáp án C Câu hỏi 45 : Cho các thí nghiệm sau: (1) Nhúng một thanh Fe vào dung dịch Fe(NO3)3. (2) Nhúng một thanh Cu vào dung dịch Fe(NO3)3. (3) Nhúng một thanh Mg vào dung dịch Cu(NO3)2. (4) Nhúng một thanh Ag vào dung dịch Cu(NO3)2. Số thí nghiệm xảy ra ăn mòn điện hóa là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 46 : Thực hiện các thí nghiệm sau: (1) Cho lá kim loại Fe vào dung dịch CuSO4. (2) Cho lá kim loại Al vào dung dịch HNO3 loãng, nguội. (3) Đốt cháy dây Mg trong khí Cl2. (4) Cho lá kim loại Fe vào dung dịch CuSO4 và H2SO4 loãng. (5) Cho thanh Cu nhúng vào dung dịch AgNO3. (6) Cho thanh Cu nhúng vào dung dịch Fe(NO3)3. Số thí nghiệm có xảy ra ăn mòn điện hóa học là
Đáp án: C Phương pháp giải: (*) Điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li Lời giải chi tiết: (1) Fe + CuSO4 → FeSO4 + Cu Kim loại Cu bám trực tiếp vào lá Fe tạo thành cặp điện cực Fe-Cu, cùng nhúng trong dd điện li → có xảy ra ăn mòn điện hóa (2) Không có cặp điện cực → không xảy ra ăn mòn điện hóa (3) Không có cặp điện cực → không xảy ra ăn mòn điện hóa (4) Fe + CuSO4 → FeSO4 + Cu Kim loại Cu bám trực tiếp vào lá Fe tạo thành cặp điện cực Fe-Cu, cùng nhúng trong dd điện li → có xảy ra ăn mòn điện hóa (5) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag Kim loại Ag bám trực tiếp vào thanh Cu tạo thành cặp điện cực Cu-Ag, cùng nhúng trong dd điện li → có xảy ra ăn mòn điện hóa (6) Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 Không có cặp điện cực → không xảy ra ăn mòn điện hóa Vậy có 3 thí nghiệm xảy ra ăn mòn điện hóa: (1) (4) (5) Đáp án C Câu hỏi 47 : Tiến hành bốn thí nghiệm sau: - Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3; - Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4; - Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3; - Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl. Số trường hợp xuất hiện ăn mòn điện hoá là
Đáp án: A Phương pháp giải: Dựa vào điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) Lời giải chi tiết: Thí nghiệm 1: Fe + 2FeCl3 → 3FeCl2 Ở đây chỉ có 1 điện cực là Fe nên không xảy ra ăn mòn điện hóa. Thí nghiệm 2: Fe + CuSO4 → FeSO4 + Cu Có 2 điện cực Fe và Cu tiếp xúc trực tiếp với nhau, nhúng trong cùng dung dịch chất điện li (muối sunfat). → Xảy ra ăn mòn điện hóa. Thí nghiệm 3: Cu + 2FeCl3 → CuCl2 + 2FeCl2 Ở đây chỉ có 1 điện cực là Cu nên không xảy ra ăn mòn điện hóa. Thí nghiệm 4: Có 2 điện cực Cu và Fe tiếp xúc trực tiếp với nhau, nhúng vào cốc đựng dung dịch HCl. → Xảy ra ăn mòn điện hóa. Vậy có 2 thí nghiệm xuất hiện ăn mòn điện hóa. Đáp án A Câu hỏi 48 : Tiến hành các thí nghiệm sau: (1) Ngâm lá đồng trong dung dịch AgNO3. (2) Ngâm lá kẽm trong dung dịch HCl loãng. (3) Ngâm lá nhôm trong dung dịch NaOH. (4) Ngâm lá sắt được cuốn dây đồng trong dung dịch HCl. (5) Để một vật bằng gang ngoài không khí ẩm. (6) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3. Số thí nghiệm xảy ra ăn mòn điện hóa là
Đáp án: A Phương pháp giải: Dựa vào điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) Lời giải chi tiết: (1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag Có 2 điện cực là Ag và Cu tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (dung dịch muối nitrat) → xảy ra ăn mòn điện hóa. (2) Zn + 2HCl → ZnCl2 + H2 Ở thí nghiệm này chỉ có 1 điện cực Zn → không xảy ra ăn mòn điện hóa. (3) Al + NaOH + H2O → NaAlO2 + 3/2 H2 Ở thí nghiệm này chỉ có 1 điện cực Al → không xảy ra ăn mòn điện hóa. (4) Ở thí nghiệm này có 2 điện cực Fe và Cu tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (dung dịch HCl) → xảy ra ăn mòn điện hóa. (5) Ở thí nghiệm này có 2 điện cực Fe và cacbon tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (không khí ẩm) → xảy ra ăn mòn điện hóa. (6) Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Ở thí nghiệm này chỉ có 1 điện cực Cu → không xảy ra ăn mòn điện hóa. Các thí nghiệm xảy ra ăn mòn điện hóa là (1), (4), (5) (có 3 thí nghiệm thỏa mãn). Đáp án A Câu hỏi 49 : Thực hiện các thí nghiệm sau: (1) Thả một viên Fe vào dung dịch HCl. (2) Thả một viên Fe vào dung dịch Cu(NO3)2. (3) Thả một viên Fe vào dung dịch FeCl3. (4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm. (5) Đốt một dây Fe trong bình kín chứa đầy khí O2. (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng. Các thí nghiệm mà Fe không bị ăn mòn điện hóa học là
Đáp án: A Phương pháp giải: Dựa vào điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) Lời giải chi tiết: (1) Fe + 2HCl → FeCl2 + H2 Ở thí nghiệm này chỉ có 1 điện cực Fe nên không xảy ra ăn mòn điện hóa học. (2) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu Ở thí nghiệm này có 2 điện cực là Cu và Fe tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (dd muối). Do đó ở thí nghiệm 2, Fe bị ăn mòn điện hóa học. (3) Fe + 2FeCl3 → 3FeCl2 Ở thí nghiệm này chỉ có 1 điện cực Fe nên không xảy ra ăn mòn điện hóa học. (4) Ở thí nghiệm này có 2 điện cực là Ni và Fe tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (không khí ẩm). Do đó ở thí nghiệm 2, Fe bị ăn mòn điện hóa học. (5) 3Fe + 2O2 → Fe3O4 Ở thí nghiệm này chỉ có 1 điện cực Fe nên không xảy ra ăn mòn điện hóa học. (6) Fe + CuSO4 → FeSO4 + Cu Ở thí nghiệm này có 2 điện cực là Cu và Fe tiếp xúc trực tiếp với nhau và cùng tiếp xúc với môi trường chất điện li (dd muối, axit). Do đó ở thí nghiệm 6, Fe bị ăn mòn điện hóa học. Các thí nghiệm mà Fe không bị ăn mòn điện hóa học là (1), (3), (5). Đáp án A Câu hỏi 50 : Tiến hành các thí nghiệm sau: (a) Nhúng thanh đồng nguyên chất vào dung dịch Fe(NO3)3. (b) Tấm tôn (sắt tráng kẽm) bị trầy xước đến lớp sắt, để trong không khí ẩm. (c) Nhúng thanh sắt vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4. (d) Quấn sợi dây đồng vào thanh kẽm rồi nhúng vào cốc đựng dung dịch NaCl. Số thí nghiệm xảy ra ăn mòn điện hóa học là
Đáp án: D Phương pháp giải: Xét các điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau về bản chất (KL-KL, KL-PK,…) - Hai điện cực phải cùng tiếp xúc với môi trường chất điện li - Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn) Lời giải chi tiết: (1) Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 Ở đây chỉ có 1 điện cực là Cu nên không xảy ra ăn mòn điện hóa. (b) Có 2 điện cực là sắt và kẽm, tiếp xúc trực tiếp với nhau, đặt trong cùng 1 chất điện li nên xảy ra ăn mòn điện hóa. (c) Fe + CuSO4 → FeSO4 + Cu Có 2 điện cực Fe và Cu tiếp xúc trực tiếp với nhau, nhúng trong cùng dung dịch chất điện li (muối sunfat) nên xảy ra ăn mòn điện hóa. (d) Có 2 điện cực Cu và Zn tiếp xúc trực tiếp với nhau, nhúng vào cốc đựng dung dịch NaCl nên xảy ra ăn mòn điện hóa. Vậy có 3 thí nghiệm xảy ra ăn mòn điện hóa là (b), (c) và (d). Đáp án D
|