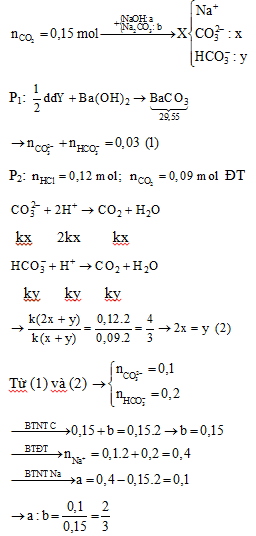50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giảiLàm bàiCâu hỏi 1 : Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5g chất rắn khan gồm 4 muối. giá trị của V là
Đáp án: D Phương pháp giải: Bài toán CO2 + dung dịch kiềm; bảo toàn điện tích, bảo toàn nguyên tố Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư =>nCO3 = nCO2 +) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- =>nCO3 = nOH – nCO2 +) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-. =>nHCO3 = nOH Lời giải chi tiết: Vì phản ứng tạo 4 muối => có tạo x mol CO32- và y mol HCO3- => mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 = 23.2,75v + 2.39v + 60x + 61y Bảo toàn điện tích : nNa+ + nK+ = nHCO3- + nCO3(2-).2 => 2,75v + 2v = 2x + y Bảo toàn C : nCO2 + nK2CO3 = x + y = 0,4 + v Giải hệ phương trình 3 ẩn ta có : v = 0,2 lit = 200 ml Đáp án D Câu hỏi 2 : Dẫn từ từ 5,6 lít CO2 (đktc) vào 400ml dung dịch chứa đồng thời các chất NaOH 0,3M; KOH 0,2M; Na2CO3 0,1875M; K2CO3 0,125M thu được dung dịch X. Thêm dung dịch CaCl2 dư vào dung dịch X, số gam kết tủa thu được là:
Đáp án: A Phương pháp giải: Bài toán CO2 + dung dịch kiềm Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư =>nCO3 = nCO2 +) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- =>nCO3 = nOH – nCO2 +) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-. =>nHCO3 = nOH Lời giải chi tiết: nCO2 = 0,25 mol nCO3 = 0,125 mol ; nOH = 0,2 mol Thứ tự phản ứng: (1) CO2 + 2OH - → CO3 2- + H2O 0,1 ← 0,2 → 0,1 (mol) Sau phản ứng (1): CO2: 0,15 mol CO32-: 0,1 + 0,125 = 0,225 mol (2) CO2 + CO32- + H2O → 2HCO3- 0,15→0,15 nCO32- dư = 0,225 – 0,15 = 0,075 mol = nCaCO3 => mCaCO3 = 0,075.100 = 7,5 gam Đáp án A Câu hỏi 3 : Hấp thụ hoàn toàn V lit CO2 (đktc) vào bình đựng 200 ml dung dịch NaOH 1M và Na2CO3 0,5M. Cô cạn dung dịch sau phản ứng (bằng cách đun nóng) đến khối lượng không đổi thu được 19,9g chất rắn khan. Giá trị của V là
Đáp án: B Phương pháp giải: Bài toán CO2 + dung dịch kiềm Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư =>nCO3 = nCO2 +) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- =>nCO3 = nOH – nCO2 +) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-. =>nHCO3 = nOH Lời giải chi tiết: nNaOH = 0,2 mol ; nNa2CO3 = 0,1 mol Xét trường hợp 2 muối NaHCO3 và Na2CO3 thì sau khi cô cạn chỉ thu được Na2CO3 (vì NaHCO3 không bền phân huỷ hết thành Na2CO3). Khi đó nNa2CO3 = 0,2 mol => Chất rắn khan có chứa cả NaOH Đặt nNaOH pư = x mol => Chất rắn gồm (0,2 – x) mol NaOH và (0,1 + 0,5x) mol Na2CO3 => mrắn = 40.(0,2 – x) + 106.(0,1 + 0,5x) = 19,9g => x = 0,1 mol => nCO2 = ½ nNaOH pứ = 0,05 mol => V = 1,12 lit Đáp án B Câu hỏi 4 : Hấp thụ hết 0,3 mol khí CO2 vào 500 ml dung dịch chứa Na2CO3 0,2M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, số mol Na2CO3 thu được là
Đáp án: A Phương pháp giải: Cách 1: Viết PTHH Thứ tự các phản ứng xảy ra là: CO2 + 2NaOH → Na2CO3 + H2O (1) CO2 + Na2CO3 + H2O → 2NaHCO3 (2) Cách 2: Dùng tỉ lệ nNa : nC Bảo toàn Na → nNa = 2nNa2CO3 bđ + nNaOH Ta thấy nNanC=2,33>2 ⟹ tạo muối Na2CO3 và NaOH còn dư Bảo toàn C → nNa2CO3 thu được = nCO2 Lời giải chi tiết: nNa2CO3 bđ = 0,1 mol; nNaOH = 0,5 mol Cách 1: Viết PTHH CO2 + 2NaOH → Na2CO3 + H2O (1) 0,25/0,05 ← 0,5 → 0,25 CO2 + Na2CO3 + H2O → 2NaHCO3 (2) 0,05 → 0,05 ⟹ nNa2CO3 thu được = nNa2CO3 bđ + nNa2CO3 (1) - nNa2CO3 (2) = 0,1 + 0,25 - 0,05 = 0,3 mol Cách 2: Dùng tỉ lệ nNa : nC Bảo toàn Na → nNa = 2nNa2CO3 bđ + nNaOH = 0,7 mol Ta thấy nNanC=0,70,3=2,33>2 ⟹ tạo muối Na2CO3 và NaOH còn dư Bảo toàn C → nNa2CO3 thu được = nCO2 = 0,3 mol Đáp án A Câu hỏi 5 : Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 200 ml dung dịch hỗn hợp NaOH 2M và KOH xM. Sau phản ứng làm bay hơi dung dịch được 26,8 gam chất rắn khan. Giá trị của x là
Đáp án: D Phương pháp giải: Tính số mol CO2 và OH‑ Lập tỉ lệ thấy nOH-/nCO2 > 2 Vậy dd sau chứa: Na+: 0,4 (bảo toàn Na); K+: 0,2x (bảo toàn K); CO32-: 0,2 (bảo toàn C); OH- (y) +) Bảo toàn điện tích → (1) +) Từ khối lượng chất rắn khan → (2) Lời giải chi tiết: nCO2 = 0,2 (mol) nOH- = nNaOH + nKOH = 0,4 + 0,2x (mol) →(∗)=nOH−nCO2=0,4+0,2x0,2=2+x→(∗)>2 Vậy dd sau chứa: Na+: 0,4 (bảo toàn Na); K+: 0,2x (bảo toàn K); CO32-: 0,2 (bảo toàn C); OH- (y) +) BTĐT → 0,4 + 0,2x = 0,2.2 + y (1) +) mchất rắn = 23.0,4 + 39.0,2x + 60.0,2 + 17y = 26,8 (2) Giải hệ được x = 0,5 và y = 0,1 Đáp án D Câu hỏi 6 : Nhỏ từ từ từng giọt đến hết 50 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,3M và NaHCO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, số mol CO2 thu được là
Đáp án: B Phương pháp giải: Cho từ từ dd HCl vào dd hỗn hợp Na2CO3 và NaHCO3 xảy ra phản ứng theo thứ tự sau: PTHH: HCl + Na2CO3 → NaHCO3 + NaCl (1) HCl + NaHCO3 → NaCl + CO2 + H2O (2) Đổi số mol mối chất, PTHH (1) tính theo Na2CO3; PTHH (2) tính theo số mol HCl Lời giải chi tiết: 100 ml = 0,1 (lít) ; 50 ml = 0,05 (lít) nHCl = VHCl×CM HCl = 0,05×1 = 0,05 (mol) nNa2CO3 = V.CM Na2CO3 = 0,1×0,3 = 0,03 (mol) nNaHCO3 = V. CM NaHCO3 = 0,1×0,2 = 0,02 (mol) Cho từ từ dd HCl vào dd hỗn hợp Na2CO3 và NaHCO3 xảy ra phản ứng theo thứ tự sau: PTHH: HCl + Na2CO3 → NaHCO3 + NaCl (1) (mol) 0,03Dư 0,02 ← 0,03 → 0,03 Kết thúc pư (1): nHCl dư = nHCl bđ – nHCl(1) = 0,05 – 0,03 = 0,02 (mol) Tổng mol NaHCO3 = nNaHCO3 bđ + nNaHCO3 (1) = 0,02 + 0,03 = 0,05 (mol) HCl + NaHCO3 → NaCl + CO2 + H2O (2) bđ (mol) 0,02 0,05 pư (mol) 0,02 → 0,02 → 0,02 sau (mol) 0 0,03 0,02 Theo (2): nCO2 thu được = nHCl (2) = 0,02 (mol) Đáp án B Câu hỏi 7 : Cho m gam hỗn hợp gồm Na2CO3 và NaHCO3 vào nước thu được dung dịch X. Cho từ từ 250 ml dung dịch HCl 1M vào dung dịch X thu được dung dịch Y và 2,24 lít khí CO2(đktc). Dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 49,25 gam kết tủa. Giá trị của m là
Đáp án: A Phương pháp giải: Cho từ từ HCl vào hỗn hợp 2 muối xảy ra phản ứng theo thứ tự: HCl + Na2CO3 → NaHCO3 (1) HCl + NaHCO3 → NaCl + CO2↑ + H2O (2) Từ số mol CO2 và HCl tìm được nNa2CO3 bđ dd Y chứa NaHCO3. Từ số mol kết tủa BaCO3 tính được số mol NaHCO3 bđ Lời giải chi tiết: Đặt trong m gam hỗn hợp: {Na2CO3:x(mol)NaHCO3:y(mol) nHCl = VHCl×CM = 0,25×1 = 0,25 (mol); nCO2(đktc) = 2,24/22,4 = 0,1 (mol) Cho từ từ HCl vào hỗn hợp 2 muối xảy ra phản ứng theo thứ tự: HCl + Na2CO3 → NaHCO3 (1) 0,15 → 0,15 → 0,15 HCl + NaHCO3 → NaCl + CO2↑ + H2O (2) 0,1 ← 0,1 ← 0,1 Theo PTHH (2): nHCl(2) = nCO2 = 0,1 (mol) → nHCl(1) = nHCl bđ – nHCl (2) = 0,25 – 0,1 = 0,15 (mol) Theo PTHH (1): nNa2CO3 = nHCl(1) = 0,15 (mol) = x ; nNaHCO3(1) = nHCl = 0,15 (mol) dd Y thu được: NaHCO3 = nNaHCO3 bđ + nNaHCO3(1) - nNaHCO3(2) = y + 0,05 (mol) PTHH: NaHCO3 + Ba(OH)2 → BaCO3↓ + NaOH + H2O (3) (mol) y + 0,05 → y + 0,05 mBaCO3 = 49,25 (g) → nBaCO3 = 49,25/197 = 0,25 (mol) Theo PTHH (3): nBaCO3 = nNaHCO3 = y + 0,05 (mol) → y + 0,05 = 0,25 → y = 0,2 Vậy m gam hỗn hợp: {Na2CO3:0,15(mol)NaHCO3:0,2(mol)⇒m=0,15.106+0,2.84=32,7(g) Đáp án A Câu hỏi 8 : Nung nóng 7,26 g hỗn hợp gồm NaHCO3 và Na2CO3 đến khối lượng không đổi, người ta thu được 0,84 lít khí CO2 (đktc). Phát biểu nào sau đây không chính xác?
Đáp án: D Phương pháp giải: - Nung hỗn hợp thì chỉ có NaHCO3 bị phân hủy: 2NaHCO3t0→Na2CO3+CO2+H2O - Tính toán theo PTHH Lời giải chi tiết: Nung hỗn hợp, chỉ có NaHCO3 bị phân hủy: 2NaHCO3t0→Na2CO3+CO2+H2O Theo phương trình, nNaHCO3=2nCO2=2.0,8422,4=0,075mol Trước khi nung: mNaHCO3=84.0,075=6,3(g) →mNa2CO3=7,26−6,3=0,96(g) Sau khi nung: mNa2CO3=0,96+106.0,0375=4,935gam Đáp án D Câu hỏi 9 : Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được khí X và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện m gam kết tủa. Biểu thức liên hệ giữa m với a và b là
Đáp án: A Phương pháp giải: - Tính số mol HCO3- - Tính số mol kết tủa Lời giải chi tiết: Khi cho từ từ HCl vào dd Na2CO3 ban đầu xảy ra phản ứng: H+ + CO32- → HCO3- (1) Do thu được khí nên ở (1) thì H+ dư, CO32- hết, ta có thêm phản ứng: H+ + HCO3- → CO2 + H2O (2) Vì dung dịch Y tác dụng với nước vôi trong có kết tủa nên có chứa HCO3-, suy ra ở (2) H+ hết, HCO3- dư. Cho Y tác dụng với nước vôi trong dư thì: Ca2+ + OH- + HCO3- → CaCO3 + H2O (3) Đặt mol vào các PTHH: H+ + CO32- → HCO3- (1) Bđ: a b Pư: b ← b → b Sau: a-b 0 b H+ + HCO3- → CO2 + H2O (2) Bđ: a-b b Pư: a-b → a-b Sau: 0 2b-a Ca2+ + OH- + HCO3- → CaCO3 + H2O (3) 2b-a → 2b-a → mkết tủa = mCaCO3 = 100(2b-a) (g) Đáp án A Câu hỏi 10 : Hòa tan hoàn toàn m gam hỗn hợp gồm Na, Na2O, NaOH và Na2CO3 trong dung dịch axit H2SO4 40% (vừa đủ) thu được 8,96 lít (đktc) hỗn hợp khí có tỉ khối với H2 bằng 16,75 và dung dịch Y có nồng độ 51,449%. Cô cạn Y thu dược 170,4 gam muối. Giá trị của m là
Đáp án: B Phương pháp giải: m khí = M khí.n khí = ? gam BTNT “S” => nH2SO4 = nNa2SO4 = ? mol => m dd H2SO4 ? gam CMNa2SO4=mNa2SO4m+mddH2SO4−mkhi.100%→m=? Lời giải chi tiết: m khí = M khí.n khí = 16,75.2.0,4 = 13,4 gam nNa2SO4 = 170,4/142 = 1,2 mol BTNT “S” => nH2SO4 = nNa2SO4 = 1,2 mol => m dd H2SO4 = 1,2.98.(100/40) = 294 gam CMNa2SO4=mNa2SO4m+mddH2SO4−mkhi.100% →51,449%=170,4m+294−13,4.100% Giải phương trình được m = 50,6 gam Đáp án B Câu hỏi 11 : Hấp thụ hoàn toàn 7,84 lít khí CO2 bằng 500 ml dung dịch hỗn hợp Na2CO3 0,5M và KOH aM thu được dung dịch X. Nhỏ từ từ đến hết 200 ml dung dịch HCl 1M vào dung dịch X thì thấy có 2,24 lít khí thoát ra. Giá trị của a là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 12 : Hấp thụ khí CO2 vào dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch T. Khối lượng chất tan có trong T là 1,48m gam. Chất tan có trong T là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 13 : Dung dịch X gồm K2CO3 1M và Na2CO3 1M. Dung dịch Y gồm H2SO4 2M và HNO3 1M. Nhỏ từ từ 100ml dung dịch Y vào 200ml dung dịch X, thu được V lít khí CO2 (đktc) và dung dịch Z. Cho dung dịch Ba(OH)2 tới dư vào z, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và V lần lượt là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Câu hỏi 14 : Cho 14,2 gam P2O5 vào V ml dung dịch hỗn hợp gồm NaOH 1M và KOH 2M. Phản ứng xong cô cạn dung dịch được 29,4 gam chất rắn. Giá trị của V là
Đáp án: D Phương pháp giải: Đặt CTTB là MOH với M= (23.1 + 39.2) : 3 = 33,67 (g/mol) nP2O5 = 0,1 mol : P2O5 → 2H3PO4 → nH3PO4 = 0,2 mol +) Nếu phản ứng tạo muối M3PO4 : 0,2 mol → mmuối +) Nếu phản ứng tạo muối M2HPO4 : 0,2 mol → mmuối +) Nếu phản ứng tạo muối MH2PO4 : 0,2 mol → mmuối → So sánh khối lượng của muối thực tế nằm giữa khoảng hai muối nào → Tạo ra hai muối đấy Lời giải chi tiết: Đặt CTTB là MOH với M= (23.1 + 39.2) : 3 = 33,67 (g/mol) nP2O5 = 0,1 mol : P2O5 → 2H3PO4 → nH3PO4 = 0,2 mol +) Nếu phản ứng tạo muối M3PO4 : 0,2 mol → mmuối = 0,2 . 196 = 39,2 gam +) Nếu phản ứng tạo muối M2HPO4 : 0,2 mol → mmuối = 32,67 gam +) Nếu phản ứng tạo muối MH2PO4 : 0,2 mol → mmuối = 26,13 gam Ta thấy: mMH2PO4 (=26,13 gam) < 29,4 < mM2HPO4 (32,67 gam) nên phản ứng tạo 2 muối M2HPO4 (x mol) và MH2PO4 (y mol) BTNT "P" => x + y = 0,2 mol (1) mmuối = x.490/3 + 392/3.y = 29,4 (2) Giải (1) và (2) được x = y = 0,1 mol → nM = 2x + y = 0,3 mol = nNa + nK = 0,001V + 0,002V → V = 100 ml Đáp án D Câu hỏi 15 : Hấp thụ hoàn toàn V lít CO2 (đktc) vào bình đựng 200 ml dung dịch NaOH 1M và Na2CO3 0,5M. Cô cạn dung dịch sau phản ứng thu được 19,9 gam chất rắn khan. Giá trị V là
Đáp án: B Phương pháp giải: Giả sử NaOH không còn sau phản ứng thì muối sau khi cô cạn là Na2CO3 (vì nếu có NaHCO3 thì cũng bị phân hủy thành Na2CO3). BTNT "Na" xác định được số mol của Na2CO3 trong chất rắn và so sánh thấy khác khối lượng chất rắn đề bài cho => NaOH dư Giả sử chất rắn sau khi cô cạn gồm: Na2CO3 (x mol) và NaOH dư (y mol) + m chất rắn => (1) + BTNT "Na": 2nNa2CO3 thu được + nNaOH dư = nNaOH bđ + 2nNa2CO3 bđ => (2) Giải hệ (1) và (2) được x, y BTNT "C": nCO2 + nNa2CO3 bđ = nNa2CO3 thu được => nCO2 = ? Lời giải chi tiết: nNaOH = 0,2 mol; nNa2CO3 bđ = 0,1 mol Giả sử NaOH không còn sau phản ứng thì muối sau khi cô cạn là Na2CO3 (vì nếu có NaHCO3 thì cũng bị phân hủy thành Na2CO3). BTNT "Na": nNa2CO3 = 0,5nNaOH + nNa2CO3 bđ = 0,5.0,2 + 0,1 = 0,2 mol => m chất rắn = 0,2.106 = 21,2 gam ≠ 19,9 gam => NaOH dư Giả sử chất rắn sau khi cô cạn gồm: Na2CO3 (x mol) và NaOH dư (y mol) + m chất rắn = 106x + 40y = 19,9 (1) + BTNT "Na": 2nNa2CO3 thu được + nNaOH dư = nNaOH bđ + 2nNa2CO3 bđ => 2x + y = 0,2 + 2.0,1 (2) Giải hệ (1) và (2) được x = 0,15 và y = 0,1 BTNT "C": nCO2 + nNa2CO3 bđ = nNa2CO3 thu được => nCO2 + 0,1 = 0,15 => nCO2 = 0,05 mol => V = 0,05.22,4 = 1,12 lít Đáp án B Câu hỏi 16 : Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 1 mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau :
Đáp án: A Phương pháp giải: + Xét phần 2 có:12(nCO2(bd)+nCO32−(bd))=nBaCO3→b=? + Xét phần 1: giả sử dd X có x mol NaHCO3 và y mol Na2CO3 phản ứng với 0,12 mol HCl ta có hệ: {nH+=x+2y=0,12nCO2=x+y=0,09→{x=?y=? → Tỉ lệ NaHCO3 và Na2CO3 có trong phần 1 BTNT "C" ta có: nNaHCO3+nNa2CO3=12(nCO2(bd)+nCO32−(bd)) → Số mol của NaHCO3 và Na2CO3 có trong phần 1 BTNT "Na" tính được a Có a, b ta suy ra được tỉ lệ Lời giải chi tiết: nCO2(đktc) = 3,36 :22,4 = 0,15 (mol) Phần 1: nHCl = 0,12.1 = 0,12 (mol); nCO2(đktc) = 2,016:22,4 = 0,09 (mol) Phần 2: nBaCO3 = 29,55 : 197 = 0,15 (mol) Xét phần 2 có: 12(nCO2(bd)+nCO32−(bd))=nBaCO3→12(0,15+b)=0,15→b=0,15 Xét phần 1: giả sử dd X có x mol NaHCO3 và y mol Na2CO3 phản ứng với 0,12 mol HCl ta có hệ: {nH+=x+2y=0,12nCO2=x+y=0,09→{x=0,06y=0,03 → Trong phần 1 có nNaHCO3nNa2CO3=0,060,03=21 BTNT "C" ta có: nNaHCO3+nNa2CO3=12(nCO2(bd)+nCO32−(bd))=0,15 → Phần 1 có 0,1 mol NaHCO3 và 0,05 mol Na2CO3 BTNT "Na" ta có: a + 2.0,15 = 2.(0,1+ 0,05.2) → a = 0,1 → a : b = 0,1 : 0,15 = 2:3 Đáp án A Câu hỏi 17 : Hấp thụ hoàn toàn 3,36 lít CO2(đktc) vào 100ml dung dịch gồm Na2CO3 0,25M và KOH a mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch Ca(NO3)2(dư), thu được 7,5 gam kết tủa.giá trị của a là
Đáp án: D Phương pháp giải: Trong Y có: nCO32- = nCaCO3 = ? ; nHCO3- = nCO2 + nCO3 2-(bđ) - nCO32-(Y) = ? => nOH- = nHCO3- + 2. (nCO32-(Y) - nCO32- (bđ) ) = ? Lời giải chi tiết: nCO2(đktc) = 3,36 :22,4 = 0,15 (mol) ; nNa2CO3 = 0,1.0,25 = 0,025 (mol); nCaCO3 = 7,5 :100 = 0,075 (mol) Vì nCaCO3 < nCO2 + nCO32- ban đầu nên khi hấp thụ CO2 vào dd chứa CO32-: 0,025 mol và OH-: 0,1a (mol) xảy ra phản ứng các phản ứng sau CO2 + OH-→ HCO3- (1) CO2 + 2OH- → CO32- + H2O (2) Trong dd Y chứa nCO32-(Y) = nCaCO3 = 0,075 (mol) BTNT "C": nHCO3- = nCO2 + nCO32- bđ - nCO32-(Y) = 0,15 + 0,025 - 0,075 = 0,1 (mol) => nKOH = nHCO3- + (nCO32-(Y) - nCO32- bđ) = 0,1 + 2(0,075 - 0,025)= 0,2 (mol) => 0,1a = 0,2 => a = 2 (M) Đáp án D Câu hỏi 18 : Hấp thụ hoàn toàn 0,56 lít CO2 (đktc) vào 50 mL dung dịch gồm K2CO3 1,0M và KOH xM, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư, thu được 9,85 gam kết tủa. Giá trị của x là
Đáp án: B Phương pháp giải: CO2 + OH- → HCO3 – CO2 + 2OH- → CO3 2- + H2O Dd Y chứa: HCO3- ; CO32- ; K+ Ba2+ + CO32- → BaCO3↓ => nCO3 2- (trong Y) = nBaCO3 = ? (mol) Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- (trong Y) + nCO32- (trong Y) => nHCO3- (trong Y) =? (mol) Bảo toàn điện tích các chất trong dd Y: nK+ = nHCO3- + 2. nCO32- = ? (mol) BTNT K: nKOH = ∑ nK+ - 2nK2CO3 = ? (mol) => x = ? (M) Lời giải chi tiết: nCO2 = 0,025 (mol) ; nK2CO3 = 0,05 (mol) ; nKOH = 0,05x (mol) nBaCO3 = 9,85 : 197 = 0,05 (mol) CO2 + OH- → HCO3 – CO2 + 2OH- → CO3 2- + H2O Dd Y chứa: HCO3- ; CO32- ; K+ Ba2+ + CO32- → BaCO3↓ => nCO3 2- (trong Y) = nBaCO3 = 0,05 (mol) Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- (trong Y) + nCO32- (trong Y) => 0,025 + 0,05 = nHCO3- (trong Y) + 0,05 => nHCO3- (trong Y) =0,025 (mol) Bảo toàn điện tích các chất trong dd Y: nK+ = nHCO3- + 2. nCO32- = 0,025 + 2. 0,05 = 0,125 (mol) BTNT K: nKOH = ∑ nK+ - 2nK2CO3 = 0,125 – 2. 0,05 = 0,025 (mol) => 0,05x = 0,025 => x = 0,5 (M) Đáp án B Câu hỏi 19 : Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào dung dịch chứa a mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau. Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc). Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa. Tỉ lệ a: b tương ứng là
Đáp án: B Phương pháp giải: Bảo toàn nguyên tố C, Na Bảo toàn điện tích Lời giải chi tiết: Đáp án B Câu hỏi 20 : Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100ml dung dịch chứa K2CO3 0,2M và NaOH x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư, thu được 11,82 gam kết tủa. Giá trị của x là:
Đáp án: A Phương pháp giải: + BTNT C => nHCO3-=nCO2+nK2CO3-nCO32- + nOH-=2nCO32-+nHCO3- Lời giải chi tiết: nCO2=0,1 mol; nK2CO3=0,02 mol nCO32-=nBaCO3=0,06 mol BTNT C => nHCO3-=nCO2+nK2CO3-nCO32-=0,1+0,02-0,06=0,06 mol => CO2 tác dụng với NaOH: CO32-: 0,06-0,02=0,04 mol HCO3-: 0,06 mol => nOH-=2nCO32-+nHCO3-=2.0,04+0,06=0,14 mol => x=1,4M Đáp án A Câu hỏi 21 : Hỗn hợp X gồm hai muối R2CO3 và RHCO3. Chia 44,7 gam X thành ba phần bằng nhau: - Phần một tác dụng hoàn toàn với dung dịch Ba(OH)2 dư, thu được 35,46 gam kết tủa. - Phần hai tác dụng hoàn toàn với dung dịch BaCl2 dư, thu được 7,88 gam kết tủa. - Phần ba tác dụng tối đa với V ml dung dịch KOH 2M. Giá trị của V là
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố C, bảo toàn khối lượng Lời giải chi tiết: Gọi số mol R2CO3 và RHCO3 lần lượt là x và y mol trong mỗi phần + Phần 1: nBaCO3 = x + y = 0,18 mol + Phần 2: nBaCO3 = x = 0,04 mol => y = 0,14 mol Vậy xét trong mỗi phần có m = 14,9 g => 0,04. ( 2R + 60) + 0,14. ( R + 61) = 14,9 => R = 18 ( NH4) + Phần 3: nKOH = 2nNH4HCO3 + 2n(NH4)2CO3 = 0,36 mol => V = 0,18 lít = 180ml Đáp án A Câu hỏi 22 : Hấp thụ hoàn toàn V lít khí CO2 (đktc) vào 400ml dung dịch KOH x mol, thu được dung dịch X. Nhỏ từ từ đến hết 500 ml dung dịch HCl 1M vào dung dịch X, thu được dung dịch Y và thoát ra 2,24 lít khí (đktc). Cho dung dịch Y tác dụng với Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là:
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Câu hỏi 23 : Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100ml dung dịch chứa K2CO3 0,2M và NaOH x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư, thu được 11,82 gam kết tủa. Giá trị của x là:
Đáp án: A Phương pháp giải: + BTNT C => nHCO3-=nCO2+nK2CO3-nCO32- + nOH-=2nCO32-+nHCO3- Lời giải chi tiết: nCO2=0,1 mol; nK2CO3=0,02 mol nCO32-=nBaCO3=0,06 mol BTNT C => nHCO3-=nCO2+nK2CO3-nCO32-=0,1+0,02-0,06=0,06 mol => CO2 tác dụng với NaOH: CO32-: 0,06-0,02=0,04 mol HCO3-: 0,06 mol => nOH-=2nCO32-+nHCO3-=2.0,04+0,06=0,14 mol => x=1,4M Đáp án A Câu hỏi 24 : Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 1,82 gam kết tủa. Gía trị của x là
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố Lời giải chi tiết: nCO2 = 2,24:22,4 = 0,1 mol; nK2CO3 = 0,02 mol; nKOH = 0,1x mol; nBaCO3 = 11,82: 197 = 0,06 mol Ta thấy: nCO2 + nCO32- (trong K2CO3) = 0,1 + 0,02 > nBaCO3 = 0,06 mol => Hấp thụ CO2 xảy ra 2 PT: CO2 + OH- → HCO3- (1) CO2 + 2OH- → CO3 2- + H2O (2) Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- + nBaCO3 => nHCO3- = 0,1 + 0,02 – 0,06 = 0,06 mol => ∑nOH- (1) +(2) = nHCO3- + 2 (nBaCO3 - nK2CO3 ) = 0,06 + 2. ( 0,06 – 0,02) = 0,14 mol => CM = n: V = 0,14 : 0,1 = 1,4 M Đáp án A Câu hỏi 25 : Hỗn hợp X gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Cho 32,65 gam X tác dụng vừa đủ với dung dịch HCl thu được dunh dịch Y và có 17,6 gam CO2 thoát rA. Dung dịch Y tác dụng với dung dịch AgNO3 dư được 100,45 gam kết tủa. Phần trăm khối lượng muối MCl trong X gần nhất với giá trị nào sau đây?
Đáp án: D Phương pháp giải: Phương pháp giải: Bảo toàn khối lượng, bảo toàn nguyên tố Lời giải chi tiết: Hướng dẫn giải: Sơ đồ:X → MCl → AgCl⇒ nAgCl = nCl(Y) = 0,7 molĐặt số mol các chất trong X lần lượt là: a, b, c mol.⇒ nCl(Y) = nMCl = nM = 2a + b + c = 0,7 mol (1)Và nCO2 = a + b = 0,4 mol (2) Có mX = mM2CO3 + mMHCO3 + mMCl = a(2M + 60) + b(M + 61) + c(M + 35,5) ⇒ (2a + b + c)M + 60(a + b) + b + 35,5c = 32,65 g (3)⇒ 0,7M = 8,65 - b - 35,5c < 8,65⇒ M < 12,36⇒ M là Li (M = 7) Thay M = 7 vào (3) ta có 74a + 68b + 42,5c = 32,65 Giải hệ ta có a = b = 0,2, c = 0,1 => %MCl = 13,02% Đáp án D Câu hỏi 26 : Thêm từ từ đến hết dung dịch chứa 0,2 mol KHCO3 và 0,1 mol K2CO3 vào dung dịch chứa 0,3 mol HCl . Thể tích CO2 thu được là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: (*) Phương pháp : (*) Dạng : Muối Cacbonat , Hidrocacbonat + H+ - TH : Nếu Cho từ từ Muối (CO32- : x mol và HCO3- : y mol) vào dung dịch Axit => Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời CO32- + 2H+ ® CO2 + H2O HCO3- + H+ ® CO2 + H2O => nCO3 pứ : nHCO3 pứ = x : y
- Lời giải : nKHCO3 : nK2CO3 = 0,2 : 0,1 = 2x : x CO32- + 2H+ ® CO2 + H2O x 2x x HCO3- + H+ ® CO2 + H2O 2x 2x 2x => nHCl = 4x = 0,3 => x = 0,075 mol => VCO2 = 22,4.3x = 5,04 lit Đáp án B Câu hỏi 27 : Hấp thụ hoàn toàn 1,12 lit khí CO2 (dktc) vào 200 ml dung dịch NaOH 1M , thu được dung dịch Y. Cho từ từ dung dịch HCl 2,5M vào Y khi bắt đầu có khí sinh ra thì hết V ml . Giá trị của V là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: nCO2 = 0,05 ; nNaOH = 0,2 mol dư so với CO2 => sau phản ứng có : 0,05 mol Na2CO3 và 0,1 mol NaOH H+ + OH- -> H2O CO32- + H+ -> HCO3- HCO3- + H+ -> CO2 + H2O => nHCl = nCO3 + nOH = 0,15 mol => V = 0,06 lit = 60 ml Đáp án C Câu hỏi 28 : Hấp thụ hoàn toàn 1,12 lít CO2(đkc) vào 150 ml dung dịch KOH 1M thu được dung dịch X. Cho từ từ dung dịch HCl 2,5M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
Đáp án: B Phương pháp giải: CT nhanh: nH+ = nOH- + nCO32- Lời giải chi tiết: nCO2 = 0,05 mol ; nKOH = 0,15 mol => Sau phản ứng có : nK2CO3 = 0,05 mol ; nKOH = 0,05 mol Cho từ từ H+ đến khi có khí sinh ra H+ + OH- → H2O H+ + CO32- → HCO3- => nHCl = nK2CO3 + nKOH = 0,05 + 0,05 = 0,1 mol => Vdd HCl = 0,04 lit = 40 ml Đáp án B Câu hỏi 29 : Hấp thụ hoàn toàn 1,12 lit khí CO2 ( đktc) vào 200 ml dung dịch KOH 1M thu được dung dịch X. Cho từ từ dd HCl 2,5 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
Đáp án: B Phương pháp giải: CThức: nH+ = nOH- + nCO32- Lời giải chi tiết: nCO2 = 0,05 ; nKOH = 0,2 mol > 2nCO2 => OH- dư => nK2CO3 = 0,05 ; nKOH dư = 0,1 mol Nhỏ từ từ HCl đến khi có khí thì dừng , có các phản ứng sau : HCl + KOH -> KCl + H2O K2CO3 + HCl -> KHCO3 + KCl => nHCl = nKOH + nK2CO3 = 0,15 mol => V = 0,06 lit = 60 ml Đáp án B Câu hỏi 30 : Hấp thụ hết 8,96 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 400 ml dung dịch X. Lấy 200 ml dung dịch X cho từ từ vào 600 ml dung dịch HCl 0,5M, thu được 5,376 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
Đáp án: B Phương pháp giải: 400 ml dd X = CO2: 0,4 mol + {KOH: x mol; K2CO3: y mol} → 200 ml dd X = CO2: 0,2 mol + {KOH: 0,5x mol; K2CO3: 0,5y mol} và 100 ml dd X = CO2: 0,1 mol + {KOH: 0,25x mol; K2CO3: 0,25y mol} * 100 ml dd X + Ba(OH)2 dư: BTNT "C" → nCO2 + nK2CO3 = nBaCO3 → 0,1 + 0,5y = 39,4/197 → y * Cho từ từ 200 ml dd X + HCl (0,3 mol) thu được 0,24 mol CO2: Chứng minh được phản ứng tạo 2 muối CO32- và HCO3- Do nCO2 < nHCO3- + nCO32- nên H+ hết; HCO3- và CO32- dư Khi cho từ từ H+ vào {HCO3-; CO32-} thì HCO3- và CO32- phản ứng đồng thời với H+ theo đúng tỉ lệ mol của chúng. Như vậy: HCO3- + H+ → H2O + CO2 a a a CO32- + 2H+ → H2O + CO2 b 2b b Lập hệ phương trình về số mol H+ và số mol CO2 tìm được a, b → Tỉ lệ mol của HCO3- và CO32- Mà trong dd X có nHCO3- + nCO32- = nCO2 + nK2CO3 = ? → nHCO3- và nCO32- Áp dụng bảo toàn điện tích để tìm x. Lời giải chi tiết: 400 ml dd X = CO2: 0,4 mol + {KOH: x mol; K2CO3: y mol} → 200 ml dd X = CO2: 0,2 mol + {KOH: 0,5x mol; K2CO3: 0,5y mol} và 100 ml dd X = CO2: 0,1 mol + {KOH: 0,25x mol; K2CO3: 0,25y mol} * 100 ml dd X + Ba(OH)2 dư: BTNT "C" → nCO2 + nK2CO3 = nBaCO3 → 0,1 + 0,25y = 39,4/197 → y = 0,4 * Cho từ từ 200 ml dd X + HCl (0,3 mol) thu được 0,24 mol CO2: +) Nếu dd X chỉ chứa ion CO32- thì theo bảo toàn C → nCO32- = 0,2 + 0,5y = 0,4 mol CO32- + 2H+ → H2O + CO2 Bđ: 0,4 0,3 Pư: 0,15 ← 0,3 → 0,15 +) Nếu dd X chỉ chứa ion HCO3- thì theo bảo toàn C → nHCO3- = 0,4 mol HCO3- + H+ → H2O + CO2 Bđ: 0,4 0,3 Pư: 0,3 ← 0,3 → 0,3 Mà theo đề bài: 0,15 < nCO2 (= 0,24 mol) < 0,3 → Tạo 2 muối CO32- và HCO3- Do nCO2 < nHCO3- + nCO32- nên H+ hết; HCO3- và CO32- dư Khi cho từ từ H+ vào {HCO3-; CO32-} thì HCO3- và CO32- phản ứng đồng thời với H+ theo đúng tỉ lệ mol của chúng. Như vậy: HCO3- + H+ → H2O + CO2 a a a CO32- + 2H+ → H2O + CO2 b 2b b Ta có hệ: {nH+=a+2b=0,3nCO2=a+b=0,24→{a=0,18b=0,06→nHCO3−nCO22−=0,180,06=31 Mà trong 200 ml dd X có nHCO3- + nCO32- = nCO2 + nK2CO3 = 0,2 + 0,2 = 0,4 mol nên dễ dàng suy ra: nHCO3- = 0,3 và nCO32- = 0,1 BTĐT → nK+ = nHCO3- + 2.nCO32- → 0,5x + 2.0,5y = 0,3 + 2.0,1 → x = 0,2 Đáp án B
Câu hỏi 31 : Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
Đáp án: B Phương pháp giải: Khi cho từ từ dd chứa HCO3- và CO32- vào dd HCl sẽ xảy ra phản ứng: HCO3- + H+ → CO2 + H2O CO32- + 2H+ → CO2 + H2O Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ này trùng với tỉ lệ HCO3- và CO32- ban đầu. Bảo toàn nguyên tố C Bảo toàn điện tích Bảo toàn nguyên tố K Lời giải chi tiết: CO2⏟0,2mol+{KOH:x(mol)K2CO3:y(mol)→ddX⏟200ml{HCO3−:2a(mol)CO32−:2b(mol)K+⟨100mlX+0,15molHCl→CO2:0,12mol100mlX+Ba(OH)2du→BaCO3↓:0,2mol TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+ Khi cho từ từ 100 ml dd X vào 0,15 mol HCl OH- + H+ → H2O CO32- + 2H+ → CO2 ↑+ H2O => nH+ = nOH- + 2nCO2 > 0,12.2 = 0,24 (mol) => loại vì nH+ = 0,15 (mol) Vậy dd X không chứa OH- dư TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng: HCO3- + H+ → CO2 + H2O x → x →x (mol) CO32- + 2H+ → CO2 + H2O y → 2y → y (mol) Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ xy=ab Ta có: {∑nCO2=x+y=0,12∑nHCl=x+2y=0,15=>{x=0,09(mol)y=0,03(mol)=>ab=xy=31 => a – 3b = 0 (1) BTNT C: nBaCO3 = a + b = 0,2 (2) Từ (1) và (2) => a = 0,15 và b = 0,05 (mol) Trong 200 ml dd X : nHCO3- = 0,3 (mol) ; nCO32- = 0,1 (mol) Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol) BTNT C: nCO2(bđ) + nK2CO3 = nHCO3-+ nCO32- => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol) BTNT K: nK+ = nKOH + 2nK2CO3 => nKOH = 0,5 – 2.0,2 = 0,1 (mol) => x = 0,1 (mol) Đáp án B Câu hỏi 32 : Hấp thụ hết 4,480 lít CO2(đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ 100 ml X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
Đáp án: C Phương pháp giải: CO2:0,02(mol)+{KOH:x(mol)K2CO3:y(mol)→ddX{HCO3−:amolCO32−:bmol⟨+HCl:0,15mol→CO2:0,12mol+Ba(OH)2→BaCO3:0,2mol Xét trong 100 ml dung dịch X BTNT: C => nBaCO3 = a + b = 0,2 (1) Gọi u và v lần lượt là số mol HCO3- và CO32- tác dụng với HCl với tỉ lệ u/v = a/b HCO3- + H+ → CO2 + H2O u → u → u (mol) CO32- + 2H+ → CO2 + H2O v → 2v → v (mol) Ta có hệ phương trình {∑nH+=u+2v=0,15∑nCO2=u+v=0,12=>{u=?(mol)v=?(mol)=>ab=uv=?(2) Từ (1) và (2) => a = ? và b = ? (mol) Xét trong 200 ml dd X chứa: CO32-: 2b ; HCO3-: 2a; K+ : ? (mol) ( Bảo toàn điện tích ra được số mol của K+) BTNT K, C => x, y = ? Lời giải chi tiết: CO2:0,02(mol)+{KOH:x(mol)K2CO3:y(mol)→ddX{HCO3−:amolCO32−:bmol⟨+HCl:0,15mol→CO2:0,12mol+Ba(OH)2→BaCO3:0,2mol Xét trong 100 ml dung dịch X BTNT: C => nBaCO3 = a + b = 0,2 (1) Gọi u và v lần lượt là số mol HCO3- và CO32- tác dụng với HCl với tỉ lệ u/v = a/b HCO3- + H+ → CO2 + H2O u → u → u (mol) CO32- + 2H+ → CO2 + H2O v → 2v → v (mol) Ta có hệ phương trình {∑nH+=u+2v=0,15∑nCO2=u+v=0,12=>{u=0,03(mol)v=0,09(mol)=>ab=uv=13=>3a−b=0(2) Từ (1) và (2) => a = 0,05 và b = 0,15 (mol) Xét trong 200 ml dd X chứa: CO32-: 0,1 ; HCO3-: 0,3; K+ : 0,5 (mol) ( Bảo toàn điện tích ra được số mol của K+) {BTNT:K→x+2y=0,5BTNT:C→y+0,2=0,1+0,3=>{x=0,1y=0,2 Đáp án C Câu hỏi 33 : Lên men m gam tinh bột thành ancol etylic với hiệu suất 81%, hấp thụ toàn bộ khí CO2 sinh ra vào dung dịch chứa 0,05 mol Ba(OH)2, thu được kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào X, đến khi kết tủa lớn nhất thì cần tối thiểu 10ml dung dịch NaOH 1M. Giá trị của m là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 34 : Hấp thụ hoàn toàn V lít khí CO2 (đktc) vào 250ml dung dịch hỗn hợp gồm NaOH 0,4M và KOH aM thu được dung dịch X. Cho từ từ 250 ml dung dịch H2SO4 0,5M vào X thu được dung dịch Y và 1,68 lít khí CO2 (đktc). Cho Y tác dụng với dung dịch Ba(OH)2 dư thấy xuất hiện 34,05 gam kết tủa trắng. Giá trị của a là
Đáp án: B Phương pháp giải: Tính nNaOH ; nKOH; nH2SO4; nCO2 mBaSO4 max < 34,05 gam => còn có BaCO3 => Trong Y chứa HCO3- (không chứa H+) m kết tủa = mBaSO4 + mBaCO3 => mBaCO3 => nBaCO3 CO2+{NaOH:0,1KOH:0,25a→X+H2SO4:0,125→Y{Na+:0,1K+:0,25aHCO3−SO42−:0,125CO2:0,075+Ba(OH)2du→{BaSO4:0,125BaCO3 => nHCO3- (Y) = nBaCO3 BTĐT cho dd Y: nNa+ + nK+ = nHCO3- + 2nSO4 2- => a Lời giải chi tiết: nNaOH = 0,1 mol; nKOH = 0,25a mol nH2SO4 = 0,125 mol; nCO2 = 0,075 mol mBaSO4 max = 0,125.233 = 29,125 gam < 34,05 gam => còn có BaCO3 => Trong Y chứa HCO3- (không chứa H+) m kết tủa = mBaSO4 + mBaCO3 => mBaCO3 = 34,05 – 0,125.233 = 4,925 gam => nBaCO3 = 0,025 mol CO2+{NaOH:0,1KOH:0,25a→X+H2SO4:0,125→Y{Na+:0,1K+:0,25aHCO3−SO42−:0,125CO2:0,075+Ba(OH)2du→{BaSO4:0,125BaCO3 => nHCO3- (Y) = nBaCO3 = 0,025 mol BTĐT cho dd Y: nNa+ + nK+ = nHCO3- + 2nSO4 2- => 0,1 + 0,25a = 0,025 + 0,125.2 => a = 0,7 Đáp án B Câu hỏi 35 : Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Lấy 100 ml dung dịch X cho từ từ vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng được với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x gần nhất với giá trị nào sau đây?
Đáp án: B Phương pháp giải: Ta có: nCO2, nHCl Nếu X có OH- dư thì X gồm K+, OH-, CO32-. Khi cho từ từ X vào H+ thì: Ta có: nH+ = nOH- dư + 2.nCO2 = nOH- dư+ 2. 0,12 > 0,24 mol, trái với giả thiết là chỉ dùng 0,15 mol H+ Vậy X không chứa OH- dư. Trong 100 ml dung dịch X chứa CO32-: a mol; HCO3-: b mol và K+ - Khi cho dung dịch X tác dụng với Ba(OH)2 dư thì: HCO3-+ OH- → CO32-+ H2O Ba2++ CO32- → BaCO3 Bảo toàn C ta có: nBaCO3 = nHCO3-+ nCO3(2-) → (1) - Khi cho X từ từ vào dung dịch HCl: HCO3-+ H+ → CO2+ H2O CO32-+ 2H+ → CO2+ H2O Đặt u, v lần lượt là số mol CO32- và HCO3- phản ứng với u/v = a/b Ta có: nHCl = 2u + v = 0,15 mol; nCO2 = u + v = 0,12 mol Giải hệ trên ta có: u và v Vậy a/b = u/v → (2) Giải hệ (1) và (2) ta có: a và b Áp dụng bảo toàn điện tích ta có: 2.nCO3(2-)+ 1.nHCO3- = nK+ → nK+ Áp dụng bảo toàn nguyên tố C và nguyên tố K để tìm x và y. Lời giải chi tiết: Ta có: nCO2 = 0,12 mol, nHCl = 0,15 mol Nếu X có OH- dư thì X gồm K+, OH-, CO32-. Khi cho từ từ X vào H+ thì: Ta có: nH+ = nOH- dư + 2.nCO2 = nOH- dư+ 2. 0,12 > 0,24 mol, trái với giả thiết là chỉ dùng 0,15 mol H+ Vậy X không chứa OH- dư. Trong 100 ml dung dịch X chứa CO32-: a mol; HCO3-: b mol và K+ -Khi cho dung dịch X tác dụng với Ba(OH)2 dư thì: HCO3-+ OH- → CO32-+ H2O Ba2++ CO32- → BaCO3 Ta có: nBaCO3 = 39,4 : 197 = 0,2 mol Vậy khi đó theo bảo toàn C ta có: nBaCO3 = nHCO3-+ nCO3(2-) → 0,2 = a + b (1) -Khi cho X từ từ vào dung dịch HCl: HCO3-+ H+ → CO2+ H2O CO32-+ 2H+ → CO2+ H2O Đặt u, v lần lượt là số mol CO32- và HCO3- phản ứng với u/v = a/b Ta có: nHCl = 2u + v = 0,15 mol; nCO2 = u + v = 0,12 mol Giải hệ trên ta có: u = 0,03 và v = 0,09 Vậy a/b = u/v = 1/3 → 3a- b =0 (2) Giải hệ (1) và (2) ta có: a = 0,05 và b = 0,15 Do đó trong 200 ml dung dịch X chứa 0,1 mol CO32- và 0,3 mol HCO3- Áp dụng bảo toàn điện tích ta có: 2.nCO3(2-)+ 1.nHCO3- = nK+ →2.0,1 + 0,3 = nK+ → nK+ = 0,5 mol Bảo toàn nguyên tố K ta có: x + 2y = 0,5 (3) Bảo toàn nguyên tố C ta có: y + 0,2 = 0,1 + 0,3 (4) Giải hệ (3) và (4) ta có: x = 0,1 và y = 0,2 Vậy x = 0,1 gần nhất với giá trị 0,11 Đáp án B Câu hỏi 36 : Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác cho 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4g kết tủa. Giá trị của x là:
Đáp án: B Phương pháp giải: Bài toán muối cacbonat, hidrocacbonat + H+ - TH1: Nếu Cho từ từ Muối (CO32-: x mol và HCO3-: y mol) vào dung dịch Axit => Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời theo đúng tỉ lệ về số mol. CO32- + 2H+ → CO2 + H2O HCO3- + H+ → CO2 + H2O => nCO3 pứ : nHCO3 pứ = x : y - TH2: Nếu cho từ từ H+ vào dung dịch muối (CO32-: x mol và HCO3-: y mol) => Do ban đầu H+ thiếu nên phản ứng với CO32- trước: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O - TH3: Trộn nhanh 2 dung dịch axit và muối => Không biết chất nào phản ứng với chất nào trước => Xét cả 2 trường hợp TH1 và TH2 => Sau đó lấy giá trị trong khoảng Lời giải chi tiết: nCO2 = 4,48 : 22,4 = 0,2 mol; nBaCO3 = 39,4 : 197 = 0,2 mol *Cho 100 ml dung dịch X tác dụng với Ba(OH)2 dư thu được 0,2 mol BaCO3 => 200 ml 0,4 mol BTNT "C": nCO2 + nK2CO3 bđ = nBaCO3 => 0,2 + y = 0,4 => y = 0,2 mol *CO2 tác dụng với hỗn hợp {KOH và K2CO3} nên có thể có 2 trường hợp xảy ra: - TH1: Tạo thành K2CO3 và KOH dư + Xét 200 ml dung dịch X: BTNT "C": nK2CO3 (dd X) = nCO2 + nK2CO3 bđ = 0,2 + 0,2 = 0,4 mol BTNT "K": nKOH + 2nK2CO3 bđ = nKOH dư + 2nK2CO3 => x + 2.0,2 = nKOH dư + 2.0,4 => nKOH dư = x - 0,4 (mol) Vậy 1/2 dd X gồm: KOH dư (0,5x - 0,2 mol) và K2CO3 (0,2 mol) + Khi cho từ từ 1/2 dung dịch X phản ứng với 0,15 mol HCl thu được 0,12 mol CO2: PTHH: H+ + OH- → H2O 0,5x-0,2 ← 0,5x-0,2 2H+ + CO32- → H2O + CO2 0,24 ← 0,12 (vô lí vì ở đây số mol H+ phản ứng lớn hơn số mol H+ đề bài cho) => Loại - TH2: Tạo KHCO3 và K2CO3 Giả sử dd X chứa a mol KHCO3 và b mol K2CO3 BTNT "C": a + b = (0,2 + 0,2)/2 (1) Phản ứng đồng thời theo đúng tỉ lệ mol: KHCO3 + HCl → H2O + CO2 + KCl ka ka ka K2CO3 + 2HCl → H2O + CO2 + 2KCl kb 2kb → kb nHCl = ka + 2kb = 0,15 (2) và nCO2 = ka + kb = 0,12 (3) Giải (1) (2) (3) được a = 0,15; b = 0,05 => 200 ml X chứa 0,3 mol KHCO3 và 0,1 mol K2CO3 BTNT "K": nKOH bđ + 2nK2CO3 bđ = nKHCO3 + 2nK2CO3 => x + 2.0,2 = 0,3 + 0,1.2 => x = 0,1 Đáp án B Câu hỏi 37 : Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 7,99% về khối lượng) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 3: 2: 7 và 0,784 lít khí H2(đktc). Cho Y tác dụng với dung dịch gồm 0,02 mol Al2(SO4)3, 0,01 mol H2SO4 và 0,04 mol KHSO4 thu được m gam kết tủa. Giá trị của m là:
Đáp án: D Phương pháp giải: Bài toán muối nhôm tác dụng với dd kiềm Cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa: + Với muối nhôm Các phản ứng xảy ra: Al3+ + 3OH- → Al(OH)3 (1) Al(OH)3 + OH- → [Al(OH)4]- (2) Từ (1) và (2) ta rút ra kết luận: + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần Al3+ + 3OH- → Al(OH)3 (1) mol a → 3a → a Al(OH)3 + OH- → [Al(OH)4]- (2) Mol b-3a b-3a nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết: Qui đổi hỗn hơp thành Na (3u mol) ; K (2u mol) ; Ba (7u mol) và O (v mol) (Vì sau khi cho vào nước thu được nNaOH: nKOH: nBa(OH)2 = 3: 2: 7 = 3u: 2u: 7u) Bảo toàn electron: nNa + nK + 2nBa = 2nO + 2nH2 => 3u + 2u + 2.7u = 2v + 0,035.2 Lại có: %mO = 7,99% => 16v = 7,99%.(23.3u + 39.2u + 137.7u + 16v) Giải hệ PT => u = 0,01 ; v = 0,06 mol => nOH = 2v + 0,035.2 = 0,19 mol nH+ = 2nH2SO4 + nKHSO4 = 2.0,01 + 0,04 = 0,06 mol nAl3+ = 2nAl2(SO4)3 = 0,04 mol => nAl(OH)3 = 4nAl3+ - (nOH – nH+) => nAl(OH)3 = 0,03 mol nBa2+ = 0,07 mol và nSO4 = 0,11 mol => nBaSO4 = nBa = 0,07 mol => mrắn = mBaSO4 + mAl(OH)3 = 18,65g Đáp án D Câu hỏi 38 : Sục 6,16 lít CO2 (dktc) vào 1 lít dung dịch chứa NaOH x M và Na2CO3 y M thu được dung dịch X. Cho từ từ 200 ml dung dịch chứa HCl 1M và H2SO4 0,3M vào dung dịch X thu được 2,688 lít khí CO2 (dktc) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 59,29g kết tủa. Tỷ lệ x: y gần nhất với giá trị nào sau đây?
Đáp án: B Phương pháp giải: - Dựa vào thí nghiệm Ba(OH)2 + Y => số mol BaCO3 trong kết tủa => số mol HCO3- trong Y (Vì Cho axit từ từ vào X nên thứ tự phản ứng là: OH- + H+ → H2O CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O) Bảo toàn C: nCO2 bđ + nNa2CO3 = nBaCO3 + nCO2 sản phẩm => nNa2CO3 = y Bảo toàn điện tích: nNa = nCl + 2nSO4 + nHCO3 (Y) => nNa Bảo toàn Na: nNa+ = nNaOH + 2nNa2CO3 => nNaOH = x => x: y Lời giải chi tiết: nCO2 = 6,16 : 22,4 = 0,275 mol nHCl = 0,2.1 = 0,2 mol ; nH2SO4 = 0,2.0,3 = 0,06 mol ; nCO2 sản phẩm = 2,688 : 22,4 = 0,12 mol - Khi Y + Ba(OH)2 thì kết tủa gồm 0,06 mol BaSO4 và BaCO3 => nBaCO3 = 0,23 mol = nHCO3 trong Y (Vì Cho axit từ từ vào X nên thứ tự phản ứng là: OH- + H+ → H2O CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O) Bảo toàn C: nCO2 bđ + nNa2CO3 = nBaCO3 + nCO2 sản phẩm => nNa2CO3 = 0,075 mol => y = 0,075 M - Khi X + axit thì sau phản ứng dung dịch chỉ còn: NaCl ; Na2SO4 và NaHCO3 Bảo toàn điện tích: nNa = nCl + 2nSO4 + nHCO3 (Y) => nNa = 0,55 mol Bảo toàn Na: nNa+ = nNaOH + 2nNa2CO3 => nNaOH = 0,55 – 0,075.2 = 0,4 mol = x =>x : y = 0,4 : 0,075 = 5,3 Đáp án B Câu hỏi 39 : Hấp thụ hết 4,48 lít CO2 (ở đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200ml dung dịch X. Cho từ từ đến hết 100ml dung dịch X vào 300ml dung dịch HCl 0,5M thu được 2,688 lít khí (ở đktc). Mặt khác 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là
Đáp án: A Phương pháp giải: 200 ml dd X = CO2: 0,2 mol + {KOH: x mol; K2CO3: y mol} → 100 ml dd X = CO2: 0,1 mol + {KOH: 0,5x mol; K2CO3: 0,5y mol} * 100 ml dd X + Ba(OH)2 dư: BTNT "C" → nCO2 + nK2CO3 = nBaCO3 → 0,1 + 0,5y = 39,4/197 → y * Cho từ từ 100 ml dd X + HCl (0,15 mol) thu được 0,12 mol CO2: Chứng minh được phản ứng tạo 2 muối CO32- và HCO3- Do nCO2 < nHCO3- + nCO32- nên H+ hết; HCO3- và CO32- dư Khi cho từ từ H+ vào {HCO3-; CO32-} thì HCO3- và CO32- phản ứng đồng thời với H+ theo đúng tỉ lệ mol của chúng. Như vậy: HCO3- + H+ → H2O + CO2 a a a CO32- + 2H+ → H2O + CO2 b 2b b Lập hệ phương trình về số mol H+ và số mol CO2 tìm được a, b → Tỉ lệ mol của HCO3- và CO32- Mà trong dd X có nHCO3- + nCO32- = nCO2 + nK2CO3 = ? → nHCO3- và nCO32- Áp dụng bảo toàn điện tích để tìm x. Lời giải chi tiết: 200 ml dd X = CO2: 0,2 mol + {KOH: x mol; K2CO3: y mol} → 100 ml dd X = CO2: 0,1 mol + {KOH: 0,5x mol; K2CO3: 0,5y mol} * 100 ml dd X + Ba(OH)2 dư: BTNT "C" → nCO2 + nK2CO3 = nBaCO3 → 0,1 + 0,5y = 39,4/197 → y = 0,2 * Cho từ từ 100 ml dd X + HCl (0,15 mol) thu được 0,12 mol CO2: +) Nếu dd X chỉ chứa ion CO32- thì theo bảo toàn C → nCO32- = 0,1 + 0,1 = 0,2 mol CO32- + 2H+ → H2O + CO2 Bđ: 0,2 0,15 Pư: 0,075 ← 0,15 → 0,075 +) Nếu dd X chỉ chứa ion HCO3- thì theo bảo toàn C → nHCO3- = 0,2 mol HCO3- + H+ → H2O + CO2 Bđ: 0,2 0,15 Pư: 0,15 ← 0,15 → 0,15 Mà theo đề bài: 0,075 < nCO2 (= 0,12 mol) < 0,15 → Tạo 2 muối CO32- và HCO3- Do nCO2 < nHCO3- + nCO32- nên H+ hết; HCO3- và CO32- dư Khi cho từ từ H+ vào {HCO3-; CO32-} thì HCO3- và CO32- phản ứng đồng thời với H+ theo đúng tỉ lệ mol của chúng. Như vậy: HCO3- + H+ → H2O + CO2 a a a CO32- + 2H+ → H2O + CO2 b 2b b Ta có hệ: {nH+=a+2b=0,15nCO2=a+b=0,12→{a=0,09b=0,03→nHCO3−nCO22−=0,090,03=31 Mà trong dd X có nHCO3- + nCO32- = nCO2 + nK2CO3 = 0,1 + 0,1 = 0,2 mol nên dễ dàng suy ra: nHCO3- = 0,15 và nCO32- = 0,05 BTĐT → nK+ = nHCO3- + 2.nCO32- → 0,5x + 0,2 = 0,15 + 2.0,05 → x = 0,1 Đáp án A Câu hỏi 40 : Dung dịch X gồm KHCO3 a M và Na2CO3 1M. Dung dịch Y gồm H2SO4 0,25M và HCl 1,5M. Nhỏ từ từ đến hết 100 ml dung dịch X vào 100 ml dung dịch Y, thu được 2,688 lít (đktc) khí CO2. Nhỏ từ từ cho đến hết 100 ml dung dịch Y vào 100 ml dung dịch X thu được dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Giá trị của a và m lần lượt là
Đáp án: D Phương pháp giải: TN1: Cho từ từ X vào Y thì HCO3- và CO32- phản ứng đồng thời theo đúng tỉ lệ mol HCO3- + H+ → H2O + CO2 CO32- + 2H+ → H2O + CO2 *TN2: Cho từ từ Y vào X thì phản ứng xảy ra lần lượt theo thứ tự CO32- + H+ → HCO3- HCO3- + H+ → H2O + CO2 Lời giải chi tiết:
100 ml X {KHCO3:0,1aNa2CO3:0,1 100 ml Y {H2SO4:0,025HCl:0,15 TN1: Cho từ từ X vào Y thì HCO3- và CO32- phản ứng đồng thời theo đúng tỉ lệ mol HCO3- + H+ → H2O + CO2 x x x CO32- + 2H+ → H2O + CO2 y 2y y (Do nH+ (0,2 mol) < 2nCO32- + nHCO3- (0,2 + 0,1a) nên suy ra H+ hết) Theo đề bài ta có hệ: + nCO2 = x + y = 0,12 mol + nH+ = x + 2y = 0,2 Giải hệ được x = 0,04 và y = 0,08 Do HCO3- và CO32- phản ứng theo đúng tỉ lệ mol nên ta có: 0,1a/0,1 = 0,04/0,08 => a = 0,5 *TN2: Cho từ từ Y vào X thì phản ứng xảy ra lần lượt theo thứ tự CO32- + H+ → HCO3- 0,1 → 0,1 dư 0,1 → 0,1 => nHCO3- = 0,1 + 0,05 = 0,15 mol HCO3- + H+ → H2O + CO2 0,1dư 0,05 ← 0,1 Khi cho dd Ba(OH)2 dư vào dung dịch E thì có các phản ứng tạo kết tủa: HCO3- + OH- → CO32- + H2O 0,05 → 0,05 Ba2+ + CO32- → BaCO3 ↓ 0,05 → 0,05 Ba2+ + SO42- → BaSO4 ↓ 0,025 → 0,025 => m kết tủa = 0,05.197 + 0,025.233 = 15,675 gam Đáp án D Câu hỏi 41 : Hấp thụ hết 4,48 lít CO2 (ở đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200ml dung dịch X. Cho từ từ đến hết 100ml dung dịch X vào 300ml dung dịch HCl 0,5M thu được 2,688 lít khí (ở đktc). Mặt khác 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 42 : Hấp thụ hết một lượng khí CO2 vào dung dịch chứa a mol NaOH thu được dung dịch X. Nhỏ từ từ từng giọt đến hết lượng X vào 140 ml dung dịch HCl 1M và khuấy đều thu được 2,24 lít khí CO2 (đktc). Mặt khác, nếu cho toàn bộ X tác dụng với lượng dư dung dịch Ba(OH)2 thu được 24,625 gam kết tủa. Giá trị của a là
Đáp án: C Phương pháp giải: TH1: X chứa NaOH và Na2CO3 BTNT “C”: nNa2CO3 = nBaCO3 = ? H+ + OH- → H2O 2H+ + CO32- → CO2 + H2O TH2: X chứa Na2CO3 (a mol) và NaHCO3 (b mol) BTNT “C”: nNa2CO3 + nNaHCO3 = nBaCO3 => a + b = 0,125 (1) 2H+ + CO32- → CO2 + H2O 2ka ← ka → ka H+ + HCO3- → CO2 + H2O kb ← kb nH+ = 2ka + kb = 0,14 hay k(2a + b) = 0,14(2) nCO2 = ka + kb = 0,1 hay k(a + b) = 0,1 (3) Từ (1) (2) (3) => a, b BTNT “Na”: nNaOH = 2nNa2CO3 + nNaHCO3 = ? Lời giải chi tiết: nBaCO3 = 24,625 : 197 = 0,125 mol TH1: X chứa NaOH và Na2CO3 BTNT “C”: nNa2CO3 = nBaCO3 = 0,125 mol H+ + OH- → H2O x x 2H+ + CO32- → CO2 + H2O 0,2 ← 0,2 => nH+ = x + 0,2 = 0,14 => x < 0 (loại) TH2: X chứa Na2CO3 (a mol) và NaHCO3 (b mol) BTNT “C”: nNa2CO3 + nNaHCO3 = nBaCO3 => a + b = 0,125 (1) 2H+ + CO32- → CO2 + H2O 2ka ← ka → ka H+ + HCO3- → CO2 + H2O kb ← kb nH+ = 2ka + kb = 0,14 hay k(2a + b) = 0,14(2) nCO2 = ka + kb = 0,1 hay k(a + b) = 0,1 (3) Từ (1) (2) (3) => a = 0,05 và b = 0,075 BTNT “Na”: nNaOH = 2nNa2CO3 + nNaHCO3 = 2.0,05 + 0,075 = 0,175 mol Đáp án C Câu hỏi 43 : Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
Đáp án: B Phương pháp giải: CO2:0,4mol+{NaOH:2,75V(mol)K2CO3:V(mol)→ddXcocan→64,5(g)chatran{Na+:2,75V(mol)K+:2V(mol)CO32−:x(mol)HCO3−:y(mol) BTNT “C”: nCO32- + nHCO3- = nCO2 + nK2CO3 hay x + y = 0,4 + V (1) BTĐT cho dd sau phản ứng có: 2nCO32- + nHCO3- = nNa+ + nK+ => 2x + y = 4,75V (2) Từ (1) và (2) => x và y theo V => Thành phần dung dịch sau phản ứng (với ẩn số mol là V) Dựa vào khối lượng chất tan trong dung dịch sau phản ứng tính được giá trị của V. Lời giải chi tiết:
CO2:0,4mol+{NaOH:2,75V(mol)K2CO3:V(mol)→ddXcocan→64,5(g)chatran{Na+:2,75V(mol)K+:2V(mol)CO32−:x(mol)HCO3−:y(mol) BTNT “C”: nCO32- + nHCO3- = nCO2 + nK2CO3 hay x + y = 0,4 + V (1) BTĐT cho dd sau phản ứng có: 2nCO32- + nHCO3- = nNa+ + nK+ => 2x + y = 4,75V (2) Từ (1) và (2) => x = 3,75V – 0,4 và y = 0,8 – 2,75V Dung dịch sau phản ứng gồm: Na+ (2,75V); K+ (2V), CO32- (3,75V-0,4); HCO3- (0,8-2,75V) (mol) Khối lượng chất tan: 2,75V.23 + 2V.39 + (3,75V - 0,4).60 + (0,8-2,75V).61 = 64,5 => V = 0,2 (lít) = 200 ml Đáp án B Câu hỏi 44 : Hòa tan hoàn toàn m gam hỗn hợp KHCO3 và Na2CO3 vào nước dư thu được dung dịch X. Nhỏ chậm và khuấy đều toàn bộ dung dịch X vào 55 ml dung dịch KHSO4 2M. Sau khi kết thúc phản ứng thu được 1,344 lit khí CO2 (dktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào Y thì thu được 49,27g kết tủa . Giá trị của m là (Cho biết các phản ứng xảy ra hoàn toàn)
Đáp án: C Phương pháp giải: Muối Cacbonat , Hidrocacbonat + H+ - TH1 : Nếu Cho từ từ Muối (CO32- : x mol và HCO3- : y mol) vào dung dịch Axit => Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời CO32- + 2H+ → CO2 + H2O HCO3- + H+ → CO2 + H2O => nCO3 pứ : nHCO3 pứ = x : y - TH2 : Nếu cho từ từ H+ vào dung dịch muối (CO32- : x mol và HCO3- : y mol) => Do ban đầu H+ thiếu nên phản ứng với CO32- trước : CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O - TH3 : Trộn nhanh 2 dung dịch axit và muối => Không biết chất nào phản ứng với chất nào trước => Xét cả 2 trường hợp TH1 và TH2 => và lấy giá trị trong khoảng. (*) Cụ thể ở bài toán này : - Chất kết tủa gồm BaSO4 và BaCO3 Bảo toàn nguyên tố : nS = nKHSO4 = nBaSO4 => mrắn = 49,72 = mBaSO4 + mBaCO3 => nBaCO3 nCO2 = nKHCO3 + nNa2CO3(pứ) => Bảo toàn nguyên tố C : nKHCO3 + nNa2CO3 = nCO2 + nBaCO3 Vì nhỏ chậm X vào KHSO4=> phản ứng đồng thời với cả 2 chất theo tỉ lệ mol nhất định giống với tỉ lệ mol trong hỗn hợp ban đầu Gọi nKHCO3 = a ; nNa2CO3 = b => a + b = ??? (1) =>nKHCO3 pứ = at ; nNa2CO3 pứ = bt Bảo toàn C : nCO2 = nKHCO3 pứ + nNa2CO3 pứ => ??? = (a + b).t => t KHSO4 + KHCO3 → K2SO4 + CO2 + H2O 2KHSO4 + Na2CO3 → K2SO4 + Na2SO4 + CO2 + H2O => nKHSO4 = at + 2bt = ??? => a + b = ??? (2) Từ (1,2) => a, b => m = mKHCO3 + mNa2CO3 Lời giải chi tiết: - Chất kết tủa gồm BaSO4 và BaCO3 nKHSO4 = 0,055.2 = 0,11 mol Bảo toàn nguyên tố : nS = nKHSO4 = nBaSO4 = 0,11 mol => mrắn = 49,72 = mBaSO4 + mBaCO3 => nBaCO3 = 0,12 mol nCO2 = 1,344 : 22,4 = 0,06 mol = nKHCO3 + nNa2CO3(pứ) => Bảo toàn nguyên tố C : nKHCO3 + nNa2CO3 = nCO2 + nBaCO3 = 0,18 mol Vì nhỏ chậm X vào KHSO4=> phản ứng đồng thời với cả 2 chất theo tỉ lệ mol nhất định giống với tỉ lệ mol trong hỗn hợp ban đầu Gọi nKHCO3 = a ; nNa2CO3 = b => a + b = 0,18 (1) =>nKHCO3 pứ = at ; nNa2CO3 pứ = bt Bảo toàn C : nCO2 = nKHCO3 pứ + nNa2CO3 pứ => 0,06 = (a + b).t => t = 1/3 KHSO4 + KHCO3 → K2SO4 + CO2 + H2O 2KHSO4 + Na2CO3 → K2SO4 + Na2SO4 + CO2 + H2O => nKHSO4 = at + 2bt = 0,11 => a + b = 0,33 (2) Từ (1,2) => a = 0,03, b = 0,15 => m = mKHCO3 + mNa2CO3 = 0,03.100 + 0,15.106 = 18,9g Đáp án C Câu hỏi 45 : Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
Đáp án: D Phương pháp giải: TH1: 2 muối đều tạo kết tủa TH2: 1 muối là NaF (X) => muối còn lại là NaCl(Y) Lời giải chi tiết: TH1: 2 muối đều tạo kết tủa Na¯X+AgNO3→NaNO3+Ag¯X →23+¯X108+¯X=6,038,61→¯X=175,6 (loại) TH2: 1 muối là NaF (X) => muối còn lại là NaCl (Y) nAgCl = 0,06 mol = nNaCl => mNaF = 6,03 - 0,06.58,5 = 2,52 g →%mNaF=2,526,03.100%=41,8% Đáp án D Câu hỏi 46 : Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là
Đáp án: D Phương pháp giải: Khi sục từ từ CO32- và HCO3- vào H+ thì phản ứng xảy ra đồng thời và theo đúng tỉ lệ mol. TinhduocnBaCO3{CO32−:0,2HCO3−:a→HCO3−CO32−=5aCO32−+2H+→CO2+H2Oy2yHCO3−+H+→CO2+H2O5ay5ay→{2y+5ay=nH+BT:C→0,2+a=y+5ay+nBaCO3→{y=0,52+5a0,2+a=y+5ay+0,4→0,2+a=0,52+5a+5a.0,52+5a+0,4→a=?→x=nV Lời giải chi tiết: nBaCO3=0,4{CO32−:0,2HCO3−:a→HCO3−CO32−=5aCO32−+2H+→CO2+H2Oy2yHCO3−+H+→CO2+H2O5ay5ay→{2y+5ay=nH+=0,5BT:C→0,2+a=y+5ay+0,4→{y=0,52+5a0,2+a=y+5ay+0,4→0,2+a=0,52+5a+5a.0,52+5a+0,4→a=0,6→x=nV=0,60,5=1,2M Đáp án D Câu hỏi 47 : 2 kim loại kiềm A và B nằm trong 2 chu kì liên tiếp nhau trong bản tuần hoàn các nguyên tố hoá học. Hoà tan 2 kim loại này vào nước thu được 0,336 lít khí (đktc) và dung dịch C. Cho HCl dư vào dung dịch C thu được 2,075 gam muối, hai kim loại đó là
Đáp án: B Phương pháp giải: 2¯R+2H2O→2¯ROH+H2¯ROH+HCl→¯RCl+H2O→¯R Lời giải chi tiết: 2¯R+2H2O→2¯ROH+H2 0,03 ← 0,03 ← 0,015 ¯ROH + HCl→ ¯RCl + H2O 0,03 → 0,03 => ¯R+35,5 = 2,075/0,03 = 69,17 => ¯R = 33,67 => Na, K Đáp án B Câu hỏi 48 : Hỗn hợp X gồm M2CO3, MHCO3 và MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 g chất rắn. Nếu lấy 20,29 g hỗn hợp X trên tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 g kết tủa. Phần trăm khối lượng của kim loại M trong MCl gần đúng với
Đáp án: C Phương pháp giải: Đặt số mol của M2CO3, MHCO3, MCl là x,y,z mol Đun nóng X : 2MHCO3 → M2CO3 + H2O + CO2 X tác dụng với 0,5 mol HCl : M2CO3 + 2HCl → 2MCl + H2O + CO2 MHCO3 + HCl → MCl + H2O + CO2 Dd Y có MCl và có thể có HCl dư MCl + AgNO3 → MNO3 + AgCl HCl + AgNO3 → AgCl + HNO3 . Tính theo PTHH Lời giải chi tiết: Hướng dẫn giải : Đặt số mol của M2CO3, MHCO3, MCl là x,y,z mol Đun nóng X : 2MHCO3 → M2CO3 + H2O + CO2 mrắn giảm = 18. y/ 2 + 44.y/2 =20,29 -18,74 → y = 0,05 mol X tác dụng với 0,5 mol HCl : M2CO3 + 2HCl → 2MCl + H2O + CO2 MHCO3 + HCl → MCl + H2O + CO2 nCO2 = x + y = 0,15 → x =0,1mol → nHCl phản ứng = 2.0,1 + 0,05 =0,25 mol < nHCl ban đầu → HCl dư Dd Y có MCl và có thể có HCl dư Ag+ + Cl- → AgCl 0,52 mol → nCl- = 0,52 = nHCl + nMCl (ban đầu) = 0,5 + z → z = 0,02 mol Ta có mX = 0,1 (2M + 60) + 0,05 ( M + 61) + 0,02 (M + 35,5) → M = 39 (K) Trong KCl thì %K = 39/74,5 .100% =52,35 % Đáp án D Câu hỏi 49 : Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là
Đáp án: D Phương pháp giải:
Lời giải chi tiết:
Câu hỏi 50 : Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1:1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1,0M thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1,0M sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là
Đáp án: B Phương pháp giải: hhX{KNa}+{H2SO4:0,25Al2(SO4)3:0,5}(1)⟶ddY{K+,Na+,AlO2−SO42−,OH−}(2)⟶HCl:1,5molAl(OH)3↓⏟0,3mol+ddZ{Al3+,K+,Na+SO42−,Cl−} Khối lượng Na, K đã dùng có giá trị nhỏ nhất khi xảy ra hiện tượng hòa tan một phần kết tủa ở quá trình (2). Theo bảo toàn nguyên tố Al, gốc SO42- và bảo toàn điện tích trong dung dịch Z sẽ tìm được mol K, Na từ đó tính được m Lời giải chi tiết: hhX{KNa}+{H2SO4:0,25Al2(SO4)3:0,5}(1)⟶ddY{K+,Na+,AlO2−SO42−,OH−}(2)⟶HCl:1,5molAl(OH)3↓⏟0,3mol+ddZ{Al3+,K+,Na+SO42−,Cl−} Khối lượng Na, K đã dùng có giá trị nhỏ nhất khi xảy ra hiện tượng hòa tan một phần kết tủa ở quá trình (2). Theo bảo toàn nguyên tố Al, gốc SO42- và bảo toàn điện tích trong dung dịch Z, ta có: {nAl3+(Z)=nAl3+(bd)−nAl(OH)3=0,2nSO42−=nH2SO4+3nAl2(SO4)3=1,253nAl3+(Z)⏟0,2+nK+⏟x+nNa+⏟x=nCl−⏟1,5+2nSO42−⏟1,25⇒{x=1,7(mol)mmin Đáp án B
|