20 bài toán kim loại kiềm tác dụng với nước có lời giảiLàm bàiCâu hỏi 1 : Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được 2,24 lít H2 (đktc). Hai kim loại đó là
Đáp án: B Phương pháp giải: Bảo toàn electron n Kim loại kiềm = 2 nH2 Lời giải chi tiết: nH2 = 0,1 mol Gọi công thức chung của 2 kim loại kiềm là M 2M + 2H2O → 2MOH + H2 0,2 ← 0,1 (mol) => M trung bình = 6,2 : 0,2 = 31g/mol Do 2 kim loại kiềm ở 2 chu kì liên tiếp nên là Na (M = 23) và K (M = 39) Đáp án B Câu hỏi 2 : Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư), thu được 0,336 lít khí hidro (đktc). Kim loại kiềm là:
Đáp án: D Phương pháp giải: Bảo toàn e Lời giải chi tiết: nH2 = 0,336 : 22,4 = 0,015 (mol) => nM = 0,015.2/1 = 0,03 ( mol) => MM = 0,69 : 0,03 = 23 => Na Đáp án D Câu hỏi 3 : Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của x là
Đáp án: A Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Đáp án A Câu hỏi 4 : Cho 7,8g K vào 192,4g nước thu được m gam dung dịch và 1 lượng khí thoát ra. Giá trị của m là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: nK = 7,8/39 = 0,2 mol nH2 = 0,5nK = 0,1 mol BTKL => m dung dịch = mK + mH2O – mH2 = 7,8 + 192,4 – 0,1.2 = 200 gam Đáp án B Câu hỏi 5 : Cho 4,6g kim loại kiềm M tác dụng với lượng nước dư sinh ra 2,24 lit H2 (dktc). Kim loại M là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: M + H2O → MOH + 0,5H2 0,2 ← 0,1 (mol) => MM = 4,6/0,2 = 23g => Na Đáp án B Câu hỏi 6 : Cho hỗn hợp các kim loại kiềm Na, K hoà tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hoà hết một phần ba dung dịch A là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: nOH- = 2nH2 = 0,06 mol Số mol H+ cần để trung hòa 1/3 dung dịch A là: nH+ = 0,06/3 = 0,02 mol => V = 0,02/0,1 = 0,2 (lít) = 200 ml Đáp án B Câu hỏi 7 : Hòa tan hoàn toàn m gam hỗn hợp Na, K vào nước dư thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch chứa HCl 1M và H2SO4 1M cần dùng để trung hòa hết dung dịch X là
Đáp án: D Phương pháp giải: => nOH- = 2nH2 = ? (mol) H+ + OH- → H2O nH + = nOH - = ? (mol) Mặt khác: nH+ = nHCl + 2nH2SO4 = ? (mol) => V = ? Lời giải chi tiết: nH2 = 3,36 : 22,4 = 0,15 (mol) => nOH- = 2nH2 = 0,3 (mol) H+ + OH- → H2O nH + = nOH - = 0,3 (mol) Mặt khác: nH+ = nHCl + 2nH2SO4 = V + 2V = 3V (mol) => 3V = 0,3 => V =0,1 (lít) = 100 (ml) Đáp án D Câu hỏi 8 : Cho 0,78 gam một kim loại kiềm tác dụng với nước dư sau phản ứng thu được 0,224 lít khí ở đktc. Kim loại kiềm là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 9 : Hòa tan hoàn toàn hỗn hợp gồm K và Na vào nước thu được dung dịch X và V lít khí H2 (đktc). Trung hòa X cần 200 ml dung dịch H2SO4 0,1M. Giá trị của V là
Đáp án: D Phương pháp giải: Phản ứng trung hòa: nH+ = nOH- BTNT H: nH2 = ½ nOH- Lời giải chi tiết:
Đáp án D Câu hỏi 10 : Cho 1,365 g một kim loại kiềm X tan hoàn toàn vào nước thu được một dung dịch có khối lượng lớn hơn so với khối lượng nước đã dùng là 1,33 gam. X là:
Đáp án: B Phương pháp giải: 2X + 2H2O → 2XOH + H2 1,365/X → 0,6825/X Khối lượng dung dịch sau phản ứng lớn hơn khối lượng nước đã dùng là 1,33 gam => Khối lượng dung dịch tăng m dd tăng = mKL – mH2 => X Lời giải chi tiết: 2X + 2H2O → 2XOH + H2 1,365/X → 0,6825/X Khối lượng dung dịch sau phản ứng lớn hơn khối lượng nước đã dùng là 1,33 gam => Khối lượng dung dịch tăng m dd tăng = mKL – mH2 => 1,365 - (0,6825/X).2 = 1,33 => X = 39 Vậy X là Kali (K). Đáp án B Câu hỏi 11 : Nồng độ phần trăm của dung dịch thu được khi cho 5,85 gam kali tác dụng với 162,3 gam H2O là:
Đáp án: A Phương pháp giải: Tính theo PTHH: K + H2O → KOH + 0,5 H2 Chú ý: mdd sau phản ứng = mK + mH2O - mH2 => C% KOH Lời giải chi tiết: PTHH: K + H2O → KOH + 0,5 H2 0,15→ 0,15 →0,075 (mol) mKOH = 0,15.56 = 8,4 gam mdd sau phản ứng = mK + mH2O- mH2 = 5,85 + 162,3 – 0,075.2 = 168 (gam) => C% = 8,5/168.100% = 5% Đáp án A Câu hỏi 12 : Cho hỗn hợp các kim loại kiềm Na, K tan hết vào nước được dung dịch A và 6,72 lít khí H2 (đktc). Thể tích dung dịch HCl 2 M cần để trung hòa hết một phần ba dung dịch A là
Đáp án: A Phương pháp giải: R + H2O → ROH + 0,5 H2 HS chú ý trung hòa 1/3 dung dịch A. ROH + HCl → RCl + H2O Lời giải chi tiết: R +H2O → ROH + 0,5 H2 0,6 ← 0,3 Trung hòa 1/3 dung dịch A (nROH = 0,6 : 3 = 0,2 mol) ROH + HCl → RCl +H2O 0,2 → 0,2 V dd HCl = n : CM = 0,2 : 2 = 0,1 lít = 100 ml Đáp án A Câu hỏi 13 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K và Ba vào nước thu được dung dịch Y và 8,96 lít khí H2 (đktc). Trung hòa Y cần dùng V ml dung dịch HCl 2 M. Giá trị của V là
Đáp án: A Phương pháp giải: Khi kim loại tác dụng với nước ta luôn có: nOH- = 2nH2 Phản ứng trung hòa luôn có: nH+ = nOH- Lời giải chi tiết: Khi kim loại tác dụng với nước ta luôn có: nOH- = 2nH2 = 2.0,4 = 0,8 mol Phản ứng trung hòa luôn có: nH+ = nOH- = 0,8 mol => nHCl = nH+ = 0,8 mol => V dd HCl = n : CM = 0,8 : 2 = 0,4 lít = 400 ml Đáp án A Câu hỏi 14 : Hòa tan 4,6 gam một kim loại kiềm vào 200 ml nước thu được 204,4 g một dung dịch kiềm. Kim loại đó là :
Đáp án: B Phương pháp giải: Bảo toàn khối lượng: mKL + mH2O = mdd kiềm + mH2 => mH2 = ? Viết PTHH tìm số mol → M Lời giải chi tiết: Đặt kim loại kiềm là X thì 2X + 2H2O → 2XOH + H2 Bảo toàn khối lượng có mH2 = 4,6 + 200 - 4.4 =0,2 g → nH2 = 0,1 mol →nX =0,2 → M = 46 / 0,2 =23 (Na) Đáp án B Câu hỏi 15 : Cho 1,17g một kim loại kiềm tác dụng với nước (dư). Sau phản ứng thu được 0,336 lit khí hiđro (đktc). Kim loại kiềm là (Cho Li = 7, Na = 23, Rb = 85) :
Đáp án: D Phương pháp giải: Gọi kim loại kiềm là M, tính toán theo phương trình M + H2O → MOH + 0,5H2 Lời giải chi tiết: nH2 = 0,336 : 22,4 = 0,015 mol M + H2O → MOH + 0,5H2 Mol 0,03 ← 0,015 => MM = 1,17 : 0,03 = 39 (g/mol) => M là Kali Đáp án D Câu hỏi 16 : Cho 4,6 gam Na tác dụng hoàn toàn với nước. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là
Đáp án: D Phương pháp giải: Tính chất hóa học của kim loại kiềm. Tính toán theo phương trình phản ứng Lời giải chi tiết: nNa = 4,6: 23 = 0,2 mol Na + H2O → NaOH + 0,5H2 Mol 0,2 → 0,1 => VH2 = 0,1.22,4 = 2,24 lit Đáp án D Câu hỏi 17 : Hòa tan hoàn toàn 4,6 gam Na vào 24 gam nước thu được dung dịch NaOH có nồng độ
Đáp án: B Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: nNa = 4,6: 23 = 0,2 mol - Phản ứng: Na + H2O → NaOH + 0,5H2 Mol 0,2 → 0,2 → 0,1 Bảo toàn khối lượng: mNa + mH2O = mdd + mH2 => mdd = 4,6 + 24 – 0,1.2 = 28,4g => C%NaOH = 0,2.40: 28,4 = 28,17% Đáp án B Câu hỏi 18 : Hòa tan m gam kim loại Na vào trong H2O thu được dung dịch X. Trung hòa dung dịch X cần 100 ml dung dịch H2SO4 1M. Giá trị của m là:
Đáp án: C Phương pháp giải: Tính toán theo phương trình phản ứng Lời giải chi tiết: Các phản ứng : Na + H2O → NaOH + ½ H2 2NaOH + H2SO4 → Na2SO4 + 2H2O nH2SO4 = 0,1.1 = 0,1 mol Theo các phản ứng : nNa = nNaOH = 2nH2SO4 = 0,2 mol => mNa = m = 23.0,2 = 4,6g Đáp án C Câu hỏi 19 : Cho m gam kim loại kiềm vào nước thu được 500 ml dung dịch A và 1,12 lít khí H2(đktc). Nồng độ mol/lít của dung dịch A là
Đáp án: A Phương pháp giải: Đặt kim loại kiềm là M PTHH: 2M + 2H2O → 2MOH + H2↑ → nMOH = 2nH2 =? → CM = nMOH : V =? Lời giải chi tiết: nH2(đktc) = 1,12 :22,4 = 0,05 (mol) Đặt kim loại kiềm là M 2M + 2H2O → 2MOH + H2↑ 0,1 ← 0,05 (mol) → nMOH = 2nH2 = 2.0,05 = 0,1 (mol) → CM MOH = n:V = 0,1 : 0,5 = 0,2 (M) Đáp án A Câu hỏi 20 : Hòa tan hoàn toàn 1,95 gam kim loại K vào H2O thu được 500 ml dung dịch có pH là
Đáp án: A Phương pháp giải: Đổi số mol K; nKOH = nK = ? => pOH = -log[KOH] = ? => pH = 14 - pOH =? Lời giải chi tiết: nK = 1,95 : 39 = 0,05 (mol) K + H2O → KOH + 1/2H2 0,05 → 0,05 (mol) nKOH = 0,05 (mol) → [KOH] = n : V = 0,05 : 0,5 = 0,1 → pOH = -lg[OH-] = 1 → pH = 14 - pOH = 13 Đáp án A
|













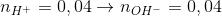
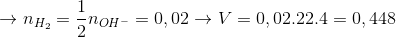 lít
lít



