40 câu hỏi lý thuyết về amoniac và muối amoni có lời giải (phần 1)Làm bàiCâu hỏi 1 : Tìm phát biểu không phù hợp với phản ứng này
Đáp án: B Phương pháp giải: Lời giải chi tiết: 92KJ là lượng nhiệt tỏa ra chứ không phải lượng nhiệt hấp thụ Đáp án B Câu hỏi 2 :
Muốn cho cân bằng của phản ứng tổng hợp amoniac chuyển dịch theo chiều thuận thì cần phải đồng thời
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ảnh hưởng của áp suất: -Khi tăng áp suất của hệ thì cân bằng chuyển dịch theo chiều giảm số mol khí -Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo chiều tăng số mol khí Trong phản ứng này là từ 4-->2 nên khi tăng áp suất cân bằng chuyển dịch theo chiều ngược lại ( sang phải) Ảnh hưởng của nhiệt độ; ∆H>0: thu nhiệt , ∆H Khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều ∆H>0 Khi nhiệt độ giảm thì cân bằng chuyển dịch theo chiều ∆H<0 Trong phản ứng này ∆H Đáp án C Câu hỏi 3 : Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
Đáp án: B Phương pháp giải: Lời giải chi tiết: A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion gốc axit C. Khí làm quì hóa xanh D. Khi nhiệt phân muối amoni chưa chắc ra khi amoniac. VD: NH4NO2 → N2 + 2H2O (t0) Đáp án B Câu hỏi 4 : Trong dung dịch amoniac là một bazơ yếu là do:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 5 : Có thể phân biệt muối amoni với các muối khác bằng cách cho nó tác dùng với dung dịch kiềm, vì khí đó:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 6 : Một nhóm học sinh chưa thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng quan sát đầy đủ và đúng nhất là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Các phản ứng xảy ra CuSO4 + 2NH3 + H2O→ Cu(OH)2 + (NH4)2SO4 Cu(OH)2 + NH3 + H2O→ [Cu(NH3)4](OH)2 Đáp án C Câu hỏi 7 : Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 8 : Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây ( các điều kiện coi như có đủ)
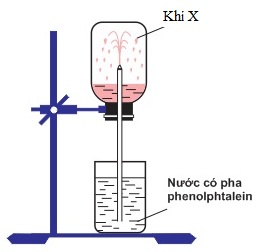
Đáp án: A Phương pháp giải: Lời giải chi tiết: A. NH3 phản ứng với tất cả các chất. B. NH3 không phản ứng với NaOH. C. NH3 không phản ứng với KOH. D. NH3 không phản ứng với KOH. Đáp án A Câu hỏi 9 : Trong phòng thí nghiệm, để thử tính chất của khí X người ta đã thực hiện thí nghiệm như hình vẽ dưới đây:
Khí X là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Dung dịch X làm phenolphtalein chuyển hồng => Dung dịch X có tính bazo => Khí X là NH3 Đáp án B Câu hỏi 10 : Có 4 dung dịch muối riêng biệt; CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư, rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 11 : Khí N2O là sản phẩm của phản ứng nhiệt phân muối nào sau đây?
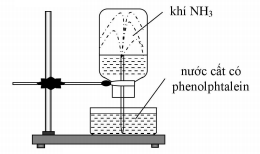
Đáp án: B Phương pháp giải: Lý thuyết về phản ứng nhiệt phân muối nitrat. Lời giải chi tiết: 2NaNO3 \(\overset{t^o}{\rightarrow}\) 2NaNO2 + O2 NH4NO3 \(\overset{t^o}{\rightarrow}\) N2O + 2H2O NH4NO3 \(\overset{t^o}{\rightarrow}\) N2 + 2H2O 2Cu(NO3)2 \(\overset{t^o}{\rightarrow}\) 2CuO + 4NO2 + O2 Đáp án B Câu hỏi 12 : Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
Đáp án: B Phương pháp giải: Dựa vào tính tan của amoniac. Lời giải chi tiết: - NH3 là khí tan tốt trong nước do đó làm áp suất trong bình thủy tinh giảm → Nước phun vào bình - NH3 tan trong nước tạo thành dung dịch có tính bazo làm phenolphtalein chuyển sang màu hồng → Nước trong bình thủy tinh có màu hồng Đáp án B Câu hỏi 13 : Cho quỳ tím vào dung dịch amoniac ta thấy
Đáp án: B Phương pháp giải: Lời giải chi tiết: Dung dịch amoniac có tính bazơ yếu nên làm quỳ tím chuyển sang màu xanh. Đáp án B Câu hỏi 14 : Phương trình để điều chế NH3 trong công nghiệp là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Phản ứng tổng hợp amoniac trong công nghiệp là: \({N_2} + 3{H_2}\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\) Đáp án: B Câu hỏi 15 : Phát biểu nào sau đây là sai về ứng dụng của amoniac?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 16 : Cho cân bằng hóa học: \({N_2} + 3{H_2}\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\) Cân bằng sẽ không chuyển dịch theo chiều thuận khi
Đáp án: C Phương pháp giải: Dựa vào nguyên lí chuyển dịch cân bằng Lơ-sa-tơ-li-e. Lời giải chi tiết: Khi giảm áp suất của hệ phản ứng thì cân bằng chuyển dịch theo chiều làm tăng số mol phân tử khí tức là chiều nghịch. Đáp án C Câu hỏi 17 : Trong phân tử NH3, nitơ có số oxi hóa là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Trong phân tử NH3, nitơ có số oxi hóa là -3. Đáp án B Câu hỏi 18 : NH3 thể hiện tính khử khi tác dụng với chất nào sau đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: NH3 thể hiện tính khử khi tác dụng với chất oxi hóa như CuO, O2, Cl2 Đáp án C Câu hỏi 19 : Phương trình để điều chế NH3 trong phòng thí nghiệm là:
Đáp án: A Phương pháp giải: Lý thuyết về amoniac. Lời giải chi tiết: Phương trình để điều chế NH3 trong phòng thí nghiệm là: \(2N{H_4}Cl + Ca{(OH)_2}\xrightarrow{{{t^o}}}CaC{l_2} + 2N{H_3} + 2{H_2}O\) Đáp án A Câu hỏi 20 : Nhận xét đúng về muối amoni trong các nhận xét dưới đây là:
Đáp án: B Phương pháp giải: Lý thuyết về muối amoni. Lời giải chi tiết: A sai muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion gốc axit. B đúng. C sai, chất khí thoát là NH3 làm quỳ tím hóa xanh. D sai, tùy từng trường hợp mà thu được khí N2, NH3 hoặc N2O. Đáp án B Câu hỏi 21 : NH3 phản ứng được với các chất nào trong các chất sau: O2; Cl2; Mg; CuO; HNO3; dd FeCl3; dd CuSO4; dd Al(NO3)3?
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của amoniac. Lời giải chi tiết: 4NH3 + 3O2 \(\xrightarrow{{{t^o}}}\) 2N2 + 6H2O 2NH3 + 3Cl2 → N2 + 6HCl 2NH3 + 3CuO \(\xrightarrow{{{t^o}}}\) 3Cu + N2 + 3H2O NH3 + HNO3 → NH4NO3 3NH3 + 3H2O + FeCl3 → Fe(OH)3 ↓ + 3NH4Cl 2NH3 + 2H2O + CuSO4 → Cu(OH)2 ↓ + (NH4)2SO4 3NH3 + 3H2O + Al(NO3)3 → Al(OH)3 ↓ + 3NH4NO3
Đáp án D Câu hỏi 22 : NH3 thể hiện tính khử khi tác dụng với chất nào sau đây?
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của amoniac. Lời giải chi tiết: - NH3 tác dụng với H2O; dd Al(NO3)3; HCl đều thể hiện tính bazơ NH3 + H2O ⇄ NH4OH 3NH3 + 3H2O + Al(NO3)3 → Al(OH)3 ↓ + 3NH4NO3 NH3 + HCl → NH4Cl - NH3 khi tác dụng với Cl2 thể hiện tính khử: 2NH3 + 3Cl2 → N2 + 6HCl Đáp án D Câu hỏi 23 : Hiện tượng hóa học xảy ra khi cho NH3 dần dần đến dư vào dung dịch AlCl3 là:
Đáp án: B Phương pháp giải: Tính chất hóa học của NH3. Lời giải chi tiết: 3NH3 + 3H2O + AlCl3 → Al(OH)3 ↓ + 3NH4Cl Dung dịch NH3 có môi trường bazơ yếu nên không hòa tan được kết tủa Al(OH)3 ⟹ Hiện tượng: thấy xuất hiện kết tủa keo trắng, kết tủa không tan khi cho dư NH3. Đáp án B Câu hỏi 24 : Cho sơ đồ chuyển hóa: \(Khi\,X\xrightarrow{{{H_2}O}}dd{\text{X}}\xrightarrow{{{H_2}S{O_4}}}Y\xrightarrow{{NaO{H_{dac}}}}Khi\,X\xrightarrow{{HN{O_3}}}Z\xrightarrow{{{t^o}}}T\) X, Y, Z, T lần lượt là:
Đáp án: B Phương pháp giải: Dựa vào tính chất hóa học của amoniac và muối amoni. Lời giải chi tiết: NH3 + H2O ⇄ NH4OH 2NH3 + H2SO4 → (NH4)2SO4 (NH4)2SO4 + 2NaOH → 2NH3 + Na2SO4 + 2H2O NH3 + HNO3 → NH4NO3 NH4NO3 \(\xrightarrow{{{t^o}}}\) N2O + 2H2O Đáp án B Câu hỏi 25 : Có các dung dịch sau: NH4NO3; (NH4)2SO4 ; K2SO4. Chỉ dùng một chất có thể phân biệt được 3 dung dịch trên là:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của muối amoni. Lời giải chi tiết: Thuốc thử có thể phân biệt 3 dung dịch trên là Ba. Cho Ba vào lần lượt 3 ống nghiệm đều thấy khí thoát ra: Ba + H2O → Ba(OH)2 + H2 ↑ + Ống có khí mùi khai bay ra (NH3) → NH4NO3 2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O + Ống có khí mùi khai bay ra (NH3) và có kết tủa trắng BaSO4 → (NH4)2SO4 (NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3↑ + 2H2O + Ống có kết tủa trắng xuất hiện → K2SO4 K2SO4 + Ba(OH)2 → BaSO4 ↓ + 2KOH Đáp án C Câu hỏi 26 : Dung dịch NH3 thể hiện tính bazơ khi tác dụng với tất cả các chất trong nhóm nào sau đây?
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của NH3. Lời giải chi tiết: A loại vì NH3 thể hiện tính khử khi phản ứng với CuO. B loại vì NH3 thể hiện tính khử khi phản ứng với O2. C loại vì NH3 thể hiện tính khử khi phản ứng với Cl2. D đúng: FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl HCl + NH3 → NH4Cl Đáp án D Câu hỏi 27 : Có thể phân biệt các dung dịch muối đựng riêng biệt: (1) NH4NO3, (2) (NH4)2SO4, (3) NaCl bằng một thuốc thử duy nhất nào sau đây?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Chọn thuốc thử là Ba(OH)2: - Khí mùi khai => NH4NO3 2NH4NO3 + Ba(OH)2 -> Ba(NO3)2 + 2NH3 + 2H2O - Khí mùi khai, kết tủa trắng => (NH4)2SO4 (NH4)2SO4 + Ba(OH)2 -> BaSO4 + 2NH3 + 2H2O - Không hiện tượng => NaCl Đáp án A Câu hỏi 28 : Hiện tượng hóa học xảy ra khi cho NH3 dần dần đến dư vào dung dịch ZnCl2 là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: - Ban đầu xuất hiện kết tủa trắng: ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 ↓ + 2NH4Cl - Sau đó, kết tủa tan dần đến hết: Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 Vậy hiện tượng của thí nghiệm là: Thấy xuất hiện kết tủa trắng, kết tủa tan dần khi cho dư NH3. Đáp án A Câu hỏi 29 : NH3 thể hiện tính khử khi tác dụng với tất cả các chất trong nhóm nào sau đây?
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của NH3. Lời giải chi tiết: A loại vì NH3 thể hiện tính bazo khi phản ứng với HCl B loại vì NH3 thể hiện tính bazo khi phản ứng với H2SO4 C đúng 2NH3 + 1,5O2 \(\overset{t^o}{\rightarrow}\) N2 + 3H2O 2NH3 + 3Cl2 → N2 + 6HCl D loại vì NH3 thể hiện tính bazo khi phản ứng với HCl, FeCl2 Đáp án C Câu hỏi 30 : Cho cân bằng hóa học: N2 (k) + 3H2 (k) \(\rightleftharpoons \) 2NH3 (k); ΔH = -92kJ (a) Thêm vào khí N2. (b) Hóa lỏng amoniac để tách amoniac ra khỏi hỗn hợp phản ứng. (c) Tăng nhiệt độ của hệ phản ứng. (d) Tăng thể tích của hệ phản ứng. Các cách thực hiện giúp cân bằng chuyển dịch theo chiều thuận là
Đáp án: A Phương pháp giải: Dựa vào lý thuyết về chuyển dịch cân bằng. Lời giải chi tiết: (a) Thêm khí N2 => CB chuyển dịch theo chiều làm giảm khí N2 => Chiều thuận (b) Tách NH3 ra khỏi hỗn hợp phản ứng => CB chuyển dịch theo chiều làm tăng NH3 => Chiều thuận (c) Tăng nhiệt độ => CB chuyển dịch theo chiều thu nhiệt => Chiều nghịch (d) Tăng thể tích của hệ phản ứng => Áp suất giảm => CB chuyển dịch theo chiều làm tăng áp suất (tăng mol khí) => Chiều nghịch Đáp án A Câu hỏi 31 : Cho dãy chất sau: Cl2; Mg; CuO; HNO3; dd CuSO4. Các chất phản ứng được với NH3 là
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của NH3. Lời giải chi tiết: Các chất phản ứng được với NH3 là: Cl2; CuO; HNO3; dd CuSO4. PTHH: 2NH3 + Cl2 → N2 + 6HCl 2NH3 + 3CuO \(\overset{t^o}{\rightarrow}\) N2 + 3Cu + 3H2O NH3 + HNO3 → NH4NO3 2NH3 + 2H2O + CuSO4 → Cu(OH)2 + (NH4)2SO4 Đáp án D Câu hỏi 32 : NH3 không có tính chất nào sau đây?
Đáp án: C Phương pháp giải: Dựa vào tính chất vật lí và hóa học của NH3. Lời giải chi tiết: C sai vì NH3 tan rất tốt trong nước. Đáp án C Câu hỏi 33 : Cho NH3 dư phản ứng với Cl2 thu được sản phẩm “khói trắng” dày đặc. Công thức hóa học của “khói trắng” là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: PTHH: 2NH3 + Cl2 → N2 + 6HCl NH3 + HCl → NH4Cl Vậy khói trắng ở đây là NH4Cl. Đáp án D Câu hỏi 34 : Thuốc thử dùng để phân biệt các muối: (NH4)2SO4, Na2SO4, NH4Cl, KOH là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: - Chọn thuốc thử là Ba(NO3)2: + Nhóm (1): Xuất hiện kết tủa trắng => (NH4)2SO4,Na2SO4 Ba2+ + SO42- → BaSO4 ↓ + Nhóm (2): Không hiện tượng => NH4Cl, KOH - Lấy từng chất của nhóm (2) cho phản ứng với từng chất của nhóm (1) Nếu có khí mùi khai sinh ra => Chất của nhóm (1) là (NH4)2SO4 và chất của nhóm (2) là KOH NH4+ + OH- → NH3 + H2O Đáp án A Câu hỏi 35 : Chất nào sau đây làm khô khí NH3 tốt nhất?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Chất làm khô phải thỏa mãn điều kiện không được phản ứng với chấn cần làm khô Đáp án C Câu hỏi 36 : Sục khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
Đáp án: D Phương pháp giải: Lời giải chi tiết: AlCl3 + 3NH3 + 3H2O -> Al(OH)3 ↓ + 3NH4Cl CuCl2 + 2NH3 + 2H2O -> Cu(OH)2 ↓ + 2NH4Cl Cu(OH)2 + 4NH3 -> [Cu(NH3)4](OH)2 (tan) Đáp án D Câu hỏi 37 : Dung dịch nào sau đây làm quỳ tím chuyển màu xanh?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Dung dịch làm quỳ tím chuyển màu xanh NH3 Đáp án D Câu hỏi 38 : Các muối nào sau đây nhiệt phân cho sản phẩm khí NH3?
Đáp án: D Phương pháp giải: Lý thuyết về phản ứng nhiệt phân muối amoni.
Lời giải chi tiết: Phản ứng nhiệt phân các muối: NH4HCO3 NH4NO2 NH4NO3 NH4Cl Đáp án D Câu hỏi 39 : Muối nào sau đây là muối amoni?
Đáp án: A Phương pháp giải: Muối amoni là muối có chứa NH4+. Lời giải chi tiết: NH4Cl là muối amoni. Đáp án A Câu hỏi 40 : Tiến hành làm thí nghiệm đun nóng muối amoni clorua trên ngọn lửa đèn cồn, để một mẫu quỳ tím ẩm gần miệng ống nghiệm. Quỳ tím sẽ chuyển thành:
Đáp án: D Phương pháp giải: Viết PTHH nhiệt phân NH4Cl, dựa vào khối lượng riêng của các khí sinh ra để nêu hiện tượng thí nghiệm. Lời giải chi tiết: NH4Cl → NH3 + HCl Vì NH3 bay hơi nhanh hơn, nhẹ hơn bay lên trước => làm quì hóa xanh Sau đó, NH3 bay hết thì HCl bay lên và làm quì tím hóa đỏ Đáp án D
|














 NH3 + H2O + CO2
NH3 + H2O + CO2

