30 câu hỏi lý thuyết về nito có lời giảiLàm bàiCâu hỏi 1 : Nhận định nào sau đây không chính xác về nitơ (N2):
Đáp án: C Phương pháp giải: Dựa vào tính chất của nito. Lời giải chi tiết: C sai vì nito là chất khí tan rất ít trong nước Đáp án C Câu hỏi 2 : Khí nitơ có thể được tạo thành phản ứng hóa học nào sau đây?
Đáp án: D Phương pháp giải: Lời giải chi tiết: A. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O B. NH4NO3 → N2O + 2H2O C. AgNO3 → Ag + NO2 + 1/2O2 D. NH4NO2 → N2 + 2H2O (t0) Đáp án D Câu hỏi 3 : Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính Oxi hóa khi tham gia phản ứng ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 4 : Tìm các tính chất không thuộc về khí nitơ? a) Hóa lỏng ở nhiệt độ rất thấp −1960C) b) Có khả năng đông nhanh c) Tan nhiều trong nước d) Nặng hơn Oxi e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 5 : Khi có sấm sét, nitơ phản ứng với oxi trong không khí thu được sản phẩm là
Đáp án: A Phương pháp giải: Tính chất hóa học của N2. Lời giải chi tiết: PTHH: N2 + O2 \(\overset{tia lua dien}{\rightarrow}\) 2NO Đáp án A Câu hỏi 6 : Trong công nghiệp, nitơ được sản xuất bằng phương pháp:
Đáp án: C Phương pháp giải: Dựa vào phương pháp điều chế khí nitơ. Lời giải chi tiết: Trong công nghiệp, sản xuất nitơ với số lượng lớn nên người ta dùng phương pháp chưng cất phân đoạn không khí lỏng. Đáp án C Câu hỏi 7 : Phương trình để điều chế N2 trong phòng thí nghiệm là:
Đáp án: A Phương pháp giải: Lý thuyết về nitơ. Lời giải chi tiết: Phương trình để điều chế N2 trong phòng thí nghiệm là: \(N{H_4}N{O_2}\xrightarrow{{{t^o}}}{N_2} \uparrow + {H_2}O\) Đáp án A Câu hỏi 8 : N2 tác dụng được với các chất nào trong số các chất sau (ở điều kiện thích hợp): H2; O2; Cl2; Mg; Li; CuO?
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của nitơ. Lời giải chi tiết: N2 tác dụng được với các chất H2; O2; Mg; Li. Các PTHH: \({N_2} + 3{H_2}\overset {t,p,xt} \leftrightarrows 2N{H_3}\) \({N_2}{\text{ }} + {\text{ }}{O_2}{\text{ }}\xrightarrow{{{{3000}^0}C}}{\text{ }}2NO\) \({N_2}{\text{ }} + {\text{ }}3Mg{\text{ }}\xrightarrow{{{t^0}}}{\text{ }}M{g_3}{N_2}\) \({N_2} + 6Li \to 2L{i_3}N\) Đáp án D Câu hỏi 9 : Cho cân bằng hóa học: \({N_2}\left( k \right) + 3{H_2}\left( k \right)\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\left( k \right);\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = - 92kJ\) (a) Thêm vào khí N2 (b) Hóa lỏng amoniac để tách amoniac ra khỏi hỗn hợp phản ứng. (c) Tăng áp suất của hệ phản ứng (d) Giảm thể tích của hệ phản ứng Các cách thực hiện giúp cân bằng chuyển dịch theo chiều thuận là
Đáp án: D Phương pháp giải: Lý thuyết về chuyển dịch cân bằng. Lời giải chi tiết: (a) Thêm N2 → cân bằng sẽ chuyển dịch theo chiều giảm lượng N2 → chiều thuận (b) Tách NH3 ra khỏi hỗn hợp → cân bằng chuyển dịch theo chiều tăng lượng NH3 → chiều thuận (c) Tăng áp suất → cân bằng chuyển dịch theo chiều giảm áp suất của hệ (tức giảm số mol khí) → chiều thuận (d) Giảm thể tích của hệ → cân bằng chuyển dịch theo chiều tăng thể tích của hệ (tức tăng số mol khí) → chiều nghịch Đáp án D Câu hỏi 10 : Cho phản ứng hóa học: NO2 + NaOH → NaNO2 + NaNO3 + H2O. Trong phản ứng trên, NO2 đóng vai trò là:
Đáp án: D Phương pháp giải: Xét sự thay đổi số oxi hóa của N+4 (NO2): + Nhường e => chất khử + Nhận e => chất oxh Lời giải chi tiết: Ta thấy: N+4 + 1e → N+3 (NaNO2) N+4 - 1e → N+5 (NaNO3) => NO2 vừa nhường vừa nhận e nên vừa là chất oxi hóa vừa là chất khử Đáp án D Câu hỏi 11 : Ứng dụng nào sau đây không phải của nitơ ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 12 : Trong không khí chứa nhiều nhất chất khí nào sau đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Không khí chiếm khoảng 78% N2 , 21% O2 và 1% còn lại là các khí khác Đáp án C Câu hỏi 13 : Liên kết trong phân tử N2 là liên kết
Đáp án: B Phương pháp giải: HS cần nắm được tính chất vật lí của N2. - Trạng thái: khí - Màu: không màu - Mùi vị: không vị - Tan trong nước: ít - Không độc nhưng không duy trì sự sống. Lời giải chi tiết: Hướng dẫn giải N ≡ N Liên kết trong phân tử N2 là liên kết cộng hóa trị không cực (do 2 nguyên tử nitơ có độ âm điện như nhau). Đáp án B. Câu hỏi 14 : Nhận định nào sau đây đúng: 1. N2 là chất khí, không màu , không mùi, không vị. 2. N2 dễ tan trong nước tạo dung dịch axit. 3. N2 có tính độc. 4. N2 không duy trì sự sống.
Đáp án: A Phương pháp giải: Phương pháp: HS cần nắm được tính chất vật lí của N2. - Trạng thái: khí - Màu: không màu - Mùi vị: không vị - Tan trong nước: ít - Không độc nhưng không duy trì sự sống. Lời giải chi tiết:
Hướng dẫn giải 1. N2 là chất khí, không màu , không mùi không vị => đúng 2. N2 dễ tan trong nước tạo dung dịch axit=> Sai. Nitơ tan rất ít trong nước 3. N2 có tính độc => sai. Nitơ không độc 4. N2 không duy trì sự sống => đúng Đáp án A. Câu hỏi 15 : Tại sao khí N2 lại trơ ở điều kiện thường?
Đáp án: A Phương pháp giải: Phương pháp: Những chất có liên kết ba trong phân tử đều tương đối bền do năng lượng liên kết lớn. Lời giải chi tiết:
Hướng dẫn giải N ≡ N Vì có liên kết ba với năng lượng liên kết lớn (E= 946kJ/mol) nên phân tử nitơ rất bền. Ở điều kiện thường, nitơ khá trơ về mặt hóa học. Đáp án A. Câu hỏi 16 : Phản ứng nào sau đây thể hiện tính khử của N2?
Đáp án: B Phương pháp giải: Phương pháp: - Xác định số oxi hóa của N trong các phản ứng, phản ứng nào số oxi hóa của N tăng => thể hiện tính khử. Lời giải chi tiết:
Hướng dẫn giải: A. B. C. D. Đáp án B. Câu hỏi 17 : Vị trí của nitơ (N) trong bảng hệ thống tuần hoàn là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 18 : Chất nào sau đây được điều chế trong công nghiệp bằng phương pháp chưng cất phân đoạn không khí lỏng?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Không khí hóa lỏng sau đó nâng dần nhiệt độ ở -1960C ta thu được khí nito, ở -1830C ta thu được khí oxi Đáp án A Câu hỏi 19 : Kim loại nào sau đây tác dụng với khí nitơ ở ngay nhiệt độ thường?
Đáp án: C Phương pháp giải: Ghi nhớ tính chất hóa học của Nitơ Lời giải chi tiết: Nitơ tác dụng với kim loại Li ở nhiệt độ thường, còn tất cả các kim loại còn lại cần có nhiệt độ 6Li + 3N2 → 2Li3N Đáp án C Câu hỏi 20 : Để điều chế một lượng nhỏ nitơ trong phòng thí nghiệm ta cần đun nóng hỗn hợp dung dịch bão hòa các muối:
Đáp án: C Phương pháp giải: Dựa vào phương pháp điều chế N2 trong phòng thí nghiệm. Lời giải chi tiết: Trong phòng thí nghiệm, người ta điều chế N2 bằng cách đun nóng dung dịch NaNO2 và NH4Cl: NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O Đáp án C Câu hỏi 21 : Hợp chất nào sau đây N có số oxi hóa +5?
Đáp án: B Phương pháp giải: Xác định số oxh của N trong từng hợp chất, hợp chất nào có số oxh +5 thì chọn Lời giải chi tiết: \(\eqalign{ Đáp án B Câu hỏi 22 : Hiện tượng mưa axit chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là:
Đáp án: C Phương pháp giải: dựa vào kiến thức hiểu biết thực tế với môi trường. Lời giải chi tiết: SO2 và NO2 là hai khí chính gây ra hiện tượng mưa axit do SO2 + H2O \(\underset{{}}{\overset{{}}{\longleftrightarrow}}\) H2SO3 NO2 + O2 + H2O → HNO3 Các khí này tạo ra các axit, có tính oxi hóa gây ra nhiều hư hại tổn thất cho cuộc sống Đáp án C Câu hỏi 23 : Cho X là oxit của nito, là chất khí ở điều kiện thường, có màu nâu đỏ. X là
Đáp án: D Phương pháp giải: Dựa vào màu sắc của oxit để đoán ra được oxit đó Lời giải chi tiết: NO2 là chất khí có màu nâu đỏ ở điều kiện thường Đáp án D Câu hỏi 24 : Nhận xét nào về N2 là sai?
Đáp án: C Phương pháp giải: Lời giải chi tiết: - A, B, D đúng - C sai vì N2 tan rất ít trong nước Đáp án C Câu hỏi 25 : Cho các phản ứng sau: (1) N2 + O2 \(\overset{3000^{o}}{\rightarrow}\) 2NO (2) N2 + 3H2 \(\rightleftharpoons \) 2NH3 Trong hai phản ứng trên thì nitơ
Đáp án: B Phương pháp giải: Chất khử là chất nhường electron nên số oxi hóa tăng Chất oxi hóa là chất nhận electron nên số oxi hóa giảm Lời giải chi tiết: (1) nitơ thể hiện tính khử vì số oxi hóa của N tăng N0 → N+2 (2) nitơ thể hiện tính oxi hóa vì số oxi hóa của N giảm N0 → N-3 Đáp án B Câu hỏi 26 : Phát biểu nào sau đây đúng ?
Đáp án: C Phương pháp giải: Lý thuyết về nito. Lời giải chi tiết: A sai vì N2 thể hiện tính oxi hóa N0 → N-3 B sai vì nitơ không phải khí độc C đúng D sai vì sản phẩm tạo ra là NO Đáp án C Câu hỏi 27 : Chọn câu trả lời đúng. Trong các phản ứng oxi hóa - khử, nitơ
Đáp án: D Phương pháp giải: Dựa vào số oxi hóa của nguyên tử N trong phân tử N2 để đánh giá tính chất oxi hóa - khử của N2 trong các phản ứng hóa học. + Nếu số oxi hóa có thể tăng → Thể hiện tính khử + Nếu số oxi hóa có thể giảm → Thể hiện tính oxi hóa Lời giải chi tiết: Nguyên tử N trong phân tử N2 có số oxi hóa 0 là số oxi hóa trung gian nên vừa có thể tăng lên +1, +3, +5, +7 và giảm xuống -3. Do đó trong các phản ứng hóa học thì N2 thể hiện tính khử hoặc tính oxi hóa. Đáp án D Câu hỏi 28 : Trong những nhận xét dưới đây, nhận xét nào đúng?
Đáp án: A Phương pháp giải: Lý thuyết tổng hợp về nitơ và các hợp chất của nitơ. Lời giải chi tiết: - Số oxi hóa của nitơ trong các hợp chất và ion NO, NH4+, NO3- lần lượt là +2, -3, +5. → Đúng - Nitơ thể hiện tính khử khi tác dụng với khí H2 ở nhiệt độ, áp suất, xúc tác thích hợp. → Sai, N2 phản ứng với H2 tạo NH3 có số oxi hóa giảm từ 0 xuống -3 nên N2 thể hiện tính oxi hóa. - Ở điều kiện thường, đơn chất N2 hoạt động hóa học hơn photpho. → Sai, đơn chất N2 có liên kết ba rất bền nên khá trơ về mặt hóa học. - Khí nitơ duy trì sự hô hấp và sự cháy. → Sai, khí duy trì sự hô hấp và sự cháy là O2. Đáp án A Câu hỏi 29 : Cặp công thức của Litinitrua và nhôm nitrua là:
Đáp án: A Phương pháp giải: Trong hợp chất với kim loại, N thể hiện số oxi hóa -3 Lời giải chi tiết: Công thức của litinitrua là Li3N Công thức của nhôm nitrua là AlN Đáp án A Câu hỏi 30 : Khí X được sinh ra dưới tác dụng của sấm sét (hoặc tia lửa điện). Khí X là khí không màu ở điều kiện thường, dễ dàng hóa nâu trong không khí tạo thành khí Y. Công thức hóa học của khí Y là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B |













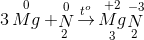 => tính oxi hóa
=> tính oxi hóa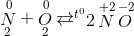 => tính khử
=> tính khử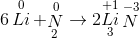 => tính oxi hóa
=> tính oxi hóa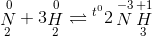 => tính oxi hóa
=> tính oxi hóa