30 bài tập CO2 tác dụng với Ca(OH)2; Ba(OH)2 có lời giảiLàm bàiCâu hỏi 1 : Hấp thụ hoàn toàn 3,36 lít (đktc) CO2 vào 500ml dung dịch nước vôi trong nồng độ 0,2M. Sau khi gạn bỏ kết tủa thu được dung dịch X. Khối lượng dung dịch X so với khối lượng nước vôi trong ban đầu
Đáp án: B Phương pháp giải: Bài toán CO2 + dung dịch kiềm Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư =>nCO3 = nCO2 +) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- =>nCO3 = nOH – nCO2 +) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-. =>nHCO3 = nOH Lời giải chi tiết: nCO2 = 0,15 mol ; nCa(OH)2 = 0,1 mol => nOH = 0,2 mol nOH-/nCO2=0,2/0,15=1,33 =>Tạo muối CaCO3 x mol và muối Ca(HCO3)2 y mol x+y=nCa=0,1 x+2y=nCO2=0,15 =>x=0,05; y=0,05 => m=0,15.44-0,05.100=+1,6>0 Vậy khối lượng dung dịch tăng 1,6 gam Đáp án B Câu hỏi 2 : Dẫn 8,96 lít khí CO2 (ở đktc) vào 600 ml dung dịch Ca(OH)2 0,5 M. Phản ứng kết thúc thu được m gam kết tủA. Giá trị của m là
Đáp án: B Phương pháp giải: Đặt Nếu a ≤ 1 => Tạo muối HCO3- và dư CO2 Nếu 1 < a < 2 => Tạo muối CO32- và muối HCO3- nHCO3- = (2 -a).nCO2 nCO32- = (a - 1).nCO2 nếu a ≥ 2 chỉ tạo muối CO32- Lời giải chi tiết: Số mol CO2 là 0,4 mol Số mol Ca(OH)2 là 0,3 mol Ta có Bảo toàn số mol C ta có Bảo toàn điện tích ta có Giải được CO32- : 0,2 mol → CaCO3: 0,2 mol → m=20g Đáp án B Câu hỏi 3 : Thổi V lít (đktc) khí CO2 vào 300 ml dung dịch Ca(OH)2 0,02M thì thu được 0,2 gam kết tủa. Giá trị của V là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 4 : Sục 6,72 lit khí CO2 (dktc) vào 400 ml dung dịch Ca(OH)2 aM. Sau phản ứng xảy ra hoàn toàn thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch NaOH 1M đến khi kết tủa thu được lớn nhất thì đã dùng 120 ml. Giá trị của a là :
Đáp án: C Phương pháp giải: Phương pháp : bài toán CO2 tác dụng với dd kiềm
Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư => nCO3 = nCO2 +) TH2 : nCO2 < nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- => nCO3 = nOH – nCO2 +) TH3 : nCO2 > nOH => CO dư => sinh ra muối HCO3-. => nHCO3 = nOH Lời giải chi tiết:
Lời giải : nCO2 = 0,3 mol ; nOH = 0,8a ; nCa = 0,4a nNaOH = 0,12 mol khi kết tủa max => Ban đầu có HCO3- nCaCO3 = 0,4a mol => 2nCO2 = 2nCa(OH)2 + nNaOH => 2.0,3 = 0,8a + 0,12 => a = 0,6M Đáp án C Câu hỏi 5 : Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta được kết quả như hĩnh vẽ :
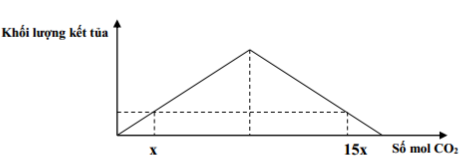
Giá trị của X là :
Đáp án: C Phương pháp giải: Phương pháp : bài toán CO2 tác dụng với dd kiềm
Công thức giải nhanh : +) TH1 : nOH ≥ 2.nCO2 => OH- dư => nCO3 = nCO2 +) TH2 : nCO2 < nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3- => nCO3 = nOH – nCO2 +) TH3 : nCO2 > nOH => CO dư => sinh ra muối HCO3-. => nHCO3 = nOH Lời giải chi tiết:
Lời giải : Dựa vào đồ thị ta có : nCa(OH)2 = a = 0,1 mol ; nNaOH = a + 0,5 – a = 0,5 mol Tại thời điểm nCO2 = x thì sản phẩm có cả muối trung hòa và muối axit => nkết tủa = nCO3 = nOH – nCO2 => nCO2 = x = nOH – nCO3 = 0,1.2 + 0,5 – 0,06 = 0,64 mol Đáp án C Câu hỏi 6 : Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là
Đáp án: A Phương pháp giải: Lời giải chi tiết: nCO2 = 0,12; nBaCO3 = 0,08 → Ba(HCO3)2 = 0,02 (BT.C) → a = (0,08+0,02) :2,5 = 0,04 (BT.Ba) Đáp án A Câu hỏi 7 : Hòa tan hoàn toàn 11,2 gam CaO và H2O dư thu được dung dịch X. Sục từ từ khí CO2 vào dung dịch X, qua quá trình khảo sát người ta lập được đồ thị như sau:
Giá trị của x là:
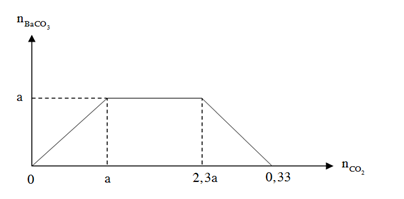
Đáp án: A Phương pháp giải: - Bài toán cho CO2 hấp thụ vào dd Ca(OH)2 tại 2 số mol CO2 khác nhau cùng thu được 1 lượng kết tủa sẽ xảy ra 2 trường hợp sau: +TH1: Lượng CO2 ít, chỉ xảy ra pư tạo muối trung hòa. Tính toán theo nCO2 Ca(OH)2 + CO2 → CaCO3 + H2O +TH2: Lượng CO2 nhiều => tạo muối trung hòa, sau đó muối bị hòa tan 1 phần. CO2 và Ca(OH)2 đều pư hết Ca(OH)2 + CO2 → CaCO3 + H2O Ca(OH)2 + 2CO2 → Ca(HCO3)2 Tính toán theo nCO2 và nCaCO3 Lời giải chi tiết: CaO + H2O → Ca(OH)2 => nCa(OH)2 = nCaO = 11,2 : 56 = 0,2 (mol) Từ đồ thị ta thấy: + Tại thời điểm số mol CO2 bằng x và 1,5x thu được lượng kết tủa như nhau => TH1: nCO2 = x ( mol) xảy ra trường hợp chỉ tạo muối trung hòa, CO2 hết, Ca(OH)2 dư. Tính toán theo số mol CO2 Ca(OH)2 + CO2 → CaCO3 + H2O x → x (mol) TH2: nCO2 = 1,5x (mol) xảy ra trường hợp tạo 2 muối, CO2 và Ca(OH)2 đều phản ứng hết. Lượng CaCO3 thu được bằng với TH1 Ca(OH)2 + CO2 → CaCO3 + H2O x ← x ← x Ca(OH)2 + 2CO2 → Ca(HCO3)2 7x ←(15x – x) ∑ nCa(OH)2 = x + 7x = 0,2 (mol) => x = 0,025 (mol) Đáp án A Câu hỏi 8 : Sục V lít khí CO2 (đktc) vào dung dịch chứa hỗn hợp Ba(OH)2 và KOH, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
Giá trị của V bằng bao nhiêu để thu được kết tủa cực đại?
Đáp án: C Phương pháp giải: Nhìn vào đồ thị ta chia làm 3 giai đoạn Giai đoạn 1: Đồ thị đi lên là xảy ra phản ứng CO2 + Ba(OH)2→ BaCO3↓ + H2O Giai đoạn 2: Đồ thị đi ngang là do xảy ra phản ứng CO2 + 2KOH → K2CO3 + H2O CO2 + K2CO3 + H2O → 2KHCO3 Giai đoạn 3: Đồ thị đi xuống là do xảy ra phản ứng CO2 + BaCO3 ↓ + H2O → Ba(HCO3)2 Vì đồ thị có tính chất đối xứng, giai đoạn đi lên cần bao nhiêu lượng CO2 để tạo kết tủa cực đại thì giai đoạn đi xuống cũng lượng CO2 như vậy => a =? Lời giải chi tiết: Nhìn vào đồ thị ta chia làm 3 giai đoạn Giai đoạn 1: Đồ thị đi lên là xảy ra phản ứng CO2 + Ba(OH)2→ BaCO3↓ + H2O Giai đoạn 2: Đồ thị đi ngang là do xảy ra phản ứng CO2 + 2KOH → K2CO3 + H2O CO2 + K2CO3 + H2O → 2KHCO3 Giai đoạn 3: Đồ thị đi xuống là do xảy ra phản ứng CO2 + BaCO3 ↓ + H2O → Ba(HCO3)2 Vì đồ thị có tính chất đối xứng, giai đoạn đi lên cần bao nhiêu lượng CO2 để tạo kết tủa cực đại thì giai đoạn đi xuống cũng lượng CO2 như vậy => 0,33 – 2,3a = a => a = 0,1 (mol) Từ đồ thị để kết tủa cực đại thì a < nCO2 < 2,3a => 0,1.22,4 < VCO2 < 2,3. 0,1. 22,4 => 2,24 < VCO2 < 5,152 Đáp án C Câu hỏi 9 : Sục 2,688 lít CO2 (đktc) và 150 ml dung dịch Ca(OH)2 1M và KOH 0,5M. Khối lượng kết tủa thu được sau khi phản ứng xảy ra hoàn toàn là:
Đáp án: C Phương pháp giải: Tính tỉ lệ: a = nOH-/nCO2 + a ≤ 1: chỉ tạo muối HCO3- + 1 < a < 2: tạo 2 muối HCO3- và CO32- + a ≥ 2: chỉ tạo muối CO32- Lời giải chi tiết: nCO2 = 0,12 mol; nCa(OH)2 = 0,15 mol; nKOH= 0,075 mol nOH- = 2nCa(OH)2 + nKOH = 0,375 mol => nOH-/nCO2 = 0,375/0,12 = 3,125 > 2 => Tạo muối trung hòa CO32- CO2 + 2OH- → CO3 2- + H2O 0,12→0,24→ 0,12 => nCaCO3 = 0,12 mol => m↓ = 12 gam Đáp án C Câu hỏi 10 : Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,15 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là
Đáp án: D Phương pháp giải: nOH-/nCO2 = a + a≤1 chỉ tạo muối HCO3- + 1<a<2: tạo hai muối HCO3-, CO32- + a≥2: tạo muối CO32- Lời giải chi tiết: nCO2 = 0,15 mol nOH- = 0,15 + 0,15.2 = 0,45 mol nOH-/nCO2 = 0,45/0,15 = 3 > 2 => Chỉ tạo muối CO32- nCO32- = nCO2 = 0,15 mol => nBaCO3 = 0,15 mol => m = 197.0,15 = 29,55 gam Đáp án D Câu hỏi 11 : Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là
Đáp án: A Phương pháp giải: Tính tỉ lệ nOH-/nCO2=a + a ≤ 1 => tạo muối axit + 1 < a < 2 => tạo hai muối + a ≥ 2 => tạo muối trung hòa Lời giải chi tiết:
Câu hỏi 12 : Cho 0,448 lít khí CO2 (đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12 M thu được m gam kết tủa. giá trị của m là
Đáp án: C Phương pháp giải: Phương pháp : Đặt Nếu a ≤ 1 => Tạo muối HCO3- và dư CO2 Nếu 1 < a < 2 => Tạo muối CO32- và muối HCO3- nHCO3- = (2 -a).nCO2 nCO32- = (a - 1).nCO2 nếu a ≥ 2 chỉ tạo muối CO32- Bảo toàn C và bảo toàn điện tích để tính từng muối tạo ra Lời giải chi tiết:
Hướng dẫn giải : nCO2 = 0,02 mol nOH- = 0,1.0,06 + 0,12.2,0,1 = 0,03 mol
Bảo toàn C thì x + y = nCO2 =0,02 mol Bảo toàn điện tích 2x + y = nNa+ + 2nBa2+ = 0,006 + 0,024=0,03 mol Nên x =0,01 mol, y=0,01 mol→ ↓ BaCO3 = 0,01 mol ( vì nBa2+ > nCO3) → mBaCO3 =1,97 Đáp án C Câu hỏi 13 : Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2 thu được m gam kết tủa. Giá trị của m là
Đáp án: D Phương pháp giải: nCO2 = 0,15 mol nOH = 0,15 +0,1.2 =0,35
CO32- + Ba2+ → BaCO3 → có 0,1 mol BaCO3 Lời giải chi tiết: nCO2 = 0,15 mol nOH = 0,15 +0,1.2 =0,35 CO32- + Ba2+ → BaCO3 → có 0,1 mol BaCO3 →mkết tủa = 19,7 Chọn D Câu hỏi 14 : Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 160ml dung dịch hỗn hợp: Ba(OH)2 0,5M và NaOH 0,5M. Sau phản ứng thu được dung dịch X và kết tủa Y. Nhỏ từ từ tới hết dung dịch HCl 2M vào X, tới khi bắt đầu thoát ra khí thì dừng lại thì thấy đã dùng V ml. Giá trị của V là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 15 : Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là
Đáp án: A Phương pháp giải: Tính tỉ lệ nOH-/nCO2=a + a ≤ 1 => tạo muối axit + 1 < a < 2 => tạo hai muối + a ≥ 2 => tạo muối trung hòa Lời giải chi tiết: \(\begin{gathered} Đáp án A Câu hỏi 16 : Cho 4,48 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH 1M và Ba(OH)2 1M, thu được m gam kết tủa. Giá trị của m là
Đáp án: D Phương pháp giải: Ta thấy: \(1 < {{{n_{O{H^ - }}}} \over {{n_{C{O_2}}}}} = {{0,3} \over {0,2}} = 1,5 < 2\) => Tạo 2 muối CO2 + OH- → HCO3- CO2 + 2OH- → CO32- + H2O \(\left\{ \matrix{ Ba2+ + CO32- → BaCO3↓ => mBaCO3 = m↓ = ? (g) Lời giải chi tiết: nCO2 = 4,48 : 22,4 = 0,2 (mol) nNaOH = 0,1 (mol); nBa(OH)2 = 0,1 (mol) => ∑ nOH - = 0,1 + 0,1.2 = 0,3 (mol) Ta thấy: \(1 < {{{n_{O{H^ - }}}} \over {{n_{C{O_2}}}}} = {{0,3} \over {0,2}} = 1,5 < 2\) => Tạo 2 muối CO2 + OH- → HCO3- CO2 + 2OH- → CO32- + H2O \(\left\{ \matrix{ Ba2+ + CO32- → BaCO3↓ 0,1 0,1 0,1 (mol) => mBaCO3 = m↓ = 0,1. 197 = 19,7 (g) Đáp án D Câu hỏi 17 : Cho 0,14 mol CO2 hấp thụ hết vào dung dịch chứa 0,11 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng giảm bao nhiêu so với dung dịch Ca(OH)2 ban đầu?
Đáp án: A Phương pháp giải: Bài toán CO2 tác dụng với dung dịch kiềm: Tính tỉ lệ: \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}}(*)\) + (*) ≥ 2 => Chỉ tạo muối CO32- + 1 < (*) < 2 => Tạo muối CO32- và HCO3- + (*) ≤ 1 => Chỉ tạo muối HCO3- => m dung dịch giảm = mCaCO3 – mCO2 Lời giải chi tiết: nOH- = 2nCa(OH)2 = 0,22 mol; nCO2 = 0,14 mol => 1 < nOH- / nCO2 = 0,22/0,14 = 1,57 < 2 => Tạo muối CO32- và HCO3- Đặt số mol CaCO3 và Ca(HCO3)2 lần lượt là x, y mol BTNT “C”: nCO2 = x + 2y = 0,14 (1) BTNT “Ca”: nCa(OH)2 = x + y = 0,11 (2) Giải (1) và (2) thu được x = 0,08 và y = 0,03 Khối lượng dung dịch giảm là mdung dịch giảm = mCaCO3- mCO2 = 0,08.100 – 0,14.44 = 1,84 gam Đáp án A Câu hỏi 18 : Hấp thụ hết 0,672 lít khí CO2 (đktc) vào bình chứa 2 lít dung dịch Ca(OH)2 0,01M. Thêm tiếp 0,4 gam NaOH vào bình này, sau khi các phản ứng xảy ra hoàn toàn thu được số gam kết tủa là:
Đáp án: B Phương pháp giải: Coi như sục CO2 vào hỗn hợp Ca(OH)2 và NaOH Bài toán CO2 tác dụng với dung dịch kiềm: Tính tỉ lệ: \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}}(*)\) + (*) ≥ 2 => Chỉ tạo muối CO32- + 1 < (*) < 2 => Tạo muối CO32- và HCO3- + (*) ≤ 1 => Chỉ tạo muối HCO3- Tính được nCO32-. So sánh nCO32- và nCa2+ suy ra số mol CaCO3 Lời giải chi tiết: nOH- = 2nCa(OH)2 + nNaOH = 2.0,02 + 0,01 = 0,05 mol nCO2 = 0,03 mol 1 < nOH- : nCO2 = 0,05 : 0,03 = 1,67 < 2 => Tạo muối CO32- và HCO3- Đặt nCO32- = x và nHCO3- = y (mol) BTNT “C”: nCO2 = nCO32- + nHCO3- => x + 2y = 0,03 (1) BTĐT: 2nCO32- + nHCO3- = 2nCa2+ + nNa+ => 2x + y = 0,02.2 + 0,01 (2) Giải (1) và (2) được x = 0,02 và y = 0,01 nCa2+ = nCO32- = 0,02 mol => nCaCO3 = 0,02 mol => mCaCO3 = 2 gam Đáp án B Câu hỏi 19 : Khi cho 0,05 mol hoặc 0,35 mol CO2 hấp thụ hoàn toàn vào dung dịch chứa a mol Ca(OH)2 đều thu được cùng một lượng kết tủa. Giá trị của a là:
Đáp án: B Phương pháp giải: Với số mol CO2 khác nhau mà thu được cùng khối lượng kết tủa chứng tỏ khi nCO2 = 0,05 mol thì kết tủa chưa bị hòa tan; còn khi nCO2 = 0,35 mol thì kết tủa bị hòa tan một phần: Lời giải chi tiết: Với số mol CO2 khác nhau mà thu được cừng khối lượng kết tủa chứng tỏ khi nCO2 = 0,05 mol thì kết tủa chưa bị hòa tan; còn khi nCO2 = 0,35 mol thì kết tủa bị hòa tan một phần: - Khi nCO2 = 0,05 mol: CO2 phản ứng hết, Ca(OH)2 dư CO2 + Ca(OH)2 → CaCO3 ↓ + H2O 0,05 → 0,05 → 0,05 mol - Khi nCO2 = 0,35 mol: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O 0,05 ← 0,05 ← 0,05 2CO2 + Ca(OH)2 → Ca(HCO3)2 (0,35- 0,05) → 0,15 Vậy a = 0,05 + 0,15 = 0,2 mol Đáp án B Câu hỏi 20 : Hấp thụ hoàn toàn V lít khí CO2 (đktc) vào 1,5 lít dung dịch Ba(OH)2 0,1M được 19,7 gam kết tủa. Giá trị lớn nhất của V là:
Đáp án: C Phương pháp giải: Do cần tìm giá trị lớn nhất của V nên xảy ra các phương trình sau: CO2 + Ba(OH)2 → BaCO3 ↓ + H2O 2CO2 + Ba(OH)2 → Ba(HCO3)2 → tổng số mol CO2 → VCO2 Lời giải chi tiết: Ta có: nBa(OH)2 = 1,5. 0,1 = 0,15 mol; nBaCO3 = 19,7 : 197 = 0,1 mol Do cần tìm giá trị lớn nhất của V nên xảy ra các phương trình sau: CO2 + Ba(OH)2 → BaCO3 ↓ + H2O 0,1 0,1 ← 0,1 mol 2CO2 + Ba(OH)2 → Ba(HCO3)2 0,1← (0,15- 0,1) mol Vậy tổng số mol CO2 là 0,1 + 0,1 = 0,2 mol → VCO2 = 0,2.22,4 = 4,48 lít Đáp án C Câu hỏi 21 : Hấp thụ hoàn toàn 3,36 lít khí CO2 ở đktc vào 100 ml dung dịch Ca(OH)2 1M thu được m gam kết tủa.Giá trị của m là ?
Đáp án: D Phương pháp giải: Ta có: \(1 < {{{n_{C{O_2}}}} \over {{n_{Ca{{(OH)}_2}}}}} = {{0,15} \over {0,1}} = 1,5 < 2\) => Tạo 2 muối CaCO3 và Ca(HCO3)2 cả CO2 và Ca(OH)2 đều phản ứng hết CO2 + Ca(OH)2 → CaCO3↓ + H2O a ← a ← a (mol) 2CO2 + Ca(HCO3)2 → Ca(HCO3)2 2b ← b ← b (mol) Ta có: \(\left\{ \matrix{ Lời giải chi tiết: nCO2 = 3,36 :22,4 = 0,15 (mol) ; nCa(OH)2 = 0,1.1 = 0,1 (mol) Ta có: \(1 < {{{n_{C{O_2}}}} \over {{n_{Ca{{(OH)}_2}}}}} = {{0,15} \over {0,1}} = 1,5 < 2\) => Tạo 2 muối CaCO3 và Ca(HCO3)2 cả CO2 và Ca(OH)2 đều phản ứng hết CO2 + Ca(OH)2 → CaCO3↓ + H2O a ← a ← a (mol) 2CO2 + Ca(HCO3)2 → Ca(HCO3)2 2b ← b ← b (mol) Ta có: \(\left\{ \matrix{ => mCaCO3 = 0,05.100 = 5 (g) Đáp án D Câu hỏi 22 : Hấp thụ hoàn toàn 0,896 lít CO2 vào 3 lít dung dịch Ca(OH)2 0,01M thu được m gam kết tủa. Giá trị của m là
Đáp án: C Phương pháp giải: Ta có: \(1 < {{{n_{C{O_2}}}} \over {{n_{Ca{{(OH)}_2}}}}} = {{0,04} \over {0,03}} = {4 \over 3} \approx 1,33 < 2\) => Tạo thành 2 muối CaCO3 và Ca(HCO3)2. Cả CO2 và Ca(OH)2 đều phản ứng hết CO2 + Ca(OH)2 → CaCO3↓ + H2O a ← a ← a (mol) CO2 + Ca(OH)2 → Ca(HCO3)2 2b ← b ← b (mol) Ta có hệ phương trình \(\left\{ \matrix{ Từ đó tính được khối lượng kết tủa Lời giải chi tiết: nCO2(đktc) = 0,896 :22,4 = 0,04 (mol) ; nCa(OH)2 = 3.0,01 = 0,03 (mol) Ta có: \(1 < {{{n_{C{O_2}}}} \over {{n_{Ca{{(OH)}_2}}}}} = {{0,04} \over {0,03}} = {4 \over 3} \approx 1,33 < 2\) => Tạo thành 2 muối CaCO3 và Ca(HCO3)2. Cả CO2 và Ca(OH)2 đều phản ứng hết CO2 + Ca(OH)2 → CaCO3↓ + H2O a ← a ← a (mol) CO2 + Ca(OH)2 → Ca(HCO3)2 2b ← b ← b (mol) Ta có hệ phương trình \(\left\{ \matrix{ => mCaCO3 = 0,02.100 = 2 (g) Đáp án C Câu hỏi 23 : Cho 5,6 lít CO2 đktc hấp thụ hết vào 500 ml dung dịch hỗn hợp NaOH 0,15 M và Ba(OH)2 0,3 M, thu được m gam kết tủa. Giá trị của m là
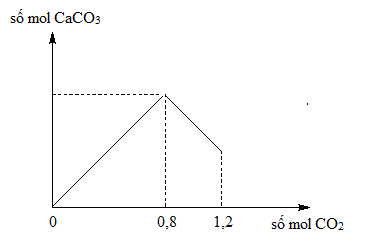
Đáp án: C Phương pháp giải: Đặt Nếu a ≤ 1 => Tạo muối HCO3- và dư CO2 Nếu 1 < a < 2 => Tạo muối CO32- và muối HCO3- Ba2+ + CO32- → BaCO3 Lời giải chi tiết: Hướng dẫn giải : nCO2 = 0,25 mol nOH- = 0,5.0,15 + 0,3.2.0,5 = 0,375 mol Bảo toàn C có 0,25 = x + y Bảo toàn điện tích có x + 2y = 0,5.0,15 + 0,5.0,3.2 → x = y = 0,125 mol Ba2+ + CO32- → BaCO3 →nBaCO3 = 0,125.197=24,625 g Chọn C Câu hỏi 24 : Sục CO2 vào 200 gam dung dịch Ca(OH)2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau : Nồng độ % chất tan trong dung dịch sau phản ứng là
Đáp án: A Phương pháp giải: Tại thời điểm kết tủa lớn nhất Ca(OH)2 + CO2 → CaCO3 + H2O → nCa(OH)2 = nCO2 = 0,8 mol Tại thời điểm CO2 : 1,2 mol thì sinh ra thêm phản ứng sau CaCO3 + CO2 + H2O → Ca(HCO3)2 Lời giải chi tiết: Tại thời điểm kết tủa lớn nhất Ca(OH)2 + CO2 → CaCO3 + H2O → nCa(OH)2 = nCO2 = 0,8 mol Tại thời điểm CO2 : 1,2 mol thì CaCO3 + CO2 + H2O → Ca(HCO3)2 Ban đầu : 0,8 mol 0,4 Sau Pư 0,4 0 0,4 Bảo toàn khối lượng mdd sau pư = 1,2.44 + 200 – 0,4 .100 =212,8 gam \( \to \% Ca{(HC{O_3})_2} = \frac{{0,4.162}}{{212,8}}.100\% = 30,45\% \) Đáp án A Câu hỏi 25 : Hấp thụ hoàn toàn a mol khí CO2 vào dung dịch chứa b mol Ca(OH)2 thì thu được hỗn hợp 2 muối CaCO3 và Ca(HCO3)2. Quan hệ giữa a và b là
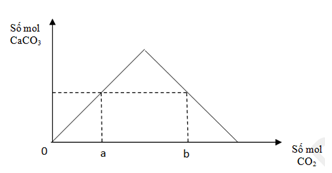
Đáp án: A Phương pháp giải: Thu được 2 muối CaCO3 và Ca(HCO3)2 => 1 < nOH-/nCO2 < 2 Lời giải chi tiết: Thu được 2 muối CaCO3 và Ca(HCO3)2 => 1 < nOH-/nCO2 < 2 Hay 1 < 2b/a < 2 => a < 2b < 2a => b < a < 2b Đáp án A Câu hỏi 26 : Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu diễn theo đồ thị bên.
Mối quan hệ giữa a, b là
Đáp án: A Phương pháp giải: Dựa vào kĩ năng quan sát đồ thị Ta thấy tại nCO2 = a (mol) và nCO2 =b (mol) cùng thu được 1 lượng kết tủa CaCO3 Xét tại nCO2 = b (mol) => xảy ra trường hợp kết tủa tạo cực đại, sau đó tan 1 lượng còn đúng a (mol) PTHH xảy ra: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) CO2 + CaCO3 → Ca(HCO3)2 (2) Lập phương trình với tổng mol CO2 theo phương trình và theo đề bài cho sẽ ra được mối liên hệ giữa a và b Lời giải chi tiết: Từ đồ thị ta thấy: Tại nCO2 = a(mol), đồ thị đi lên => chỉ xảy ra pư tạo kết tủa CaCO3, lúc này CO2 pư hết, Ca(OH)2 pư dư. Mọi tính tóa theo số mol của CO2. CO2 + Ca(OH)2 → CaCO3↓ + H2O. a → a (mol) Ta thấy tại giá trị nCO2 = b (mol) và nCO2 = a (mol) cùng thu được 1 lượng kết tủa CaCO3 => Tại nCO2 = b(mol) thu được nCaCO3 = a (mol). Vì tại nCO2 = b (mol) ta thấy đồ thị đi lên cực đại rồi lại đi xuống => kết tủa sinh ra cực đại sau đó hòa tan 1 lượng còn a (mol) CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) 0,12← 0,12 → 0,12 (mol) CO2 + CaCO3 → Ca(HCO3)2 (2) 0,12-a← (0,12-a) (mol) Tổng mol CO2 pư ở (1) và (2) là: ∑ nCO2(1+2) = 0,12 + 0,12 –a => b = 0,24 –a Đáp án A Câu hỏi 27 : Dẫn V lít (đktc) khí CO2 qua 100ml dung dịch Ca(OH)2 1M thu được 6 gam kết tủa. Lọc bỏ kết tủa, lấy dung dịch nước lọc đun nóng lại thu được kết tủa nữa. Giá trị của V là:
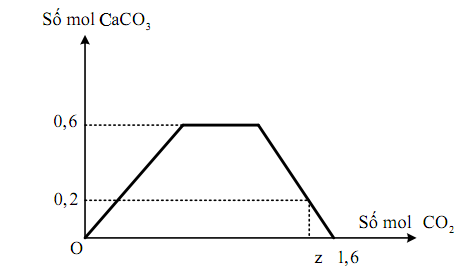
Đáp án: C Phương pháp giải: Bài toán CO2 + OH- - Biện luận sản phẩm của phản ứng là 1 muối hay 2 muối Lời giải chi tiết: Dung dịch sau phản ứng khi đun nóng có tạo thêm kết tủa => có tạo ra HCO3- nCa(OH)2 = 0,1 mol ; nCaCO3 = 6: 100 = 0,06 mol Bảo toàn Ca: nCa(OH)2 = nCaCO3 + nCa(HCO3)2 => nCa(HCO3)2 = 0,1 – 0,06 = 0,04 mol => Bảo toàn C: nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,06 + 0,04.2 = 0,14 mol => VCO2 = 3,136 lít Đáp án C Câu hỏi 28 : Khi sục từ từ đến dư CO2 vào dung dịch có chứa 0,1 mol KOH, x mol NaOH và y mol Ca(OH)2. Kết quả thí nghiệm thu được biểu diễn trên đồ thị sau: Giá trị của x, y, z lần lượt là:
Đáp án: A Phương pháp giải: Vì số mol CaCO3 lớn nhất là 0,6 mol nên nCaCO3 =nCa(OH)2 → y Tại thời điểm 1,6 mol CO2 thì kết tủa bắt đầu tan hoàn toàn nên dung dịch chỉ chứa HCO3- → CO2 + OH- → HCO3- →nOH- = nHCO3- = nKOH + nNaOH + 2nCa(OH)2 → x Tại thời điểm z mol CO2 thì tạo cả HCO3- và CO32- → nCaCO3 → nCO32- → Dung dịch chứa HCO3- ; K+ : 0,1 mol ; Na+ : x mol và Ca(OH)2 : (y -0,2) mol Bảo toàn điện tích có nHCO3- Bảo toàn C có nCO2 Lời giải chi tiết: Vì số mol CaCO3 lớn nhất là 0,6 mol nên nCaCO3 =nCa(OH)2 = 0,6 mol → y = 0,6 mol Tại thời điểm 1,6 mol CO2 thì kết tủa bắt đầu tan hoàn toàn nên dung dịch chỉ chứa HCO3- → CO2 + OH- → HCO3- →nOH- = 1,6 = nKOH + nNaOH + 2nCa(OH)2 = 0,1 + x + 2y → x = 1,6 – 0,1 - 0,6.2 =0,3 mol Tại thời điểm z mol CO2 thì tạo cả HCO3- và CO32- nCaCO3 = 0,2 mol → nCO32- = 0,2 mol Dung dịch chứa HCO3- ; K+ : 0,1 mol ; Na+ : 0,3 mol và Ca2+ : 0,4 mol Bảo toàn điện tích có nHCO3- = 0,1 + 0,3 + 0,4.2 = 1,2 mol Bảo toàn C có nCO2 = nHCO3- + nCO32- = 1,2 + 0,2 = 1,4 mol = z Đáp án A Câu hỏi 29 : Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2 . Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu điễn theo đồ thị sau:
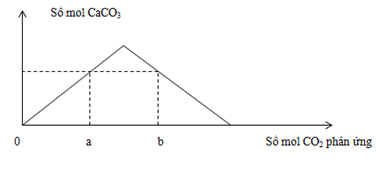
Mối quan hệ của a và b là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Các phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O(1) CaCO3 + CO2 + H2O → Ca(HCO3)2(2) - Tại nCO2 = a (đồ thị đi lên) => Chỉ xảy ra phản ứng (1) => nCaCO3 = nCO2 = a - Tại nCO2 = b (đồ thị đi xuống): Kết tủa đã bị hòa tan một phần Sản phẩm lúc này gồm: CaCO3: a mol Ca(HCO3)2: 0,12 - a (BTNT "Ca") BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => b = a + 2(0,12 - a) => b = 0,24 - a Đáp án A Câu hỏi 30 : Sục từ từ khí CO2 vào dung dịch Ca(OH)2. Sự phụ thuộc số mol kết tủa và số mol CO2 tham gia phản ứng được biểu diễn bằng đồ thị dưới đây:
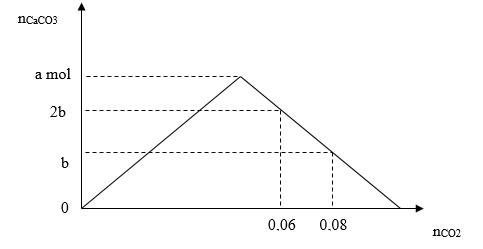
Tỉ lệ a: b là
Đáp án: C Phương pháp giải: Giai đoạn 1: đồ thị đi lên do xảy ra phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) Giai đoạn 2: đồ thị đi xuống do xảy ra phản ứng CO2 + CaCO3 + H2O → Ca(HCO3)2 (2) Khi CO2 từ 0,06 mol tăng lên 0,08 mol thì lượng kết tủa hòa tan từ 2b mol xuống b mol → b =? (mol) Xét tại nCO2 = 0,08 (mol), kết tủa CaCO3 đạt cực đại rồi hòa tan 1 lượng còn lại là 0,02 mol BTNT "C" => a = ? Lời giải chi tiết: Giai đoạn 1: đồ thị đi lên do xảy ra phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) Giai đoạn 2: đồ thị đi xuống do xảy ra phản ứng CO2 + CaCO3 + H2O → Ca(HCO3)2 (2) Khi CO2 từ 0,06 mol tăng lên 0,08 mol thì lượng kết tủa hòa tan từ 2b mol xuống b mol → 2b - b = 0,08 - 0,06 → b = 0,02 (mol) Xét tại nCO2 = 0,08 (mol), kết tủa CaCO3 đạt cực đại rồi hòa tan 1 lượng còn lại là 0,02 mol Tại thời điểm này: nCO2 = nCO2(1) + nCO2(2) = nCa(OH)2 + nCaCO3 bị hòa tan → 0,08 = a + (a -0,02) → a = 0,05 → a: b = 0,05 : 0,02 = 5: 2 Đáp án C
|













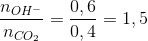 → tạo 2 muối CO32- và muối HCO3-
→ tạo 2 muối CO32- và muối HCO3-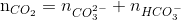 =0,4 mol
=0,4 mol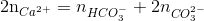 =0,6 mol
=0,6 mol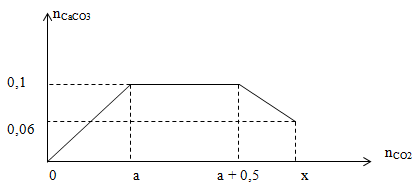

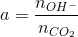 =1,5 → tạo 2 muối CO32- và HCO3- với số mol lần lượt là x và y
=1,5 → tạo 2 muối CO32- và HCO3- với số mol lần lượt là x và y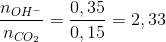 → phản ứng tạo CO32- : 0,15 mol ( Bảo toàn C )
→ phản ứng tạo CO32- : 0,15 mol ( Bảo toàn C )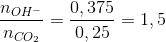 → tạo cả HCO3- : x mol và CO32- : y mol
→ tạo cả HCO3- : x mol và CO32- : y mol