15 bài tập về nước cứng có lời giảiLàm bàiCâu hỏi 1 : Một cốc nước cứng có chứa 0,1 mol Ca2+ a mol K+; 0,15 mol Cl- và b mol HCO3-. Thêm vào cốc 0,1 mol Ca(OH)2 thì mất hoàn toàn tính cứng, dung dịch trong cốc nước chỉ chứa duy nhất một muối. Đun sôi cốc nước cứng trên đến cạn thu được lượng chất rắn khan là:
Đáp án: B Phương pháp giải: + Bảo toàn điện tích + Viết phương trình ion rút gọn Lời giải chi tiết: Bảo toàn điện tích: 2nCa2+ + nK+ = nCl- + nHCO3- => 0,2 + a = 0,15 + b => b – a = 0,05 ( mol) (1) Thêm vào cốc 0,1 mol Ca(OH)2 thì dung dịch thu được chỉ chứa 1 muối duy nhất => muối đó là KCl => nK+ = nCl- = 0,15 (mol) = a Từ (1) => b = nHCO3- = 0,05 + 0,15 = 0,2 (mol) Khi đun sôi nước cứng trên thì: 2HCO3- → CO32- + CO2 + H2O 0,2 → 0,1 (mol) => nCO3 2- = 0,1 (mol) => mrắn = mCa2+ + mCO32- + mK+ + mCl- = 0,1. 40 + 0,1.60 + 0,15.39 + 0,15. 35,5 = 21,175 (g) Đáp án B Câu hỏi 2 : Một cốc nước có chứa các ion : Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), HCO3- (0,10 mol) và SO42- (0,01 mol) . Đun sôi cốc nước trên cho đến khi phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc:
Đáp án: B Phương pháp giải: Khi đun nóng thì: 2HCO3- → CO32-+ CO2+ H2O Trong dung dịch sau phản ứng ta so sánh: nCa2+, Mg2+ và nCO32- => tính cứng của nước còn lại trong cốc Lời giải chi tiết: Khi đun nóng thì: 2HCO3- → CO32-+ CO2+ H2O 0,1→ 0,05 mol Mà nCa2+, Mg2+ = 0,02 + 0,04 = 0,06 mol > 0,05 mol nên Ca2+ và Mg2+ vẫn còn dư. → Dung dịch chứa Ca2+, Mg2+, Cl-, SO42- nên nước còn lại trong cốc là nước cứng vĩnh cửu. Đáp án B Câu hỏi 3 : Một loại nước cứng có chứa các ion: Ca2+, Mg2+ , Cl-, HCO3-; trong đó nồng độ của Cl- là 0,006M và của HCO3- là 0,01M. Hãy cho biết cần lấy bao nhiêu ml dung dịch Na2CO3 0,2M để biến 1 lít nước cứng đó thành nước mềm ? Coi như các chất kết tủa hoàn toàn
Đáp án: B Phương pháp giải: Chuyển từ nước cứng thành nước mềm là kết tủa hết ion Ca2+ và Mg2+ có trong dd Ca2+ + CO32-→ CaCO3 Mg2+ + CO32- → MgCO3 Bảo toàn điện tích Tính theo PTHH Lời giải chi tiết: Ca2+ + CO32-→ CaCO3 Mg2+ + CO32- → MgCO3 Bảo toàn điện tích nên \({n_{C{a^{2 + }}}} + {n_{M{g^{2 + }}}} = {n_{HCO_3^ - }} + {n_{C{l^ - }}} = 0,01 + 0,006 = 0,016\) mol Theo pthh thì nCO3 = nCa + nMg = 0,016 mol →nNa2CO3 = 0,016 mol → VNa2CO3 = 0,08 lít = 80ml Đáp án B Câu hỏi 4 : Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
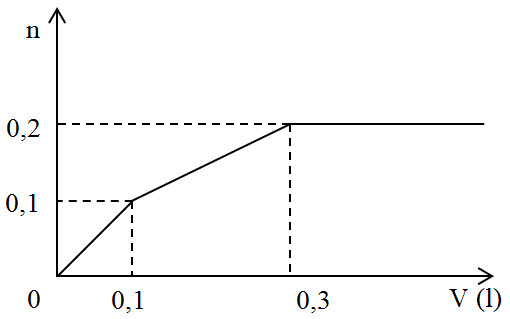
Đáp án: A Phương pháp giải: OH- + HCO3- → CO32- + H2O Ba2+ + CO32- → BaCO3↓ Khi thêm từ từ HCl vào thì xảy ra pư theo thứ tự: H+ + OH- → H2O H+ + CO3- → HCO3- Khi bắt đầu sinh khí thì nH+ = nOH- + nCO32- Lời giải chi tiết: nBa(OH)2 = 0,02 mol và nNaHCO3 = 0,03 mol OH- + HCO3- → CO32- + H2O Bđ: 0,04 0,03 Pư: 0,03 ← 0,03 → 0,03 Sau: 0,01 0 0,03 Ba2+ + CO32- → BaCO3↓ Bđ: 0,02 0,03 Pư: 0,02 → 0,02 → 0,02 Sau: 0 0,01 0,02 Vậy dung dịch X gồm: Na+ (0,03 mol); OH- (0,01 mol) và CO32- (0,01 mol) Khi thêm từ từ HCl vào thì xảy ra pư theo thứ tự: H+ + OH- → H2O H+ + CO3- → HCO3- Khi bắt đầu sinh khí thì nH+ = nOH- + nCO32- = 0,01 + 0,01 = 0,02 mol V = 0,02 : 0,25 = 0,08 lít = 80 ml Đáp án A Câu hỏi 5 : Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa lượng kết tủa và thể tích dung dịch Ba(OH)2 như sau:
Giá trị của x và y tương ứng là:
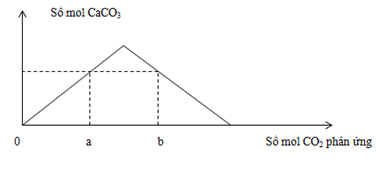
Đáp án: B Phương pháp giải: Phân tích theo đồ thị: + Tại thời điểm V = 0,1 lít thì nBa(OH)2 = 0,05 mol PTHH : OH- + HCO3- → H2O + CO32- Ba2+ + CO32- → BaCO3 Vì nCO32- = nBaCO3 = 0,1 mol nên nBa2+ phản ứng = 0,1 mol > nBa(OH)2 nên lương Ba2+ trong BaCl2 tham giá phản ứng và phản ứng hết (do đồ thị biến đổi ) → y + Tại thời điểm V = 0,3 lít thì kết tủa thu được lớn nhất thì kết tủa hoàn thành BaCO3: Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O Lời giải chi tiết: + Tại thời điểm V = 0,1 lít thì nBa(OH)2 = 0,05 mol PTHH : OH- + HCO3- → H2O + CO32- 0,1 mol 0,1 mol Ba2+ + CO32- → BaCO3 Vì nCO32- = nBaCO3 = 0,1 mol nên nBa2+ phản ứng = 0,1 mol > nBa(OH)2 nên lương Ba2+ trong BaCl2 tham giá phản ứng và phản ứng hết (do đồ thị biến đổi) → nBaCl2 = 0,1 – 0,05 = 0,05 mol = y + Tại thời điểm V = 0,3 lít → nBa(OH)2 = 0,15 mol thì kết tủa thu được lớn nhất thì kết tủa hoàn thành BaCO3 Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O → nBa(OH)2 thêm = nNaHCO3 còn lại → 0,15 – 0,05 = x – 0,1 → x = 0,2 mol Đáp án B Câu hỏi 6 : Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2 . Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu điễn theo đồ thị sau:
Mối quan hệ của a và b là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Các phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O(1) CaCO3 + CO2 + H2O → Ca(HCO3)2(2) - Tại nCO2 = a (đồ thị đi lên) => Chỉ xảy ra phản ứng (1) => nCaCO3 = nCO2 = a - Tại nCO2 = b (đồ thị đi xuống): Kết tủa đã bị hòa tan một phần Sản phẩm lúc này gồm: CaCO3: a mol Ca(HCO3)2: 0,12 - a (BTNT "Ca") BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => b = a + 2(0,12 - a) => b = 0,24 - a Đáp án A Câu hỏi 7 : Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít CO2 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư. Câu 1: Khối lượng kết tủa thu được là
Đáp án: C Phương pháp giải: - Khi dẫn CO2 vào dung dịch Ca(OH)2 dư chỉ có 1 phản ứng xảy ra: \(C{O_2} + Ca{(OH)_2} \to CaC{{\text{O}}_3} + {H_2}O\) - Từ số mol CO2 tính được số mol CaCO3 ⟹ Khối lượng kết tủa Lời giải chi tiết: PTHH: \(C{O_2} + Ca{(OH)_2} \to CaC{{\text{O}}_3} + {H_2}O\) \({n_{C{O_2}}} = \dfrac{{4,48}}{{22,4}} = 0,2\,mol \to {n_{CaC{{\text{O}}_3}}} = {n_{C{O_2}}} = 0,2(mol)\) \( \to {m_{CaC{{\text{O}}_3}}} = 0,2.100 = 20(g)\) Đáp án C Câu 2: Thể tích dung dịch HCl cần dùng là
Đáp án: A Phương pháp giải: - Viết PTHH khi cho 2 muối cacbonat phản ứng với HCl. - Dựa vào tỉ lệ ở các PTHH suy ra mối liên hệ số mol giữa HCl và CO2 - Tính được mol HCl ⟹ V dung dịch Lời giải chi tiết: PTHH: \(BaC{{\text{O}}_3} + 2HCl \to BaC{l_2} + C{O_2} + {H_2}O\) \(CaC{{\text{O}}_3} + 2HCl \to CaC{l_2} + C{O_2} + {H_2}O\) Nhận xét: Từ PTHH ta thấy \({n_{HCl}} = 2{n_{C{O_2}}} = 0,4(mol)\) \( \to {V_{HCl}} = \dfrac{{0,4}}{{0,4}} = 1,0(lit)\) Đáp án A Câu 3: Giá trị của a nằm trong khoảng nào dưới đây ?
Đáp án: C Phương pháp giải: Giả sử hỗn hợp ban đầu chỉ có BaCO3, tính ra giá trị lớn nhất của a. Giả sử hỗn hợp ban đầu chỉ có CaCO3, tính ra giá trị nhỏ nhất của a. Lời giải chi tiết: Giả sử hỗn hợp ban đầu chỉ có BaCO3 \({n_{BaC{{\text{O}}_3}}} = {n_{C{O_2}}} = 0,2\,mol \to {m_{BaC{{\text{O}}_3}}} = 0,2.197 = 39,4\,gam\) Giả sử hỗn hợp ban đầu chỉ có CaCO3 \({n_{CaC{{\text{O}}_3}}} = {n_{C{O_2}}} = 0,2\,mol \to {m_{CaC{{\text{O}}_3}}} = 0,2.100 = 20\,gam\) Thực tế, hỗn hợp ban đầu chứa cả BaCO3 và CaCO3 nên giá trị của a nằm trong khoảng 20 gam < a < 39,4 gam Đáp án C Câu hỏi 8 : Trong một cốc nước có chứa 0,03 mol Na+; 0,01 mol Ca2+; 0,01 mol Mg2+; 0,04 mol HCO3-; 0,01 mol Cl-; 0,01 mol SO42-. Nước trong cốc thuộc loại
Đáp án: A Phương pháp giải: - Đối với những bài chứa Mg2+; Ca2+; HCO3-; SO42-; Cl-… thì ta đem đun lên: + Nếu nước mất tính cứng ⟹ Nước cứng tạm thời + Nếu nước không mất tính cứng ⟹ Nước cứng toàn phần Lời giải chi tiết: Đun nóng dung dịch: 2HCO3- → CO32- + CO2 + H2O 0,04 → 0,02 (mol) Ta thấy Ca2+ và Mg2+ bị kết tủa hết: Ca2+ + CO32- → CaCO3 ↓ 0,01 0,01 Mg2+ + CO32- → MgCO3 ↓ 0,01 0,01 Vậy nước cứng bị mất tính cứng khi đun nóng nên là nước cứng tạm thời. Đáp án A Câu hỏi 9 : Trong một cốc nước chứa 0,02 mol Ca2+; 0,01 mol Mg2+; 0,04 mol HCO3-; 0,02 mol Cl-. Nước trong cốc thuộc loại
Đáp án: C Phương pháp giải: - Đối với những bài chứa Mg2+; Ca2+; HCO3-; SO42-; Cl-… thì ta đem đun lên: + Nếu nước mất tính cứng ⟹ Nước cứng tạm thời + Nếu nước không mất tính cứng ⟹ Nước cứng toàn phần Lời giải chi tiết: Đun nóng dung dịch: 2HCO3- → CO32- + CO2 + H2O 0,04 → 0,02 (mol) Ta thấy: \({n_{C{a^{2 + }}}} + {n_{M{g^{2 + }}}} > {n_{C{O_3}^{2 - }}}\) nên các ion này chưa bị kết tủa hết Vậy nước này bị giảm tính cứng khi đun nóng nhưng không mất tính cứng nên là nước cứng toàn phần. Đáp án C Câu hỏi 10 : Hỗn hợp X chứa K2O, NH4Cl, NaHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào nước dư, đun nóng thu được dung dịch Y. Các ion có trong dung dịch Y là
Đáp án: A Phương pháp giải: Gọi số mol mỗi chất ban đầu là a mol Viết các phương trình phản ứng của các chất với nước, các chất phản ứng với nhau, so sánh số mol để xét chất dư, chất hết Lời giải chi tiết: Giả sử ban đầu mỗi chất đều là a mol. Khi cho vào nước thì chỉ có K2O tác dụng với nước K2O + H2O → 2KOH a → 2a (mol) KOH + NH4Cl → KCl + NH3 + H2O a a (mol) 2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O a a 0,5a 0,5a (mol) CO32- + Ba2+ → BaCO3 (0,5a + 0,5a) a Vậy cuối cùng chỉ còn K+, Na+ và Cl- Đáp án A Câu hỏi 11 : Một cốc nước chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,065 mol HCO3-; và ion Cl-. Đun nóng cốc nước trên một hồi lâu sau đó lọc bỏ kết tủa, thu được
Đáp án: B Phương pháp giải: Tiến hành đun nóng cốc nước. Nước trong cốc thu được sẽ thuộc loại: + Nước mềm nếu mất tính cứng + Nước cứng vĩnh cửu nếu không mất tính cứng Lời giải chi tiết: 2HCO3- → CO32- + CO2 + H2O (to) 0,065 → 0,0325 (mol) Nhận thấy: ∑nCa2+,Mg2+ = 0,03 < nCO3 2- = 0,0325 ⟹ Ion Ca2+, Mg2+ bị kết tủa hết Vậy nước thu được là nước mềm. Đáp án B Câu hỏi 12 : Hấp thụ hết V lít khí CO2 (đktc) vào dung dịch chứa 0,3 mol NaOH và 0,2 mol Ba(OH)2 thu được a gam kết tủa và dung dịch X. Để thu được lượng kết tủa lớn nhất cần cho thêm 4000 ml dung dịch Ba(OH)2 0,1M vào X. Giá trị của V là
Đáp án: A Phương pháp giải: Sử dụng bảo toàn nguyên tố Ba, C Kết tủa thu được lớn nhất khi tất cả C trong CO2 chuyển thành C trong BaCO3 BTNT “Ba”: nBaCO3 = nBa(OH)2 lần 1+ nBa(OH)2 lân 2 = ? (mol) BTNT “C”: nCO2 = nBaCO3 = ? ⟹ VCO2(đktc) = ? Lời giải chi tiết: 4000 ml = 4 lít nBa(OH)2 = V.CM = 4.0,1 = 0,4 (mol) Kết tủa thu được lớn nhất khi tất cả C trong CO2 chuyển thành C trong BaCO3 BTNT “Ba”: nBaCO3 = nBa(OH)2 lần 1+ nBa(OH)2 lân 2 = 0,2 + 0,4 = 0,6 (mol) BTNT “C”: nCO2 = nBaCO3 = 0,6 (mol) ⟹ VCO2 (đktc)= 0,6.22,4 = 13,44 (lít) Đáp án A Câu hỏi 13 : Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau khi các phản ứng kết thúc thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ khối so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: NO: x mol CO2: y mol x+y=0,2 30x+44y=0,2.37 =>x=0,1 mol; y=0,1 mol =>nMgCO3=nCO2=0,1 mol \(\begin{gathered} Đáp án C Câu hỏi 14 : Một loại nước cứng có chứa Ca2+ 0,002M; Mg2+ 0,003M và HCO3-. Hãy cho biết cần lấy bao nhiêu ml dung dịch Ca(OH)2 0,05M để biến 1 lít nước đó thành nước mềm (coi như các phản ứng xảy ra hoàn toàn và kết tủa thu được gồm CaCO3 và Mg(OH)2).
Đáp án: C Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Ta thấy Ca2+ và Mg2+ đã bị kết tủa hết. Vậy V = 0,16 lít = 160 ml Đáp án C Câu hỏi 15 : Một lít dung dịch nước cứng tạm thời có thể làm mềm bằng 100 ml Ca(OH)2 0,01M vừa đủ thu được 0,192 gam kết tủa. Nồng độ mol/l của các cation gây ra tính cứng của nước là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Đáp án B
|