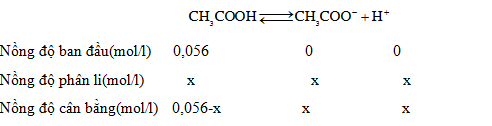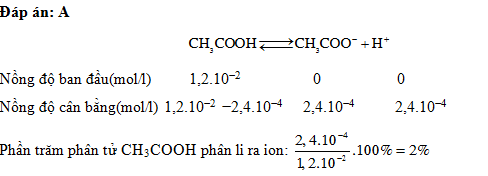20 bài tập về sự điện li có lời giải (phần 1)Làm bàiCâu hỏi 1 : Hòa tan 14,2 gam Na2SO4 trong nước thu được dd A chứa số mol ion SO42- là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: nNa2SO4 = 0,1 mol nSO42- = nNa2SO4 = 0,1 mol Đáp án A Câu hỏi 2 : Hòa tan hoàn toàn m gam Al2(SO4)3 vào nước thu được dung dịch A chứa 0,6 mol Al3+
Đáp án: A Phương pháp giải: Lời giải chi tiết: Vì Al2(SO4)3 là chất điện li mạnh, điện li hoàn toàn nên ta có: Al2(SO4)3 → 2Al3+ + 3SO42- 0,3 ← 0,6 (mol) ⟹ m = 0,3.342 = 102,6 gam Đáp án A Câu hỏi 3 : Để được dung dịch chứa: 0,05 mol Al3+; 0,06 mol SO42- ; 0,03 mol Cl-. Phải hòa tan vào nước những muối nào, bao nhiêu mol ?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Bảo toàn nguyên tố với AlCl3 và Al2(SO4)3 Đáp án A Câu hỏi 4 : Trong 100 ml dung dịch H2SO4 0,2M có số mol của ion H+ và SO42- lần lượt là
Đáp án: B Phương pháp giải: Lời giải chi tiết: nH2SO4 = 0,1.0,2 = 0,02 (mol) H2SO4 là chất điện li mạnh nên điện li hoàn toàn: H2SO4 → 2H+ + SO42- 0,02 0,04 0,02 (mol) Đáp án B Câu hỏi 5 : Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Đáp án: C Phương pháp giải: Lời giải chi tiết: \({m_{{\rm{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)\) \( \to {V_{dd}} = m:d = 50:1,12 = \frac{{625}}{{14}}ml\) \({n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)\) \( \to {C_{MNaOH}} = n:{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)\) NaOH → Na+ + OH− Theo pt: nNaOH = nOH- = 2.10-3 (mol) ⟹ Thể tích dd A cần lấy là: V = n : CM = 2.10-3 : 3,36 = 6.10-4 (l) = 0,6 (ml) Đáp án C Câu hỏi 6 : Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200ml dung dịch H2SO4 1M?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C nH2SO4 = 0,2(mol) H2SO4→2H++ SO42- $${n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 2.0,2 = 0,4(mol)$$ Ba(OH)2→ Ba2+ + 2OH− $${n_{Ba{{(OH)}_2}}} = {1 \over 2}{n_{O{H^ - }}} = {1 \over 2}.0,4 = 0,2(mol)$$ $$ = > {V_{Ba{{(OH)}_2}}} = n:{C_M} = 0,2:0,5 = 0,4(l)$$ Câu hỏi 7 : Tính nồng độ mol của CH3COOH, CH3COO− và H+ trong dung dịch CH3COOH 0,056M, biết rằng độ điện li α của CH3COOH bằng 20%.
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án: D Độ điện li : α= $${x \over {0,056 - x}}.100\% = 20\% $$ => X=0,0112( M) => [CH3COO-] = 0,0112M; [H+] = 0,0112M [CH3COOH] = 0,056 - 0,012 = 0,0448M =>chọn D Câu hỏi 8 : : Trong dung dịch CH3COOH 1,2.10−2M, người ta xác định được nồng độ H+ bằng 2,4.10−4 mol/l. Phần trăm phân tử CH3COOH trong dung dịch này phân li ra ion là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 9 : A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B Khi pha loãng dung dịch 100 lần thì nồng độ các ion trong dung dịch cũng giảm 100 lần HCl→H+ + Cl− Trước khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 0,01M$$ Sau khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 1,{0.10^{ - 4}}M$$ =>chọn B Câu hỏi 10 : Một dung dịch chứa 0,1 mol Na+ và x mol SO42-. Giá trị của x là:
Đáp án: D Phương pháp giải: Bảo toàn điện tích. Lời giải chi tiết: Áp dụng định luật bảo toàn điện tích ta có: n(+) = n(-) => nNa+ = 2nSO4 2- => 0,1 = 2x => x = 0,05 mol Đáp án D Câu hỏi 11 : Dung dịch X có chứa 0,1 mol Na và x mol ClO-. Giá trị của x là:
Đáp án: B Phương pháp giải: Bảo toàn điện tích. Lời giải chi tiết: Bảo toàn điện tích: n(+) = n(-) => nNa+ = nClO- => x = 0,1 mol Đáp án B Câu hỏi 12 : Nồng độ ion H+ trong 200 ml dung dịch H2SO4 0,25M là (coi như H2SO4 là chất điện li hoàn toàn):
Đáp án: D Phương pháp giải: Viết phương trình điện li, từ nồng độ H2SO4 suy ra nồng độ H+. Lời giải chi tiết: Do H2SO4 là chất điện li hoàn toàn nên phương trình điện li là: H2SO4 → 2H+ + SO42- 0,25M → 0,5M Đáp án D Câu hỏi 13 : Trong dung dịch Fe2(SO4)3 loãng có chứa 0,45 mol SO42- thì trong dung dịch có chứa:
Đáp án: C Phương pháp giải: Viết phương trình phân li của Fe2(SO4)3 và xác định số mol của các chất/ion từ đó chọn đáp án đúng. Lời giải chi tiết: Fe2(SO4)3 → 2Fe3+ + 3SO42- (Mol) 0,15 ← 0,3 ← 0,45 Đáp án C Câu hỏi 14 : Dung dịch Na3PO4 1M, nồng độ (mol/l) của ion Na+ và PO43- lần lượt là
Đáp án: B Phương pháp giải: Na3PO4 là chất điện li mạnh nên khi hòa tan vào nước phân li hoàn toàn thành ion. Viết phương trình phân li của Na3PO4. Từ nồng độ của Na3PO4 suy ra nồng độ Na+ và PO43-. Lời giải chi tiết: Na3PO4 là chất điện li mạnh nên khi hòa tan vào nước phân li hoàn toàn thành ion. PT phân li: Na3PO4 → 3Na+ + PO43- 1 → 3 → 1 (M) Vậy [Na+] = 3M và [PO43-] = 1M Đáp án B Câu hỏi 15 : Dung dịch thu được khi trộn lẫn 200 ml dung dịch NaCl 0,2M và 300 ml dung dịch Na2SO4 0,2M có nồng độ cation Na+ là bao nhiêu?
Đáp án: A Phương pháp giải: Tính được nNaOH và nNa2SO4 Phương trình phân li: NaOH → Na+ + OH- Na2SO4 → 2Na+ + SO42- → nNa+ → [Na+] Lời giải chi tiết: nNaOH = 0,04 mol và nNa2SO4 = 0,12 mol Phương trình phân li: NaOH → Na+ + OH- 0,04 → 0,04 mol Na2SO4 → 2Na+ + SO42- 0,06 → 0,12 mol → nNa+ = 0,16 mol → [Na+] = 0,16 : 0,5 = 0,32 M Đáp án A Câu hỏi 16 : Cho dung dịch CH3COOH 0,1M biết hằng số phân li axit của CH3COOH là Ka = 1,8.10-5. Nồng độ ion CH3COO- ở trạng thái cân bằng là:
Đáp án: C Phương pháp giải: PT phân li: CH3COOH ⇄ CH3COO- + H+ Ban đầu: 0,1 (M) Phân li: x → x → x (M) Cân bằng: 0,1-x x x (M) Ta có: \({K_a} = \frac{{\left[ {C{H_3}CO{O^ - }} \right].\left[ {{H^ + }} \right]}}{{\left[ {C{H_3}COOH} \right]}} \to x\) Suy ra nồng độ ion CH3COO- ở trạng thái cân bằng. Lời giải chi tiết: PT phân li: CH3COOH ⇄ CH3COO- + H+ Ban đầu: 0,1 (M) Phân li: x → x → x (M) Cân bằng: 0,1-x x x (M) Ta có: \({K_a} = \frac{{\left[ {C{H_3}CO{O^ - }} \right].\left[ {{H^ + }} \right]}}{{\left[ {C{H_3}COOH} \right]}} \Leftrightarrow \frac{{{x^2}}}{{0,1 - x}} = 1,{8.10^{ - 5}}\) ⟹ x = 1,33267.10-3 Vậy [CH3COO-] = x = 1,33267.10-3M Đáp án C Câu hỏi 17 : Trong 1 ml dung dịch axit HNO2 có 1,41.1019 phân tử HNO2; 0,9.1018 ion NO2- và còn lại là H+. Độ điện li α của HNO2 trong dung dịch đó là
Đáp án: A Phương pháp giải: Số phần tử các chất, ion được kí hiệu là N. Độ điện li được tính theo công thức: \( \alpha = \frac{{{N_{HN{O_2}\left( {pli} \right)}}}}{{{N_{HN{O_2}\left( {b{\rm{d}}} \right)}}}}.100\%\) Lời giải chi tiết: PT phân li: HNO2 ⇄ NO2- + H+ Số phần tử các chất, ion được kí hiệu là N. \( \to {N_{HN{O_2}\left( {pli} \right)}} = {N_{NO_2^ - }} = 0,{9.10^{18}}\) (phân tử) \( \to {N_{HN{O_2}\left( {b{\rm{d}}} \right)}} = {N_{HN{O_2}\left( {pli} \right)}} + {N_{HN{O_2}\left( {cb} \right)}} = 0,{9.10^{18}} + 1,{41.10^{19}} = 1,{5.10^{19}}\) (phân tử) \( \to \alpha = \frac{{{N_{HN{O_2}\left( {pli} \right)}}}}{{{N_{HN{O_2}\left( {b{\rm{d}}} \right)}}}}.100\% = \frac{{0,{{9.10}^{18}}}}{{1,{{5.10}^{19}}}}.100\% = 0,06 = 6\% \) Đáp án A Câu hỏi 18 : Nồng độ mol của ion H+ trong dung dịch CH3COOH 0,1M là 0,0013M. Độ điện li của axit CH3COOH là
Đáp án: B Phương pháp giải: Viết phương trình điện li: CH3COOH ⇄ CH3COO- + H+ Bđ: 0,1M Đli: 0,1α (M) 0,1α (M) ⟹ [H+] = 0,1α (M) ⟹ α Lời giải chi tiết: CH3COOH ⇄ CH3COO- + H+ Bđ: 0,1M Đli: 0,1α (M) 0,1α (M) ⟹ [H+] = 0,1α (M) ⟹ 0,0013 = 0,1α ⟹ α = 0,013 = 1,3% Đáp án B Câu hỏi 19 : Dung dịch X chứa hỗn hợp axit H2SO4 1,5M và HCl 1M. Số mol của ion H+ trong 300 ml dung dịch X là (coi như H2SO4 điện li hoàn toàn):
Đáp án: A Phương pháp giải: Dựa vào đề bài ta tính được số mol mỗi axit theo công thức: n = CM.V Viết PT điện li: H2SO4 → 2H+ + SO42- HCl → H+ + Cl- Từ đó suy ra nH+ = 2nH2SO4 + nHCl Lời giải chi tiết: Ta có: nH2SO4 = 1,5.0,3 = 0,45 mol; nHCl = 1.0,3 = 0,3 mol PT điện li: H2SO4 → 2H+ + SO42- HCl → H+ + Cl- ⟹ nH+ = 2nH2SO4 + nHCl = 2.0,45 + 0,3 = 1,2 mol Đáp án A Câu hỏi 20 : Trong dung dịch axit HCOOH 0,005M, nồng độ ion H+ là 0,001M. Hằng số phân li axit của HCOOH là
Đáp án: C Phương pháp giải: - Xác định nồng độ các chất, ion trong dung dịch tại trạng thái cân bằng dựa vào phương trình phân li: HCOOH ⇄ HCOO‑ + H+ - Tính hằng số phân li axit theo công thức: \( {K_a} = \frac{{\left[ {HCO{O^ - }} \right].\left[ {{H^ + }} \right]}}{{\left[ {HCOOH} \right]}} \) Lời giải chi tiết: PT phân li: HCOOH ⇄ HCOO‑ + H+ Ban đầu: 0,005M Phân li: 0,001M ← 0,001M ← 0,001M Cân bằng: 0,004M 0,001M 0,001M \( \to {K_a} = \frac{{\left[ {HCO{O^ - }} \right].\left[ {{H^ + }} \right]}}{{\left[ {HCOOH} \right]}} = \frac{{0,{{001}^2}}}{{0,004}} = 2,{5.10^{ - 4}}\) Đáp án C
|