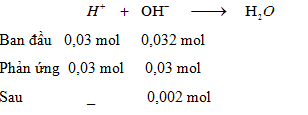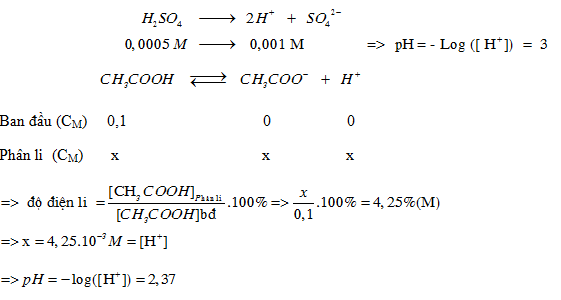20 bài tập vận dụng về tính pH có lời giải (phần 2)Làm bàiCâu hỏi 1 : Dung dịch NaOH 0,001M có giá trị pH là:
Đáp án: C Phương pháp giải: Tính pOH = -log[OH-] => pH = 14 - pOH Lời giải chi tiết: NaOH là chất điện li mạnh => [OH-] = CM NaOH = 0,001M => pOH = -log[OH-] = -log(0,001) = 3 => pH = 14 - pOH = 14 - 3 = 11 Đáp án C Câu hỏi 2 : Cho 100 ml dung dịch X chứa: 0,07 mol Na+; 0,02 mol SO42- và x mol OH-. 100 ml dung dịch Y có chứa y mol H+, Cl-, NO3- và 0,01 mol Na+ (tổng số mol Cl- và NO3- là 0,042). Trộn 100 ml dung dịch X với 100 ml dung dịch Y thu được dung dịch Z. Dung dịch Z có pH là
Đáp án: B Phương pháp giải: Bảo toàn điện tích. Lời giải chi tiết: - Bảo toàn điện tích cho dung dịch X: nOH- = nNa+ - 2nSO42- = 0,07 - 2.0,02 = 0,03 mol - Bảo toàn điện tích cho dung dịch Y: nH+ = (nCl- + nNO3-) - nNa+ = 0,042 - 0,01 = 0,032 mol Khi trộn 100 ml X với 100 ml Y có phản ứng: H+ + OH- → H2O => nH+ dư = nH+ - nOH- = 0,032 - 0,03 = 0,002 mol => [H+] = \(\frac{{{n_{{H^ + }}}}}{{{V_{{\rm{dd}}\,sau\,pu}}}}\) = \(\frac{{0,002}}{{0,1 + 0,1}}\) = 0,01M => pH = -log[H+] = 2 Đáp án B Câu hỏi 3 : Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
Đáp án: D Phương pháp giải: Tính toán theo phương trình ion rút gọn: H+ + OH- → H2O Lời giải chi tiết: nOH = 2nBa(OH)2 = 0,025 mol; nH = nHCl = 0,02 mol H+ + OH- → H2O Bđ: 0,02 0,025 Pư: 0,02 → 0,02 Sau: 0 0,005 => nOH dư = 0,005 mol Mặt khác, V dd sau pư = 0,1 + 0,4 = 0,5 lít => [OH-] = 0,005 : 0,5 = 0,01M => pOH = -log[OH-] = 2 => pH = 14 - pOH = 12 Đáp án D Câu hỏi 4 : Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH a mol/l được 500 ml dung dịch có pH = 12. Giá trị a là:
Đáp án: C Phương pháp giải: Tính toán theo PT ion rút gọn: H+ + OH- → H2O Lời giải chi tiết: nH+ = nHCl + 2nH2SO4 = 0,25.0,08 + 2.0,25.0,01 = 0,025 (mol) nOH- = nNaOH = 0,25a (mol) pH = 12 > 7 => OH- dư, H+ phản ứng hết => pOH = 14 - 12 = 2 => [OH-] = 10-2M H+ + OH- → H2O Bđ: 0,025 0,25a (mol) Pư: 0,025 → 0,025 (mol) Sau: 0 0,25a - 0,025 (mol) Mặt khác, V dd sau pư = 0,25 + 0,25 = 0,5 lít \( \Rightarrow {\rm{[}}O{H^ - }{\rm{]}} = \frac{{0,25a - 0,025}}{{0,5}} = {10^{ - 2}} \Rightarrow a = 0,12(M)\) Đáp án C Câu hỏi 5 : Trộn 200 ml dung dịch H2SO4 0,05 M với 300 ml dung dịch NaOH 0,06 M. PH của dung dịch thu được là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A $${n_{{H_2}S{O_4}}} = 0,01{\rm{ ( mol ) ; }}{{\rm{n}}_{NaOH}}{\rm{ = 0,018 ( mol )}}$$ $${{\rm{n}}_{{H^ + }}}{\rm{ = 2}}{\rm{.0,01 = 0,02 ( mol )}}$$ H2SO4 + 2NaOH → Na2SO4 + H2O Ban đầu 0,01 mol 0,018 mol Phản ứng 0,009 mol 0,018 mol Sau 0,001 mol − $${n_{{H_2}S{O_4}d}}{\rm{ }} = {\rm{ }}0,001{\rm{ (mol) = > }}{{\rm{n}}_{{H^ + }}}{\rm{ = 2}}{n_{{H_2}S{O_4}d}}{\rm{ = 0,002 (mol) = > [}}{H^ + }{\rm{] = }}{{0,002} \over {(200 + 300){{.10}^{ - 3}}}}{\rm{ }} = {\rm{ }}{4.10^{ - 3}}{\rm{ }}(M)$$ => pH = −log([H+ ]) = 2,4 Câu hỏi 6 : Cho 40 ml dung dịch HCl 0,75 M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B $${n_{HCl}} = 0,03{\rm{ ( mol ) ; }}{{\rm{n}}_{Ba{{(OH)}_2}}} = {\rm{ }}0,0128{\rm{ (mol) ; }}{{\rm{n}}_{KOH}}{\rm{ = 0,0064 ( mol )}}$$ $$\sum {{n_{O{H^ - }}}} {\rm{ = 2}}{\rm{.0,0128 + 0,0064 = 0,032 ( mol )}}$$
$${n_{O{H^ - }d}}{\rm{ }} = {\rm{ }}0,002{\rm{ (mol) = > }}{{\rm{C}}_M}{\rm{ = }}{{0,002} \over {(40 + 160){{.10}^{ - 3}}}}{\rm{ }} = {\rm{ }}0,01{\rm{ }}(M)$$ => pH = 14 - log([OH−) = 14 - 2 = 12 Câu hỏi 7 : Muốn pha chế 300ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là bao nhiêu (trong các số cho dưới đây ( Cho H =1 , O=16 , Na =23 , NaOH phân li hoàn toàn )
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A PH=10 => [ H+ ] = 10−10 => [ OH− ] = 10−14: 10−10 = 10−4 M => nNaOH = 0,3. 10−4 = 3. 10−5 ( mol) => mNaOH = 3. 10−5 . 40 = 1,2.10−3 (g) Câu hỏi 8 : Cho V lít dung dịch NaOH có pH= 13 tác dụng với dung dịch chứa 0,1 mol AlCl3 thu được 3,9 gam kết tủa trắng keo. Giá trị của V là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C pH=13 => [ H+] = 10-13 => [ OH−] = 10−14: 10−13 = 0,1 M \({n_{Al{{(OH)}_3}}} = {\rm{ }}3,9:78{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\) \(\eqalign{ & 3NaOH{\rm{ }} + {\rm{ }}AlC{l_3}{\rm{ }}\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{}} {\rm{ }}Al{(OH)_3} \downarrow {\rm{ }} + {\rm{ 3}}NaCl{\rm{ (1)}} \cr & NaOH{\rm{ }} + {\rm{ }}Al{(OH)_3}{\rm{ }}\buildrel {} \over \longrightarrow {\rm{ }}NaAl{O_2}{\rm{ }} + {\rm{ 2 }}{H_2}O{\rm{ (2) }} \cr} \) TH1: chỉ xảy ra phản ứng (1), AlCl3 dư => \({n_{NaOH}}{\rm{ }} = {\rm{ }}3{\rm{ }}{n_{Al{{(OH)}_3}}} = {\rm{ }}0,15{\rm{ }}({\rm{ }}mol{\rm{ }})\) \( = > {V_{NaOH}}{\rm{ }} = {\rm{ }}n:{C_M}{\rm{ }} = {\rm{ }}0,15:0,1{\rm{ }} = {\rm{ 1,5 }}({\rm{ }}l{\rm{ }})\) TH2: Xảy ra cả (1) và (2) Theo (1): \({n_{Al{{(OH)}_3}}} = {\rm{ }}{n_{AlC{l_3}}}{\rm{ }} = {\rm{ }}0,1{\rm{ }}(mol){\rm{ }};{\rm{ }}{n_{NaOH(1)}}{\rm{ }} = {\rm{ }}3{\rm{ }}{n_{AlC{l_3}}} = {\rm{ }}0,3{\rm{ }}(mol)\) \(= > {n_{Al{{(OH)}_3}(2)}} = {\rm{ }}0,1{\rm{ }} - {\rm{ }}0,05{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\) Theo (2) : \({n_{NaOH(2)}}{\rm{ }} = {\rm{ }}{n_{Al{{(OH)}_3}(2)}}{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\) \( = > \sum {NaO{H_{(1) + (2)}}{\rm{ }} = {\rm{ }}0,3 + 0,05{\rm{ }} = {\rm{ }}0,35{\rm{ }}(mol){\rm{ }} = > V = n:{C_M}} {\rm{ }} = {\rm{ }}0,35{\rm{ }}:{\rm{ }}0,1{\rm{ }} = {\rm{ }}3,5{\rm{ }}(l)\) Câu hỏi 9 : Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B + V1 dung dịch axit có PH = 5 $${\rm{ = > [}}{{\rm{H}}^ + }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{{H^ + }}}{\rm{ }} = {\rm{ 1}}{{\rm{0}}^{ - 5}}.{V_1}{\rm{ }}(mol)$$ + V2 dung dịch bazơ có PH = 9 => pOH = 14− 9 = 5 $${\rm{ = > [O}}{{\rm{H}}^ - }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{O{H^ - }}}{\rm{ }} = {\rm{ }}{10^{ - 5}}.{V_2}{\rm{ (mol)}}$$ +Dung dịch thu được có PH=6 môi trường axit. Vậy H+ dư sau phản ứng H+ + OH− → H2O Ban đầu (mol) 10−5V1 10−5V2 Phản ứng ( mol) 10−5V2 10−5V2 Sau (mol) 10−5 (V1 −V2) − + Ta có : PH =6 => [H+] dư = 10−6 $${{{{10}^{ - 5}}({V_1} - {\rm{ }}{V_2})} \over {{V_1} + {V_2}}} = {10^{ - 6}} = > {{{V_1}} \over {{V_2}}} = {{11} \over 9}{\rm{ = > B}}$$ Câu hỏi 10 : pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M ( =4,25%)
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A
Câu hỏi 11 : Trộn 50 ml dung dịch HCl 0,12M với 50 ml dung dịch NaOH 0,1M thu được dung dịch X. pH dung dịch X là?
Đáp án: B Phương pháp giải: Lời giải chi tiết: nH+ = nHCl = 0,006 nOH- = nNaOH = 0,005 Khi pha trộn: H+ + OH- → H2O => nH+ dư = 0,001 => [H+] = 0,001/0,1 = 0,01 => pH = 2 Đáp án B Câu hỏi 12 : Dung dịch Ba(OH)2 0,05M có pH là:
Đáp án: A Phương pháp giải: [OH-] = 2CM Ba(OH)2 => pOH = -log[OH-] => pH = 14 - pOH Lời giải chi tiết: [OH-] = 2CM Ba(OH)2 = 0,1M => pOH = -log(0,1) = 1 => pH = 14 - 1 = 13 Đáp án A Câu hỏi 13 : Cho dung dịch X gồm HNO3 và HCl có pH = 1. Trộn V ml dung dịch Ba(OH)2 0,025M với 100 ml dung dịch X thu được dung dịch Y có pH = 2. Giá trị V là:
Đáp án: A Phương pháp giải: Tính theo PT ion rút gọn: H+ + OH- → H2O Lời giải chi tiết: Dung dịch sau phản ứng có pH = 2 < 7 => H+ dư nH+ bđ = 0,1.10-1 = 0,01 mol nOH- bđ = 2nBa(OH)2 = 2.10-3V.0,025 = 5.10-5V (mol) PT ion: H+ + OH- → H2O Bđ: 0,01 5.10-5V (mol) Pư: 5.10-5V ← 5.10-5V (mol) Sau: 0,01-5.10-5V 0 Dung dịch sau có pH = 2 => \(\left[ {{H^ + }} \right] = \frac{{0,01 - {{5.10}^{ - 5}}V}}{{0,1 + {{10}^{ - 3}}V}} = {10^{ - 2}}\) => V = 150 ml Đáp án A Câu hỏi 14 : Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) thu được dung dịch có pH = 6. Tỉ lệ V1/V2 là bao nhiêu? Phương pháp giải: Dung dịch axit có pH = 5 => [H+] = 10-5M => nH+ = 10-5V1 (mol) Dung dịch kiềm có pH = 9 => pOH = 5 => [OH-] = 10-5M => nOH- = 10-5V2 (mol) Dung dịch sau phản ứng có pH = 6 < 7 => H+ dư, OH- hết PT ion: H+ + OH- → H2O Bđ: 10-5V1 10-5V2 Pư: 10-5V2 ← 10-5V2 Sau: 10-5(V1-V2) 0 Từ pH của dung dịch sau phản ứng ta lập được phương trình biểu diễn mối liên hệ giữa V1 và V2 => V1/V2 Lời giải chi tiết: Dung dịch axit có pH = 5 => [H+] = 10-5M => nH+ = 10-5V1 (mol) Dung dịch kiềm có pH = 9 => pOH = 5 => [OH-] = 10-5M => nOH- = 10-5V2 (mol) Dung dịch sau phản ứng có pH = 6 < 7 => H+ dư, OH- hết PT ion: H+ + OH- → H2O Bđ: 10-5V1 10-5V2 Pư: 10-5V2 ← 10-5V2 Sau: 10-5(V1-V2) 0 => \(\left[ {{H^ + }} \right] = \frac{{{{10}^{ - 5}}\left( {{V_1} - {V_2}} \right)}}{{{V_1} + {V_2}}} = {10^{ - 6}}\) => 10(V1 - V2) = V1 + V2 => 9V1 = 11V2 => V1/V2 = 11/9 Câu hỏi 15 : Dung dịch H2SO4 0,005M có giá trị pH là bao nhiêu ?
Đáp án: A Phương pháp giải: [H+] = 2.CM H2SO4 = ? => pH = -log[H+] = ? Lời giải chi tiết: [H+] = 2.CM H2SO4 = 0,01M => pH = -log[H+] = -log(0,01) = 2 Đáp án A Câu hỏi 16 : Một dung dịch có [OH-] = 0,1.10-6 M. Môi trường của dung dịch này là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: pH = 14 - log[OH-] = 14 - log[0,1.10-6] = 7 Vậy dung dịch đó có MT trung tính. Đáp án C Câu hỏi 17 : Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a mol/l thu được 200 ml dung dịch có pH = 12. Giá trị của a là
Đáp án: D Phương pháp giải: Tính số mol H+ có trong dd axit ban đầu theo pH Lời giải chi tiết:
Hướng dẫn giải : Dd axit ban đầu có [H+] =0,1 M → nH+=0,1.0,1 =0,01 mol Dd sau phản ứng có pH = 12 → dư bazo và có pOH =14-12=2 → [OH-] =0,01M→ nOH = 0,002 mol PTHH: H+ + OH- → H2O Ta có nNaOH = nH+ + nOH dư = 0,01 + 0,002 = 0,012 mol → a = 0,12M Đáp án D Câu hỏi 18 : Cho 10 ml dung dịch HCl có pH = 3. Cần thêm vào dung dịch này bao nhiêu ml nước để thu được dung dịch có pH = 4.
Đáp án: B Phương pháp giải: Lời giải chi tiết: nHCl bđ = V. CM = 10.10-3. 10-pH = 10-5 pHsau = 4 => CM sau = 10-4 M => Vsau = n : CM = 0,1 lit = 100 ml => Vthêm = 100 – 10 = 90 ml Đáp án B Câu hỏi 19 : Cần lấy bao nhiêu gam Ba(OH)2 rắn cho vào 100 ml nước để được dung dịch có pH = 12?
Đáp án: B Phương pháp giải: Từ pH xác định được pOH => Nồng độ của OH- => Số mol OH- Do Ba(OH)2 là chất điện li hoàn toàn nên ta có: => nBa(OH)2 = 0,5.nOH- = ? => mBa(OH)2 = ?
Lời giải chi tiết: pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10-pOH = 0,01M => nOH- = 0,01.0,1 = 0,001 mol Do Ba(OH)2 là chất điện li hoàn toàn nên ta có: => nBa(OH)2 = 0,5.nOH- = 0,5.0,001 = 0,0005 mol => mBa(OH)2 = 0,0005.171 = 0,0855g Đáp án B Câu hỏi 20 : Trộn dung dịch X chứa NaOH 0,1M, Ba(OH)2 0,2M với dung dịch Y chứa HCl 0,2M, H2SO4 0,1M theo tỉ lệ nào về thể tích để dung dịch thu được có pH = 13?
Đáp án: A Phương pháp giải: nOH- = nNaOH + 2nBa(OH)2 = 0,1VX + 2.0,2VX = 0,5VX (mol) nH+ = nHCl + 2nH2SO4 = 0,2VY + 2.0,1VY = 0,4VY (mol) Từ giá trị pH tính được nồng độ của OH- H+ + OH- → H2O Bđ: 0,4VY 0,5VX Pư: 0,4VY → 0,4VY Sau: 0 0,5VX - 0,4VY => \(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{{{V_X} + {V_Y}}} \Leftrightarrow \frac{{0,5{V_X} - 0,4{V_Y}}}{{{V_X} + {V_Y}}} = 0,1\) => VX : VY = ? Lời giải chi tiết: nOH- = nNaOH + 2nBa(OH)2 = 0,1VX + 2.0,2VX = 0,5VX (mol) nH+ = nHCl + 2nH2SO4 = 0,2VY + 2.0,1VY = 0,4VY (mol) Ta thấy: pH = 13 > 7 => OH- dư, H+ hết => pOH = 14 - 13 = 1 => [OH-] = 10-1 = 0,1M H+ + OH- → H2O Bđ: 0,4VY 0,5VX Pư: 0,4VY → 0,4VY Sau: 0 0,5VX - 0,4VY => \(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{{{V_X} + {V_Y}}} \Leftrightarrow \frac{{0,5{V_X} - 0,4{V_Y}}}{{{V_X} + {V_Y}}} = 0,1\) => 0,5VX - 0,4VY = 0,1VX + 0,1VY => 0,4VX = 0,5VY => VX : VY = 5 : 4 Đáp án A
|