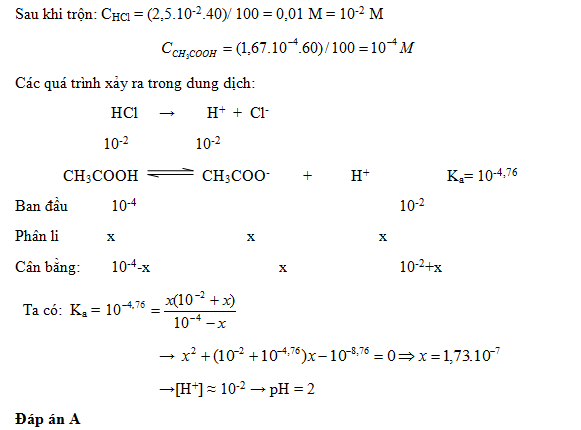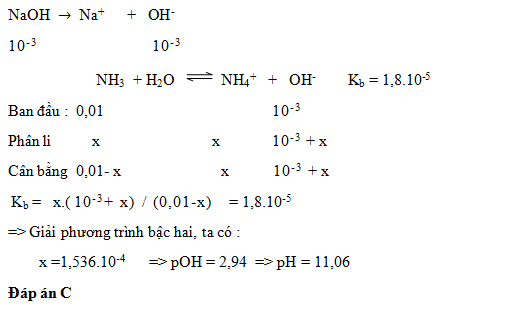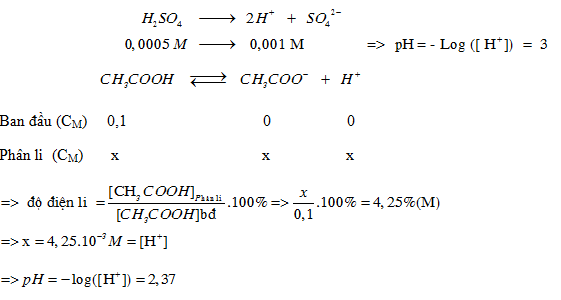10 bài tập vận dụng cao về tính pH có lời giải (phần 1)Làm bàiCâu hỏi 1 : Tính pH của dung dịch thu được khi trộn 40 ml dung dịch HCl 2,5.10-2 M với 60 ml dung dịch CH3COOH 1,67.10-4 M.Biết CH3COOH có Ka=10-4,76.
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 2 : Tính pH của dung dịch gồmNaOH 10-3M và NH3 10-2M (NH3 có Kb = 1,8.10-5 )
Đáp án: C Phương pháp giải: Lời giải chi tiết:
Câu hỏi 3 : Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B + V1 dung dịch axit có PH = 5 $${\rm{ = > [}}{{\rm{H}}^ + }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{{H^ + }}}{\rm{ }} = {\rm{ 1}}{{\rm{0}}^{ - 5}}.{V_1}{\rm{ }}(mol)$$ + V2 dung dịch bazơ có PH = 9 => pOH = 14− 9 = 5 $${\rm{ = > [O}}{{\rm{H}}^ - }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{O{H^ - }}}{\rm{ }} = {\rm{ }}{10^{ - 5}}.{V_2}{\rm{ (mol)}}$$ +Dung dịch thu được có PH=6 môi trường axit. Vậy H+ dư sau phản ứng H+ + OH− → H2O Ban đầu (mol) 10−5V1 10−5V2 Phản ứng ( mol) 10−5V2 10−5V2 Sau (mol) 10−5 (V1 −V2) − + Ta có : PH =6 => [H+] dư = 10−6 $${{{{10}^{ - 5}}({V_1} - {\rm{ }}{V_2})} \over {{V_1} + {V_2}}} = {10^{ - 6}} = > {{{V_1}} \over {{V_2}}} = {{11} \over 9}{\rm{ = > B}}$$ Câu hỏi 4 : pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M ( =4,25%)
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A
Câu hỏi 5 : Trộn 300ml dung dịch có pH = 2 gồm HCl và HNO3với 300ml dung dịch NaOH nồng độ a (mol/l) thu được 600 ml dung dịch có pH = 11. Giá trị của a là:
Đáp án: A Phương pháp giải: + Tính ∑nH+ ; + pH >7 => dư bazơ + pH = x => [H+] = 10-x + Viết phương trình ion rút gọn: H+ + OH- → H2O + Tính toán theo phương trình Lời giải chi tiết: pH = 11 => OH- dư sau phản ứng => pOH =3 \( = > {{\text{[O}}{{\text{H}}^{\text{ - }}}{\text{]}}_{{\text{sau}}}}{\text{ = 1}}{{\text{0}}^{{\text{ - 3}}}}{\text{ = }}\frac{{{n_{O{H^ - }sau}}}}{{{V_{sau}}}}\) => nOH- sau = Vsau . [OH-] = 10-3. 0,6= 0,0006 = 6.10-4 (mol) pH = 2 => [H+]= 10-2 = 0,01M => nH+= 0,3 . 0,01= 0,003 nOH- = 0,3.a H+ + OH- → H2O Ban đầu: 0,003 0,3.a Phản ứng: 0,003 0,003 Sau: 0 0,3.a-0,003 nOH- sau= 6.10-4 = 0,3a -0,003 => a=0,012M Đáp án A Câu hỏi 6 : Trộn 150ml dung dịch có pH = 3 gồm HCl và HNO3với 150ml dung dịch NaOH nồng độ a (mol/l) thu được 300 ml dung dịch có pH = 5. Giá trị của a là:
Đáp án: B Phương pháp giải: + Tính ∑nH+ ; + pH < 7 => dư axit + pH = x => [H+] = 10-x + Viết phương trình ion rút gọn: H+ + OH- → H2O + Tính toán theo phương trình Lời giải chi tiết: pHsau = 5 => H+ dư sau phản ứng \({{\text{[}}{H^ + }{\text{]}}_{sau}} = {10^{ - 5}} = \frac{{{n_{{H^ + }sau}}}}{{{V_{sau}}}}\) => nH+ sau = Vsau . [H+] = 10-5. 0,3= 3.10-6 (mol) pH = 3 => [H+]= 10-3 = 0,001M => nH+= 0,15 . 0,001= 1,5 . 10-4 nOH- = 0,15.a \({H^ + } + O{H^ - } \to {H_2}O\) Ban đầu: 1,5 .10-4 0,15.a Phản ứng: 0,15a 0,15a Sau: 1,5.10-4-0,15a 0 nH+ sau= 3.10-6 = 1,5.10-4 - 0,15a => a=9,8.10-4M Đáp án B Câu hỏi 7 : Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1M và CH3COONa 0,1M, Biết ở 25oC, Ka của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25oC là:
Đáp án: D Phương pháp giải: Ka = [CH3COO-][H+]/[CH3COOH] Lời giải chi tiết: CH3COONa → CH3COO- + Na+ 0,1 0,1 CH3COOH ↔ CH3COO- + H+ Ka = 1,75.10-5 Bđ: 0,1 0,1 Phân li:x x x CB: 0,1-x 0,1+x x Ka = [CH3COO-][H+]/[CH3COOH] => (0,1+x).x/(0,1-x)= 1,75.10-5 => x = 1,7493878.10-5 => pH = -logx = 4,757 Đáp án D Câu hỏi 8 : Thêm nước vào 10,0ml axit axetic băng (axit 100%; D=1,05g/ml) đến thể tích 1,75 lít ở 25oC, dùng máy đo thì thấy pH=2,9. Độ điện li α và hằng số cân bằng Ka của axit axetic ở nhiệt độ đó là
Đáp án: C Phương pháp giải: Lời giải chi tiết: mCH3COOH = D.V = 1,05.10 = 10,5 gam=>nCH3COOH = 10,5/60 = 0,175 mol pH = 2,9 => [H+] = 10-2,9 => nH+ = 10-2,9.1,75 = 0,0022 mol CH3COOH ↔ CH3COO- + H+ Bđ: 0,175 Pli: 0,175α 0,175α 0,175α =0,0022 CB: 0,175(1- α) 0,175α 0,175α => α = 1,26% Ka = [CH3COO-][H+]/[CH3COOH] = 0,00222/(0,175-0,0022) = 2,8.10-5 Đáp án C Câu hỏi 9 : Có V lít dung dịch NaOH pH = 12. Khi pha loãng dung dịch này 10 lần ( thêm 9V H2O vào ) thì dung dịch thu được có pH bằng
Đáp án: A Phương pháp giải: Có pH +pOH = 14 → pOH = 2 → [NaOH] Khi pha loãng dung dịch đi 10 lần thì [NaOH] mới = 1/10 .[NaOH]cũ → pOH =? → giá trị của pH Lời giải chi tiết: Có pH +pOH = 14 → pOH = 2 → [NaOH] = 10-2 = 0,01M Khi pha loãng dung dịch đi 10 lần thì [NaOH] mới = 1/10 .[NaOH]cũ = 1/10.0,01 = 0,001 M → pOH = - log 0,001 = 3 → pH = 11 Đáp án A Câu hỏi 10 : Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dung dịch Ba(OH)2 a mol/l thu được m gam kết tủa và 500 ml dung dịch có pH = 12. Giá trị của m và a là
Đáp án: A Phương pháp giải: - Dựa vào số mol các chất ban đầu tính được số mol các ion: H+, OH- (theo a), SO42-, Ba2+ (theo a). - Dung dịch sau phản ứng có pH = 12 > 7 → OH- dư, H+ phản ứng hết Tính được nồng độ của OH- sau phản ứng. - Tính toán theo PT ion rút gọn tìm được giá trị của a. - Xét phản ứng của ion Ba2+ và SO42- tính được khối lượng kết tủa BaSO4. Lời giải chi tiết: Tính được: \({n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}} = 0,025(mol)\) \({n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} = 0,5{\rm{a}}(mol)\) \({n_{S{O_4}^{2 - }}} = {n_{{H_2}S{O_4}}} = 0,0025(mol)\) \({n_{B{a^{2 + }}}} = {n_{Ba{{(OH)}_2}}} = 0,25{\rm{a}}(mol)\) Dung dịch sau phản ứng có pH = 12 > 7 → OH- dư, H+ phản ứng hết → pOH = 14 - pH = 2 → [OH-] = 10-2 = 0,01M PT ion: H+ + OH- → H2O Bđ: 0,025 0,5a (mol) Pư: 0,025 → 0,025 (mol) Sau: 0 0,5a-0,025 (mol) Ta có: \({\rm{[}}O{H^ - }{\rm{]}} = \frac{{0,5{\rm{a}} - 0,025}}{{0,5}} = 0,01 \to a = 0,06\) \( \to {n_{B{a^{2 + }}}} = 0,25{\rm{a}} = 0,015(mol);{n_{S{O_4}^{2 - }}} = 0,0025(mol)\) PT ion: Ba2+ + SO42- → BaSO4 ↓ Bđ: 0,015 0,0025 (mol) Pư: 0,0025 ← 0,0025 → 0,0025 (mol) → m = 0,0025.233 = 0,5825 gam Đáp án A
|